汤逊湖·南湖及墨水湖底泥沉积物中氮磷的释放特征
林子阳,姜应和*,程润喜,胡 芳,周 欢,陈铭楷
(1.武汉理工大学土木工程与建筑学院,湖北武汉 430070;2.路德环境科技股份有限公司,湖北武汉 430000)
汤逊湖位于武汉市东南部,水域面积达47.62 km2,横跨江夏区、洪山区和东湖新技术开发区,是武汉最大的城中湖;南湖位于武昌南部,水域面积达7.67 km2,是武汉市第三大的城中湖;墨水湖位于汉阳西南,水域面积达3.64 km2,为浅水湖泊。随着湖泊周边城市发展,各类污染物排入湖中,造成水体污染。水中营养盐通过一系列理化作用,逐渐蓄积于湖泊底泥之中。其中,氮、磷等营养盐是湖泊底泥营养盐的主要组成部分,对水体环境影响极大。在外界环境的影响下,底泥中的氮磷元素部分被沉水植物吸收,重新参与物质循环;部分以闭蓄态或结合态的形式稳定存在,难以被释放;部分通过扩散作用重新进入上覆水中,造成二次污染[1]。这部分重新被释放的氮磷元素,也是湖泊水体治理水质难以根本好转的主因之一。
底泥中氮磷的释放是一个物理、化学和生物综合作用的过程,其释放、累积和输送遵循一定的规律[2]。底泥中氮磷的释放受到如DO、温度、pH、上覆水污染物浓度等因素的影响[3]。笔者以汤逊湖、南湖和墨水湖为研究对象,采用实验室静态模拟法对底泥氮磷释放规律进行研究。
1 材料与方法
1.1 样品的采集将带上覆水和底泥的柱样定义为A类试验柱样,不带上覆水的底泥柱样定义为B类试验柱样。在汤逊湖(114°23′E,30°25′N)、南湖(114°21′E,30°30′N)和墨水湖(114°14′E,30°32′N)各设一个取样点,每一取样点取1个A类试验柱样和2个B类试验柱样。A类试验柱样取样管长为2.5 m,上覆水采样深度不小于1.5 m,底泥采样深度不小于70 cm;B类试验柱样取样管长为1.5 m,底泥采样深度不小于1.0 m。取样点具体位置如图1所示。
图1 采样点分布Fig.1 Distribution of sampling points
1.2 样品的处理各试验柱样被带回试验室后,将A类试验柱样的上覆水用虹吸管调整至相同深度(上覆水深度为1.5 m)。对上覆水进行测量所得各理化指标如表1所示。
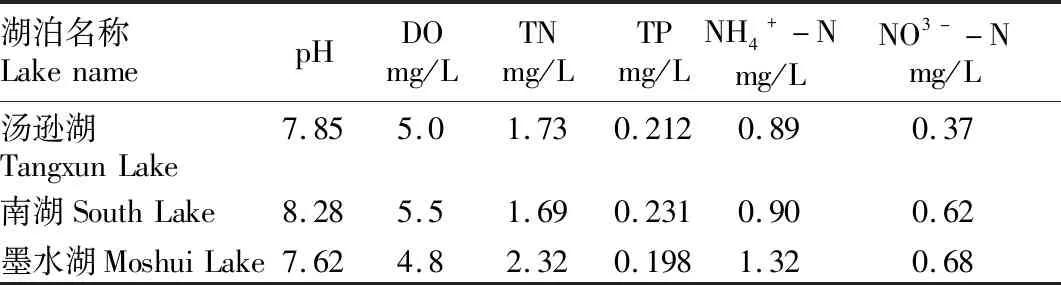
表1 各湖泊上覆水理化指标Table 1 Physical and chemical indicators of overlying water in each lake
对B类试验柱样的表层(0~5 cm)底泥进行采样,吸除水分后置于阴凉处自然风干,研磨后过100目筛,保存在聚乙烯袋中备用。测得底泥TN、TP含量如表2所示。
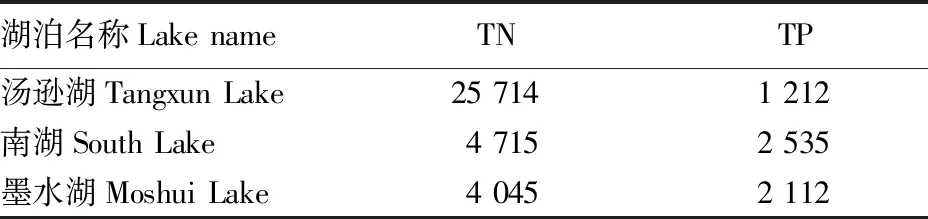
表2 各湖泊底泥中TN、TP含量Table 2 Contents of TN and TP in sediments in each lake 单位:mg/kg
1.3 底泥释放营养盐试验方法将从3个湖泊各取的1个A类试验柱样分别命名为汤逊湖、南湖和墨水湖试验柱。该试验采样时间为夏季,试验期间水温维持在(30±1)℃。将试验柱中原上覆水替换为蒸馏水。监测上覆水中DO、TN、NH4+-N、NO3--N和TP的变化,前期每隔 24 h 取样并检测,后期取样并检测的时间间隔为 48 h,每次采集水样后分别用蒸馏水补足。
累计释放量γ(mg)用以下公式计算[4]:
(1)
式中,V为试验柱中上覆水总体积(L);n为采样次数,n≥2,当n=1,仅取式右两项中的第一项;Vj为每次采集水样的体积(L);Cn为第n次采样时测出的营养盐浓度(mg/L);Cj为第j次采样时测出的营养盐浓度(mg/L);Ca为每次取样后补充水样中营养盐浓度(mg/L);C0为各类上覆水中营养盐的初始浓度(mg/L)。
1.4 水质检测方法上覆水中DO采用JPB-607A溶解氧仪测定。TN、NH4+-N、NO3--N和TP采用《水和废水监测分析方法(第四版)》提供的方法测定:TN 采用过硫酸钾氧化,紫外分光光度法测定;TP 采用钼酸铵分光光度法测定;NH4+-N采用纳氏试剂比色法测定;NO3--N采用紫外分光光度法测定。
2 结果与分析
2.1 上覆水中各指标的变化不同湖泊底泥条件下,上覆水中各指标的变化趋势如图2所示。由图2可知,3个试验柱中水样各指标的变化趋势基本一致。DO含量在10 d前持续下降,可能是好氧微生物的持续活动导致的[5];16 d后DO略有回升,此时其他营养盐浓度基本处于平衡阶段,水体环境相对稳定,说明存在一定程度的大气复氧。TN、NO3--N和TP均呈持续上升趋势,墨水湖试验柱的上覆水中TN浓度最高,汤逊湖试验柱次之,南湖试验柱最低;NO3--N浓度排序与TN一致;南湖试验柱的上覆水中TP浓度最高,汤逊湖试验柱次之,墨水湖试验柱最低。由表1可知,对于原上覆水而言,TN浓度表现为墨水湖>汤逊湖>南湖,与试验结果相符,且各试验柱中上覆水TN的最终浓度均小于各湖泊实测结果。这可能是因为在自然湖泊的上覆水环境内存在大量生物活动,以汤逊湖为例,现仍有相当规模的渔业养殖[6]。它们的代谢活动所产生的氮元素部分悬浮在上覆水中,进一步提高了TN的含量。TP浓度表现为南湖>汤逊湖>墨水湖,主要以溶解性磷酸盐(SRP)的形式存在[7],也与试验结果相符,但各试验柱中上覆水TP的最终浓度均大于各湖泊实测结果。该试验在夏季进行,气温较高,史静等[8]研究表明,温度对氮磷元素释放的影响类似,但对磷的影响更显著。且当温度升高到一定程度后,由于生物活性不再提高,氮的释放不再明显增强,而磷由于氧化还原电位的降低和含磷沉积物溶解加快等原因,释放更为明显[9]。而自然水体中存在藻类及沉水植物对溶解性磷酸盐的吸收,降低了环境中磷的浓度,所以各湖泊TP的实测数据会低于试验条件下释放的TP。NH4+-N表现出先上升后下降的趋势,这可能与底泥中有机氮转化为氨氮和硝化反应有关。
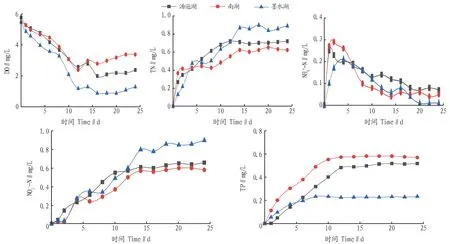
图2 各试验柱上覆水各指标随时间变化曲线Fig.2 Variation curve of various indicators of overlying water on each test column with time
2.2 上覆水中氮类营养盐变化不同湖泊底泥条件下,上覆水中各类含氮营养盐变化如图3所示。由图3可知,各试验柱中TN绝大部分由NO3--N组成。说明氮元素主要以无机氮的形式向上覆水中释放,难以以有机氮的形式释放。在试验初期,各试验柱均出现NH4+-N浓度迅速上升的趋势,这可能是由于在向试验柱内注入蒸馏水的过程中,对底泥造成了一定扰动,且试验初期水体中溶解氧充足。这可能是因为底泥中存在好氧微生物将有机氮转化为氨氮[10]。在前10 d,水体中溶解氧持续下降,NH4+-N也持续下降,NO3--N则持续上升,说明水体中存在硝化反应将NH4+-N转化为NO3--N。但也可以看出,NO3--N增长的量大于NH4+-N减少的量,说明底泥仍在向上覆水中释放NO3--N或释放NH4+-N并转化为NO3--N。陶玉炎等[11]研究表明,溶解氧缺乏的条件下,沉积物氮主要以NH4+-N形式释放,溶解氧充足条件下,沉积物氮主要以NO3--N形式释放。王圣瑞等[12]研究表明,底泥中可释放的氮主要以NO3--N的形式存在;且由于土壤带负电荷,铵根带正电荷,易被土壤吸附难以释放,而硝酸根带负电荷,更容易释放。
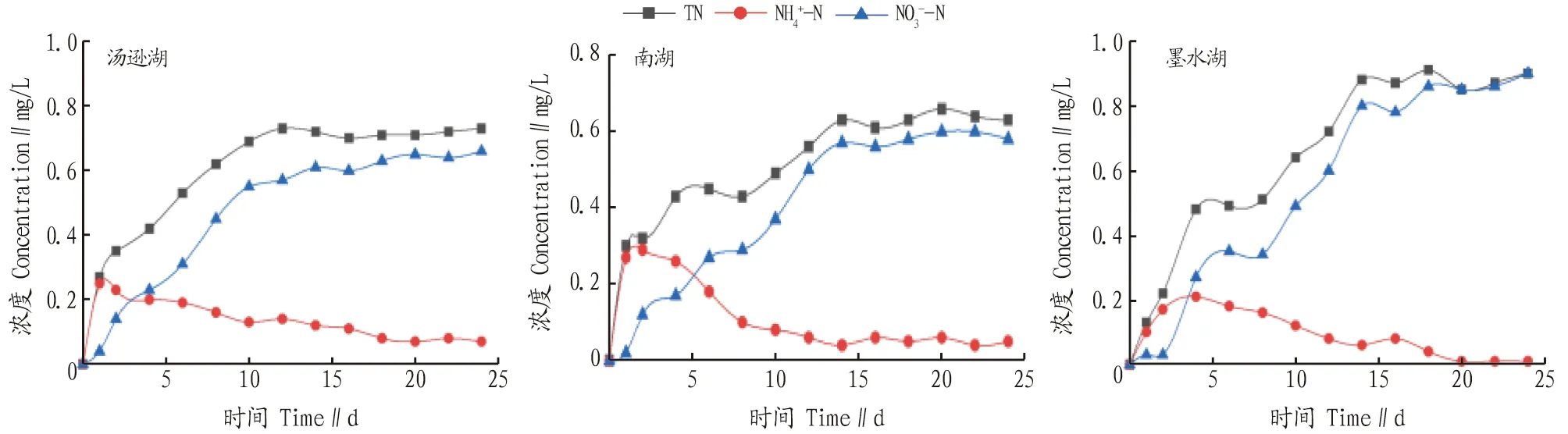
图3 各试验柱上覆水含氮营养盐随时间变化曲线Fig.3 Variation curve of nitrogen containing nutrient salts in the overlying water of each test column with time
2.3 上覆水中TN、TP累计释放量的变化从各试验柱上覆水中TN和TP累计释放量的变化趋势(图4)可以看出,不同湖泊底泥氮磷的累计释放量变化趋势基本相同。由于释放强度受上覆水与底泥间的浓度差影响,根据Fick第一扩散定律[13],在静态释放条件下,由于底泥-水界面浓度梯度的影响,底泥TN和TP的释放速率在初期最大,随时间的延续,释放速率逐渐降低[14],则累计释放量的增长也由陡变缓;最终,随着浓度差的不断缩小,扩散作用不断减弱,上覆水与底泥间逐渐达到某个平衡点,累计释放量不再明显增长,呈现出动态平衡状态。试验结束时墨水湖TN的累计释放量最大,说明墨水湖可能具有更大的氮释放能力;南湖TP的累计释放量最大,说明南湖可能具有更大的磷释放能力。
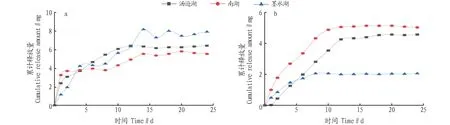
图4 各试验柱上覆水TN(a)和TP(b)累计释放量随时间变化曲线Fig.4 Variation curve of cumulative release amount of TN (a) and TP(b) in the overlying water of each test column with time
2.4 底泥沉积物氮磷存在形态对释放的影响底泥中的氮磷元素并不都具有向上覆水中释放的潜力。不同湖泊表层底泥TN中可转化态氮(TAN、TTN)及TP中易转化态磷占比区别均较大。王圣瑞等[12]对太湖等长江中下游湖泊的表层底泥测量发现,TN中可交换氮(EN)占比为6.29%~19.24%;对太湖和武汉月湖表层底泥的研究发现,TN中TAN的占比随粒径的降低而升高[15],其中最容易释放的IEF-N是可转化态无机氮的主体,占总可转化态氮的7.37%~22.25%。赵宝刚等[16]研究发现骆马湖等4个湖泊表层底泥TN中TAN占比均值为50.93%~73.10%,IEF-N占TTN的6.74%~8.82%。叶华香等[17]对南山湖表层底泥测量发现,潜在可移动形态磷占TP的54.06%。马金玉等[18]研究表明,最易释放的EX-P占华阳河湖群表层底泥TP的0.4%~4.9%。周帆琦等[19]测得武汉南湖与东湖表层底泥TP中EX-P占比为3%~11%。上述试验均表明,不同湖泊的表层底泥具有各自的形态分布特征,TN、TP中具有释放潜力的部分占比也因湖泊环境和外源输入的不同而有差异。
此次试验测得3个湖泊表层(0~5 cm)底泥的干重约为166 g,根据表2的各湖泊底泥TN、TP含量计算得出的各湖泊累计释放量占表层底泥内氮磷含量的比值如表3所示。从表3可以看出,该试验中各湖泊底泥氮磷累计释放量仅占表层底泥氮磷含量的极少部分,显然低于潜在可释放的氮磷总量。大量可释放的氮磷留存在底泥中,形成内源污染,使得湖泊水质情况难以好转,持续呈现富营养化。通过2016—2020年武汉水务局发布的武汉市水资源公报[20-24]可知,汤逊湖水质条件为Ⅴ类,中度富营养化,水质变化稳定;南湖水质条件仍为劣Ⅴ类,中度富营养化;墨水湖水质条件由劣Ⅴ类转为Ⅴ类,中度富营养化,水质有所好转。这说明底泥中大量富集的氮磷营养盐对湖泊环境的治理仍形成较大阻碍。
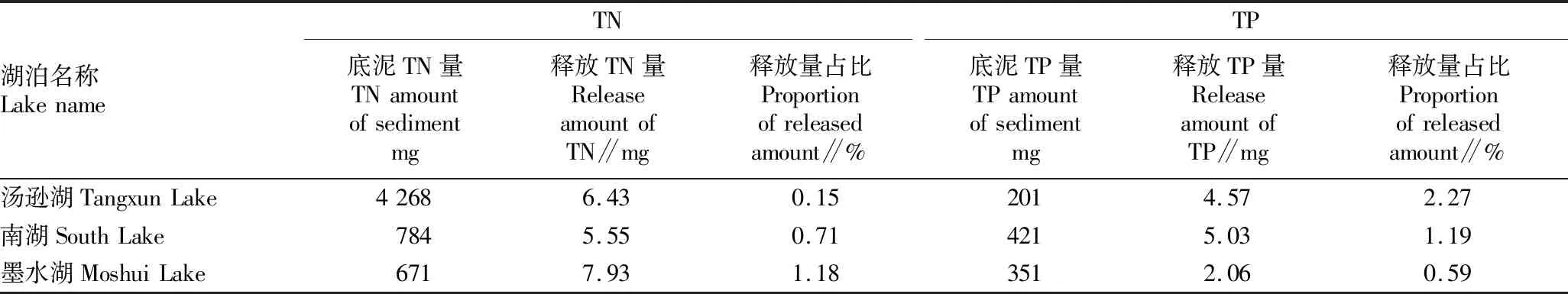
表3 各湖泊累计释放量占比Table 3 The proportion of cumulative release of each lake
3 结论
(1)夏季环境下各湖泊底泥样本向上覆水中释放的氮主要以NO3--N的形式存在,墨水湖底泥向上覆水中释放的氮最多,有较强的释放能力;南湖底泥向上覆水中释放的磷最多,有较强的释放能力。在未来的治理计划中可针对各湖泊不同的释放特点进行针对性治理。
(2)各湖泊底泥具备释放潜力的氮磷元素占比具有不同特征,最终呈现出的释放总量不一定由不同湖泊底泥间的氮磷总量简单决定。此次试验中向上覆水释放的氮磷含量仅占底泥氮磷总量的极少部分,说明汤逊湖、南湖和墨水湖底泥均具有较大的氮磷释放潜力,这也是导致各湖泊富营养化的主因之一。

