梨萼片脱落过程中木质素生物合成与活性氧代谢的关联分析
潘琦 王浩 齐开杰 谢智华 崔艳波 包建平 张绍铃 陶书田


摘要:利用DPI、H2O2、DPI+H2O2对梨幼果萼筒部位进行处理,随后对离区细胞进行观察,此外对样品进行液氮速冻,通过测定萼片离区木质素和活性氧代谢相关指标,研究萼片离区内的木质素生物合成过程与活性氧代谢间是否存在协同作用。结果表明,离层对DPI的抑制效果始终敏感,DPI可以通过降低过氧化氢含量来减少木质素含量,外源过氧化氢在处理的早期没有显著作用,而在后期可以促进离层内源过氧化氢形成,从而减缓DPI的抑制效果。皮尔森相关系数表明,萼筒离层中活性氧代谢相关指标与木质素生物合成指标呈正比例关系,特别是过氧化氢在离层中的累积可以促进细胞壁增厚。
关键词:萼片脱落;活性氧代谢;木质素合成;关联分析
中图分类号:S661.201 文献标志码:A
文章编号:1002-1302(2023)23-0157-08
梨是我国生产上的第3大果树,属于蔷薇科苹果亚科梨属植物,其栽培面积、产量、出口量均占世界第一[1]。在通常情况下,植物经过花期,萼片会自然脱落,但也存在萼片宿存的情况[2]。果实的萼片脱落与宿存是衡量梨果实外观品质的重要特征之一,宿萼果实的残留萼片不仅会影响外观,造成果面粗糙,而且还与梨的石细胞含量呈明显正相关关系,而脱萼果果面光滑整洁,石细胞含量少,口感较好[3-6]。梨果实的萼片脱落属于器官脱落的一种表现形式,其遵循器官脱落的发生规律,都需要在脱落部位形成离区。张俊超研究发现,老芒麦种子离区细胞紧凑排列,且这些细胞木质化程度高于周围组织细胞[7]。Lee等研究报道,植物体实际分离后,在离层的远端形成木质化保护层,这种木质化过程受到活性氧代谢的调控[8]。其中,过氧化氢作为重要的活性氧之一,也是活性氧相互转化的关键枢纽[9]。在棉花纤维次生细胞壁分化过程中,过氧化氢起到关键促进作用,而抑制过氧化氢的产生会延缓细胞壁的发育过程[10]。Huang等研究发现细胞木质化过程经常伴随着活性氧的暴发,水稻根结线虫感染过程中,可以观察到木质素和过氧化氢二者同时大量累积[11]。在逆境条件下,活性氧同样参与木质素合成的累积过程。例如Donnini等研究发现,缺铁环境会导致梨根系活性氧含量增加,并引起根系的木质化[12];铜胁迫条件下,DPI显著抑制水稻根系中过氧化物酶的活性及减少木质素的含量,而外源H2O2处理显著增加了根中木质素含量,证明了过氧化氢在铜胁迫条件下木质素合成中的关键作用[13]。同时,木质素合成需要在过氧化物酶/漆酶的作用下,将不同的木质素单体聚合而形成木质素,这个过程中过氧化物酶主要以过氧化氢作为电子接受体来发生反应[14]。Shigeto等研究报道,在拟南芥中AtPrx2、AtPrx71和AtPrx25的单一或双重突起会减少木质素的积累而不影响植物高度[15-16]。Fagerstedt等利用RNA干擾方法证明了不同的过氧化物酶对木质素含量的不同影响[17-18]。鉴于其他文献报道中木质化和活性氧之间的关系,本研究将在离区形成过程中,通过活性氧抑制剂处理及回补试验,来探明萼片脱落中活性氧代谢和木质素生物合成的关联。
1 材料与方法
1.1 材料与样本采集
试验材料为种植于南京农业大学梨工程技术研究中心南京湖熟种质资源圃的库尔勒香梨,在盛花期后0、5、15、20 d,用预先准备好的蒸馏水、150 μmol/L DPI、3 mmol/L H2O2和150 μmol/L DPI+3 mmol/L H2O2溶液处理库尔勒香梨幼果萼筒。处理方法为用无菌微量注射器吸取不同的抑制剂,从果柄处沿着维管束向萼筒部位进行注射。处理后每7 d进行取样,并置于液氮中速冻;取样时应选取每株中10~15个发育良好且无病害的梨幼果萼筒部位,满足3次生物学重复。样品装于冻存管中并放置于-80 ℃冰箱贮藏,用于后续指标测定。
1.2 测定指标与方法
1.2.1 木质素相关指标的测定
木质素含量:参照Tao等的方法[19]采用乙酰溴法进行测定。
石细胞含量:参照Tao等的方法[19]采用冷冻-盐酸法进行测定。
间本三酚染色:将1%间本三酚(溶于80%乙醇)和30% HCl(v/v)混合,将样品浸泡在混合液中染色5 min,滴加NaOH中和反应,用清水洗去表面液体,利用Canon相机拍照。
木质素染色:参照刘若南的方法[20]采用番红固绿法进行染色。
细胞壁观察:参照张虎平的方法[21]采用透射电镜法进行观察。
1.2.2 活性氧相关指标测定
POD活性:采用过氧化物酶活性测定试剂盒(北京索尔比奥科技有限公司)测定。
过氧化氢含量:采用过氧化氢检测试剂盒(南京建成生物有限公司)测定。
1.3 数据处理
数据收集采用Excel 2010,统计分析与绘图采用GraphPad Prism 8.0,切片图片使用ImageJ统计分析,采用SPSS 25.0软件分析差异、相关性和方差的显著性。
2 结果与分析
2.1 脱萼果、宿萼果品质差异比较
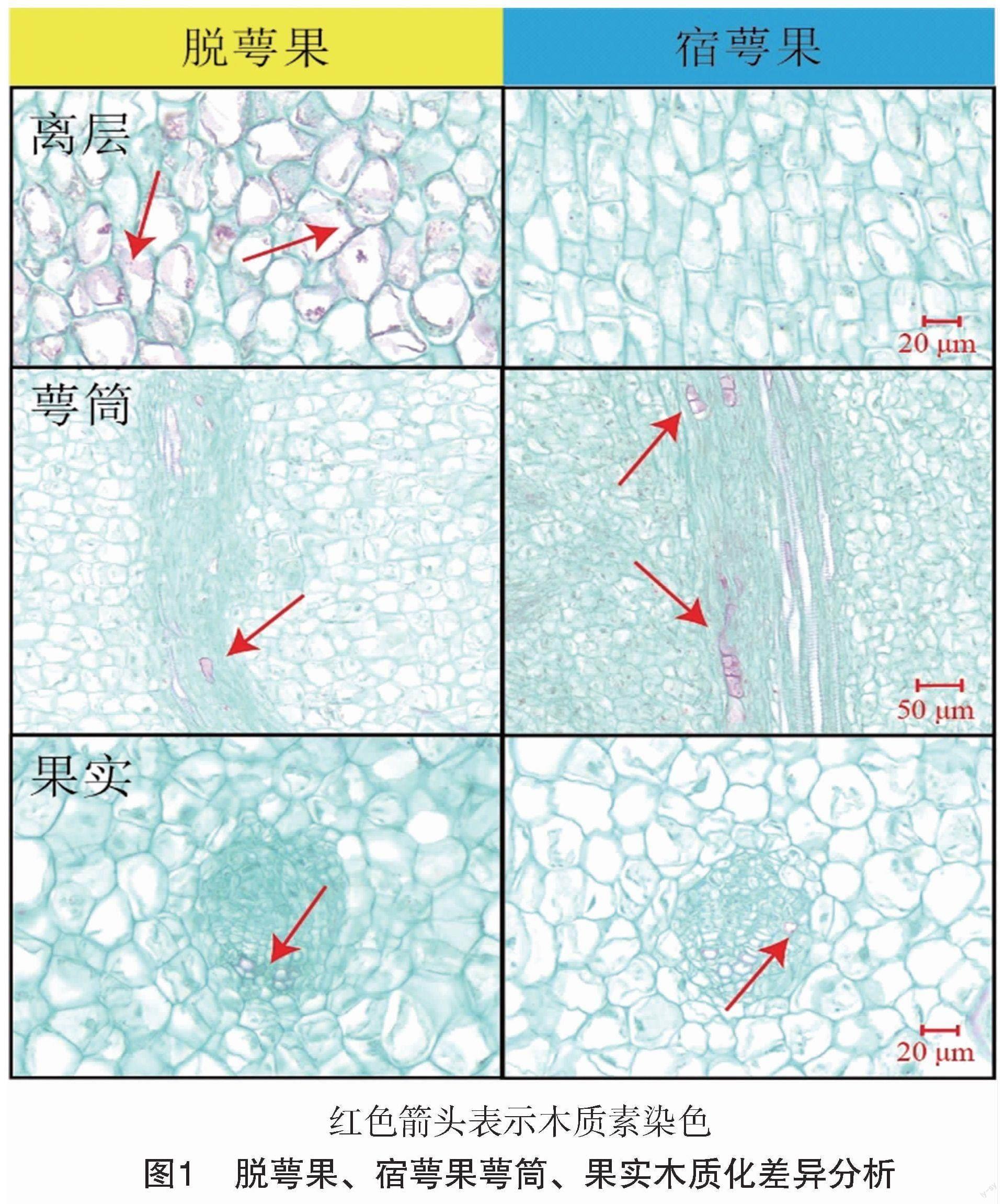
为了揭示脱萼性状产生的原因,对幼果早期中脱萼果和宿萼果进行组织部位观察。在脱萼过程中,脱萼果萼筒部位的维管束纵切直径显著窄于宿萼果,且脱萼果离层细胞相比于宿萼果要更早木质化(图1)。这是由于萼筒中直径更小的维管束更不利于运输营养物质,导致离层细胞的营养物质供应不充足,更容易产生木质化。然而,果实内部维管束的切片结果表明,脱萼果宿萼果幼果时期的维管束直径大小间并没有明显差异(图1)。因此,离层的木质化是影响脱萼的关键因素,且这种木质化与幼果萼筒基部至离层的维管束的发育密切关联。研究表明,过氧化氢可以参与棉花纤维次生细胞壁分化过程,同时抑制过氧化氢的产生会延缓细胞壁的发育过程[10]。因此笔者初步推测活性氧代谢可能与离层木质化关系密切,随即通过田间活性氧抑制剂回补试验来探明其中关系。
2.2 活性氧相关处理早期离区的指标变化
2.2.1 处理早期离区的木质化
对4个处理的梨果实萼筒进行纵切,并进行番红固绿染色。研究结果表明,在脱萼发生前期,离层细胞开始木质化,DPI、DPI+H2O2处理可以明显缩小离层细胞的木质化范围(图2-B、图2-D)。然而,对离层细胞进行透射电镜观察,仅在DPI处理发现离层细胞的细胞壁出现增厚缓慢的现象(图3-B)。从木质素含量的测定结果来看,DPI处理下木质素含量极显著降低,而H2O2和DPI+H2O2处理对木质素含量没有产生显著影响(图4-A)。DPI处理对木质素的抑制效果,不仅是细胞水平上抑制细胞壁增厚,同时也减少萼筒离区的木质化细胞数量(图5)。以上结果表明,DPI抑制早期离区木质素生物合成,而过氧化氢处理在这一时期对木质素合成的影响不显著。
2.2.2 处理早期离区的活性氧变化
内源过氧化氢含量测定结果表明,外源H2O2、DPI和DPI+H2O2处理在7 d后均没有改变内源过氧化氢水平(图4-B)。POD活性在DPI处理下极显著降低,这直接导致了单体木质素聚合的过程受到显著影响,才使得其在这个时间段木质素含量极显著降低;而外源H2O2处理导致POD活性极显著升高,DPI+H2O2处理导致POD活性极显著降低,但这些变化并未改变木质素含量。这说明单体木质素聚合过程不仅仅受到POD活性的影响,还存在其他因素影响此聚合过程(图4-C)。以上结果都说明,在萼片脱落的早期,DPI处理可以影响萼筒的活性氧代谢水平,尤其是POD活性,并影响木质素生物合成。
2.3 活性氧相关处理中期离区的指标变化
2.3.1 处理中期离区的木质化
纵切的梨果实萼
筒番红固绿染色结果表明,在抑制剂处理后的中期,离层细胞木质化进一步加剧,DPI和DPI+H2O2處理可以明显缩小离层细胞的木质化范围(图6-B、图6-D)。离层细胞透射电镜观察结果表明,单独DPI处理仍然抑制离层细胞的细胞壁增厚,H2O2和DPI+H2O2处理可以明显增厚离层细胞壁(图7)。细胞木质化数据统计结果表明,DPI处理可以减少木质化细胞数量和降低离层细胞细胞壁的厚度,而H2O2和DPI+H2O2处理的细胞壁厚度整体水平上与对照没有显著变化,说明外源过氧化氢的促进效果不够明显,具有一定局限性(图8)。外源过氧化氢处理下木质素含量极显著上升,而DPI+H2O2处理没有显著差异;DPI处理下木质素含量极显著降低,同时过氧化氢含量在DPI处理下也受到极显著抑制(图9-A)。这是由于木质素单体的聚合需要以过氧化氢作为电子接受体,然后经由POD的催化作用,产生结构相对稳定的单体木质素。
2.3.2 处理中期离区的活性氧变化
如图9所示,外源施加H2O2能够间接提高内源过氧化氢水平,而DPI+H2O2处理下,则由于DPI的作用更加明显,导致内源过氧化氢水平受到抑制, H2O2的外源促进并未对DPI的抑制作用产生显著影响(图9-B)。对POD活性进行测定发现DPI处理下POD活性极显著下降,而H2O2和DPI+H2O2处理未产生显著影响(图9-C)。经DPI、H2O2和DPI+H2O2处理后14 d,外源过氧化氢在脱萼发生的中期开始起作用可以抵消DPI的抑制作用,但还并未有显著效果。
2.4 活性氧相关处理后期离层的指标变化
2.4.1 处理后期离区的木质化
相对于之前2个时期,在活性氧相关处理后期,H2O2和DPI+H2O2处理可以明显扩增离层细胞木质化范围,DPI仍明显缩小离层细胞的木质化范围(图10-A)。离层细胞透射电镜观察的结果表明,3个处理的离层细胞壁增厚没有明显差异(图11)。细胞木质化数据统计结果表明,DPI处理可以减少木质化细胞数量但抑制效果不如前2个时期,而3种处理离层细胞的细胞壁厚度与对照没有显著差异(图12)。这是因为这个时期离层细胞已经发育完全,各处理对萼筒细胞水平发育的影响已经不显著。与染色分布结果一致,DPI处理下木质素含量极显著降低,而H2O2和DPI+H2O2处理下木质素含量极显著上升(图13-A)。
2.4.2 处理后期离区的活性氧变化
随后对内源过氧化氢水平进行了测定,发现了与前面2个时期不一样的结果,DPI+H2O2处理下,内源过氧化氢水平极显著提高;DPI处理降低内源过氧化氢含量,而外源H2O2处理提高内源过氧化氢含量,这与7 d和14 d结果一致(图13-B)。POD的活性依然对于DPI的抑制效果较为敏感,当外源DPI处理21 d后,POD活性极显著下调,而另外2种处理没有显著差异(图13-C)。以上结果表明,外源过氧化氢在处理后期可以显著促进内源过氧化氢的形成,导致木质素增加;而DPI处理对内源过氧化氢和POD活性的具有抑制作用,降低木质素含量,二者均证明了内源过氧化氢和POD活性的变化是影响木质素生物合成的关键。
2.5 脱萼过程中木质素生物合成和活性氧代谢的相关性分析
为了探明脱萼过程中木质素生物合成和活性氧的关联,分别使用抑制剂处理后前中后3个时期的各项活性氧代谢和木质素合成相关指标进行相关性分析,并绘制出皮尔森相关系数相关性热图。由图14可以看出, 活性氧相关处理后前期, 超氧阴离
子含量分别与细胞壁厚度(r=0.917**)和木质素含量(r=0.917**)呈极显著正相关;活性氧相关处理后中期,木质素含量分别与过氧化氢含量(r=0.678*)和POD活性(r=0.864**)呈显著或极显著正相关,且染色分布范围分别与过氧化氢含量(r=0.509)和POD活性(r=0.781**)呈正相关;活性氧相关处理后后期,染色分布分别与过氧化氢含量(r=0.632*)和POD活性(r=0.668*)呈显著正相关,且木质素含量分别与过氧化氢含量(r=0.921**)和POD活性(r=0.920**)呈极显著正相关,而与羟基自由基含量呈极显著负相关(r=-0.900**)(图14)。综上所述,萼筒离层中中木质素生物合成和活性氧代谢整体上呈正比例关系。其中,离区过氧化氢含量和POD活性与木质素含量呈正比例关系,从而促进了离层细胞壁增厚。
3 讨论与结论
本研究中,观察到脱萼果离层维管束直径显著小于宿萼果,且离层细胞壁开始木质化增厚(图1)。Ma等研究报道,更大的萼筒维管束平均面积可以为萼片提供足够营养和水分,防止离层的形成[22]。在拟南芥花瓣脱落中,DPI可以抑制离层NADPH氧化酶活性,影响木质素单体的聚合过程,阻止花瓣脱落层中木质素的积累[8]。脱萼过程可能也受到活性氧代谢和木质素生物合成两者的协同作用。因此,在本研究中筛选了参与活性氧代谢的抑制剂DPI来进行试验。有研究报道,DPI可以与血红素修复基团反应形成稳定的化合物,特异性地抑制NADPH氧化酶活性影响活性氧代谢[23]。Hoffmann等研究表明,在木质素聚合过程中,过氧化物酶可以利用H2O2催化单木酚氧化[24]。在脱萼关键形成时期,对梨幼果果实萼筒进行DPI、H2O2以及DPI+H2O2处理的微量注射,每次间隔5 d进行处理的抑制剂的补充注射。研究结果表明,处理后7 d,DPI处理能够降低过氧化氢含量,减少木质素含量,而外源过氧化氢早期不影响木质素含量(图2至图5)。Liu等在水稻中发现外源H2O2可以增加水稻根部的木质素含量,而DPI处理可以抑制这一现象[25]。中期萼筒离层在DPI处理下,仍可以通过降低离层过氧化氢的含量,抑制木质素生物合成,而这个时期离层开始对过氧化氢促进效果敏感,可以促进内源过氧化氢合成,但不影响木质素含量(图6至图9)。Heng等报道已经证明多胺代谢产生的H2O2影响了梨外皮组织的木质化[26]。在处理后期,萼筒离层外源处理过氧化氢可以弥补DPI的抑制效果(图10~图13)。LAC启动氧化聚合后,POD在木质素、半纤维素和扩展素之间形成刚性交联,进而影响木质化[27]。脱萼过程中木质素生物合成和活性氧代谢之间存在显著正相关关系,离区中过氧化氢和POD活性水平的升高可以增加离区木质化染色分布,并提高木质素的含量。
综上结果表明,处理后全时期萼筒离层对DPI的抑制效果敏感,DPI可以抑制梨果实萼筒的细胞壁木质化,过氧化氢可以在一定程度上弥补这一抑制过程,从而促进木质素的生物合成过程。
参考文献:
[1]王国平,田路明,李秀根,等. 新中国果树科学研究70年——梨[J]. 果树学报,2019,36(10):1273-1282.
[2]邵月霞. 库尔勒香梨萼片脱落及果实发育变化研究[D]. 石河子:石河子大学,2007.
[3]Qi X X,Wu J,Wang L F,et al. Identifying the candidate genes involved in the calyx abscission process of ‘Kuerlexiangli (Pyrus sinkiangensis Yu) by digital transcript abundance measurements[J]. BMC Genomics,2013,14:727.
[4]马宏超,王燕凌,文 旭,等. 不同药剂处理对库尔勒香梨脱萼和缩萼果萼筒显微结构的影响[J]. 果树学报,2011,28(3):518-520,551.
[5]Cheng X,Li M L,Li D H,et al. Characterization and analysis of CCR and CAD gene families at the whole-genome level for lignin synthesis of stone cells in pear (Pyrus bretschneideri) fruit[J]. Biology Open,2017,6(11):1602-1613.
[6]Dardick C,Callahan A M. Evolution of the fruit endocarp:molecular mechanisms underlying adaptations in seed protection and dispersal strategies[J]. Frontiers in Plant Science,2014,5:284.
[7]張俊超. 基于转录组测序挖掘老芒麦落粒候选基因及其功能分析[D]. 兰州:兰州大学,2020.
[8]Lee Y,Yoon T H,Lee J,et al. A lignin molecular brace controls precision processing of cell walls critical for surface integrity in Arabidopsis[J]. Cell,2018,173(6):1468-1480.
[9]王志科. 马铃薯块茎休眠解除过程中H2O2与NO作用机理的解析[D]. 兰州:甘肃农业大学,2020.
[10]Ros-Barceló A,Pomar F,López-Serrano M,et al. Developmental regulation of the H2O2-producing system and of a basic peroxidase isoenzyme in the Zinnia elegans lignifying xylem[J]. Plant Physiology and Biochemistry,2002,40(4):325-332.
[11]Huang W K,Ji H L,Gheysen G,et al. Thiamine-induced priming against root-knot nematode infection in rice involves lignification and hydrogen peroxide generation[J]. Molecular Plant Pathology,2016,17(4):614-624.
[12]Donnini S,DellOrto M,Zocchi G. Oxidative stress responses and root lignification induced by Fe deficiency conditions in pear and quince genotypes[J]. Tree Physiology,2011,31(1):102-113.
[13]Li L,Li M,Yu L P,et al. The FLS2-associated kinase BIK1 directly phosphorylates the NADPH oxidase RbohD to control plant immunity[J]. Cell Host & Microbe,2014,15(3):329-338.
[14]張 杰. 马铃薯StSN2抑制H2O2积累和木质素合成延长块茎休眠研究[D]. 雅安:四川农业大学,2020.
[15]Shigeto J,Itoh Y,Hirao S,et al. Simultaneously disrupting AtPrx2,AtPrx25 and AtPrx71 alters lignin content and structure in Arabidopsis stem[J]. Journal of Integrative Plant Biology,2015,57(4):349-356.
[16]Shigeto J,Kiyonaga Y,Fujita K,et al. Putative cationic cell-wall-bound peroxidase homologues in Arabidopsis,AtPrx2,AtPrx25,and AtPrx71,are involved in lignification[J]. Journal of Agricultural and Food Chemistry,2013,61(16):3781-3788.
[17]Fagerstedt K V,Kukkola E M,Koistinen V V T,et al. Cell wall lignin is polymerised by class Ⅲ secretable plant peroxidases in Norway spruce[J]. Journal of Integrative Plant Biology,2010,52(2):186-194.[HJ1.75mm]
[18]Liu C J. Deciphering the enigma of lignification:precursor transport,oxidation,and the topochemistry of lignin assembly[J]. Molecular Plant,2012,5(2):304-317.
[19]Tao S T,Khanizadeh S,Zhang H,et al. Anatomy,ultrastructure and lignin distribution of stone cells in two Pyrus species[J]. Plant Science,2009,176(3):413-419.
[20]刘若南. 赤霉素和GID1在调控梨果实木质素形成中的功能研究[D]. 南京:南京农业大学,2018.
[21]张虎平. 梨果实内糖的转运及积累特性研究[D]. 南京:南京农业大学,2011.
[22]Ma L,Zhou L,Quan S W,et al. Integrated analysis of mRNA-seq and miRNA-seq in calyx abscission zone of Korla fragrant pear involved in calyx persistence[J]. BMC Plant Biology,2019,19(1):192.
[23]Gui T Y,Gao D H,Ding H C,et al. Identification of respiratory burst oxidase homolog (rboh) family genes from Pyropia yezoensis and their correlation with archeospore release[J]. Frontiers in Plant Science,2022,13:929299.
[24]Hoffmann N,Benske A,Betz H,et al. Laccases and peroxidases Co-localize in lignified secondary cell walls throughout stem development[J]. Plant Physiology,2020,184(2):806-822.
[25]Liu Q Q,Zheng L,He F,et al. Transcriptional and physiological analyses identify a regulatory role for hydrogen peroxide in the lignin biosynthesis of copper-stressed rice roots[J]. Plant and Soil,2014,387:323-336.
[26]Heng W,Wang M D,Yang J Y,et al. Relationship between H2O2 in polyamine metabolism and lignin in the exocarp of a russet mutant of ‘Dangshansuli pear (Pyrus bretschneideri Rehd.)[J]. Plant Molecular Biology Reporter,2016,34(6):1056-1063.
[27]Passardi F,Penel C,Dunand C. Performing the paradoxical:how plant peroxidases modify the cell wall[J]. Trends in Plant Science,2004,9(11):534-540.

