维持性血液透析患者发生肺动脉高压的危险因素分析
许嵘,吕文律,曹学森,余金波,沈波,许佳瑞,徐辰祺,丁小强,邹建洲,李正红
肺动脉高压(pulmonary arterial hypertension,PAH)是维持性血液透析(maintained hemodialysis,MHD)患者常见且严重的心血管并发症[1],文献报道其患病率为33%~40%[2-3]。研究表明,PAH是MHD患者心血管死亡和全因死亡的独立危险因素[2]。然而,MHD患者发生PAH的病因目前尚未明确,可能与内皮功能紊乱、血管钙化、心脏舒张功能减退、炎症反应及免疫紊乱等有关[4]。本研究旨在探究MHD患者发生PAH的危险因素,以期为临床防治PAH提供干预策略。
1 对象与方法
1.1 研究对象 选取2012年11月至2021年3月在复旦大学附属中山医院血液透析中心治疗的MHD患者335例。纳入标准:(1)年龄≥18周岁;(2)透析龄≥6个月[5];(3)透析频率为4 h/次,3次/周。排除标准:(1)有恶性肿瘤史患者;(2)有慢性传染病史患者;(3)肾移植患者;(4)有血液系统疾病患者;(5)近3个月内服用过免疫抑制剂患者;(6)近期发生急性感染患者;(7)合并可能引起PAH的疾病(先天性心脏病、慢性阻塞性肺疾病、系统性红斑狼疮等)患者;(8)血液透析前有明确的PAH、肺栓塞、肺动脉狭窄等肺部疾病史患者;(9)有心脏瓣膜病、风湿性心脏病等心血管疾病史患者;(10)特发性、家族性PAH患者;(11)活动性结核患者;(12)近期行手术治疗、输血治疗患者;(13)合并甲状腺疾病以及长期应用引起肺动脉压增高的药物患者。本研究经复旦大学附属中山医院伦理委员会审核批准(B2021-067R)。所有患者签署知情同意书。
1.2 观察指标 (1)PAH发生情况及一般资料。使用连续多普勒超声心动图检查评估患者PAH发生情况,以肺动脉收缩压(pulmonary arterial systolic pressure,PASP)>35 mm Hg(1 mm Hg=0.133 kPa)为发生PAH,根据PAH发生情况,将患者分为PAH组和非PAH组[6]。收集患者一般资料,包括性别、年龄、BMI、透析龄、血管通路类型、透析间期体质量增长率(透析间期体质量增长量与干体质量的比值)、血压(记录患者透析前的血压,并连续随访3个月,取其平均值)、合并高血压情况、合并糖尿病情况、尿素清除指数(urea clearance index,Kt/V)。(2)实验室检查指标。于透析前检测患者N末端脑钠肽前体(N-terminal pro brain natriuretic peptide,NT-proBNP)、血尿素氮、血肌酐、血白蛋白、血钙、血磷、血镁、超敏C反应蛋白、血红蛋白、红细胞分布宽度(redcell distribution width,RDW)、血甲状旁腺激素、血β2微球蛋白、铁蛋白、CD4+T淋巴细胞占比、CD8+T淋巴细胞占比、IL-1、IL-2R、IL-6、IL-8、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)。采用电化学发光法检测NT-proBNP,采用HITCH-7080全自动生化分析仪检测血生化指标,采用自动化学发光免疫法检测血甲状旁腺激素,采用流式细胞术检测CD4+、CD8+T淋巴细胞占比,采用化学发光定量检测法检测IL-1、IL-2R、IL-6、IL-8、TNF-α。(3)超声心动图检查结果。由本院心脏超声科医生采用彩色多普勒超声心动仪完成超声心动图检查。所有超声心动图检查于血液透析后完成,记录患者左心房内径、左心室舒张末期内径、主动脉根部内径、左心室收缩末期内径、室间隔厚度、左心室后壁厚度、左心室射血分数。
1.3 统计学方法 采用SPSS 22.0统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;非正态分布计量资料以〔M(P25,P75)〕表示,组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验;采用多因素Logistic回归分析探讨MHD患者发生PAH的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 PAH发生情况及一般资料 本研究共有129例患者发生PAH。两组性别、年龄、BMI、透析龄、血管通路类型、收缩压、舒张压、合并高血压者占比、合并糖尿病者占比、Kt/V比较,差异无统计学意义(P>0.05);PAH组透析间期体质量增长率高于非PAH组,差异有统计学意义(P<0.05),见表1。

表1 两组一般资料比较Table 1 Comparison of general data between the two groups
2.2 实验室检查指标和超声心动图检查结果 两组血尿素氮、血肌酐、血白蛋白、血磷、血镁、超敏C反应蛋白、血甲状旁腺激素、血β2微球蛋白、铁蛋白、CD4+T淋巴细胞占比、CD8+T淋巴细胞占比、IL-1、IL-2R、IL-6、IL-8、主动脉根部内径、室间隔厚度比较,差异无统计学意义(P>0.05)。PAH组NT-proBNP、TNF-α高于非PAH组,RDW、左心房内径、左心室舒张末期内径、左心室收缩末期内径、左心室后壁厚度大于非PAH组,血钙、血红蛋白、左心室射血分数低于非PAH组,差异有统计学意义(P<0.05),见表2。
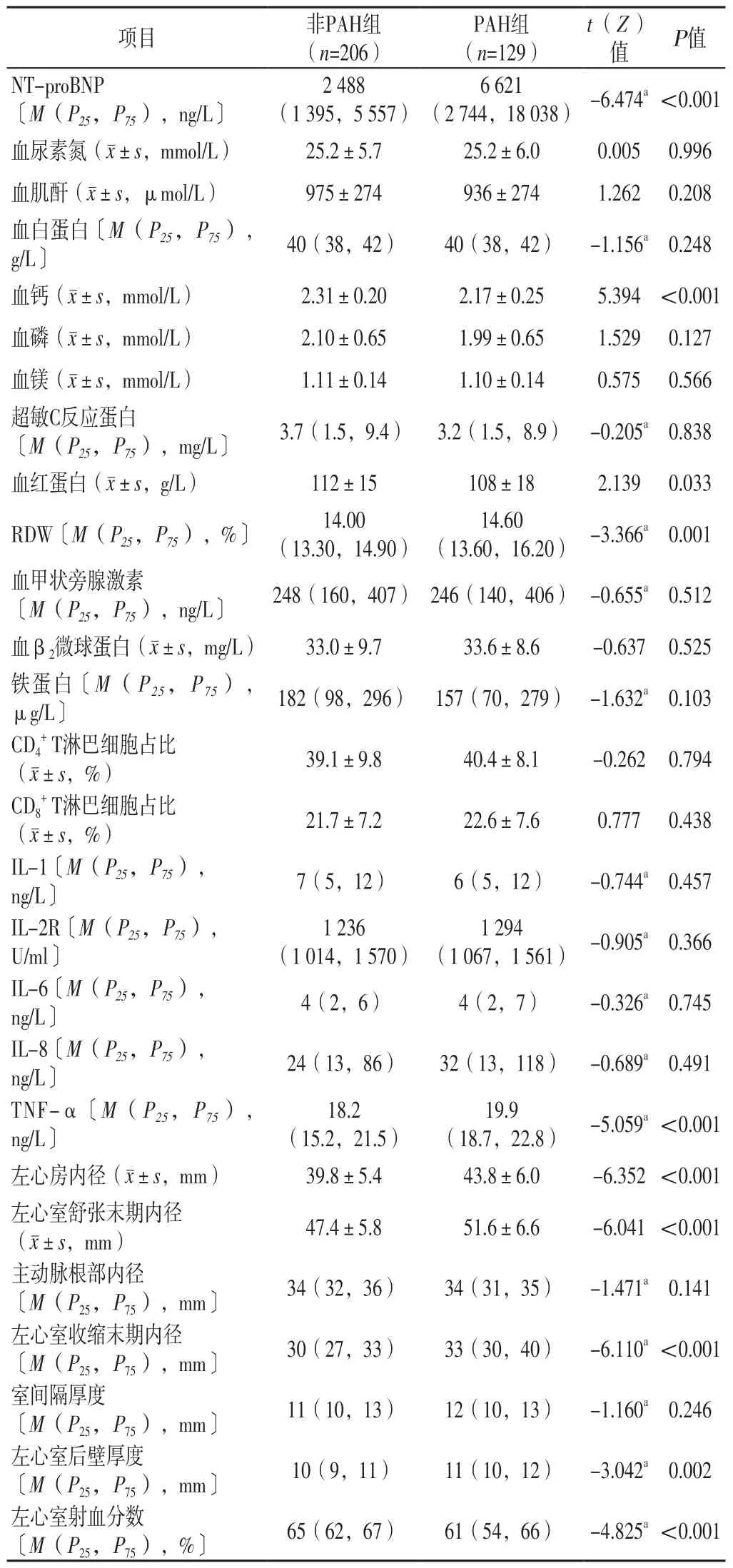
表2 两组实验室检查指标、超声心动图检查结果比较Table 2 Comparison of laboratory examination indexes and echocardiography results between the two groups
2.3 MHD患者发生PAH影响因素的多因素Logisitic回归分析 以表1、2中P<0.1的变量为自变量(赋值:实测值),以MHD患者是否发生PHA为因变量(赋值:是=1,否=0),进行多因素Logistic回归分析,结果显示,NT-proBNP升高、血钙降低、RDW增大和TNF-α升高是MHD患者发生PAH的独立危险因素(P<0.05),见表3。

表3 MHD患者发生PAH影响因素的多因素Logistic回归分析Talbe 3 Multivariate Logistic regression analysis of influencing factors of PAH in MHD patients
3 讨论
PAH是以肺循环阻力进行性增加为特点的肺小动脉疾病,是导致右心功能衰竭的主要原因。研究表明,合并PAH的MHD患者心血管疾病死亡及全因死亡风险明显增加[7-8]。肺动脉压长期持续升高可导致肺血管结构改变以及不同程度的右心室功能障碍,目前尚无可治愈的手段。因此,预防PAH的发生发展是改善MHD患者预后的关键。有研究表明,MHD患者发生PAH可能与年龄、透析龄、血管通路类型、内皮功能紊乱、骨矿物质代谢紊乱所致的血管钙化、容量超负荷、炎症和氧化应激增加、心脏收缩和舒张功能减退等相关[9-10]。尽管国内外探索MHD患者并发PAH影响因素的研究逐渐增多,但由于研究人群、研究类型、PAH诊断界值等方面差异较大,PAH的发病机制及影响因素仍存在较多争议。
本研究结果显示,MHD患者PAH发生率为38.5%(129/335),与既往研究报道的33%~40%[2-3]相符。既往研究结果显示,合并PAH的MHD患者年龄、透析龄大于未合并PAH的MHD患者,收缩压高于未合并PAH的MHD患者[11-12]。本研究结果显示,非PAH组和PAH组年龄、透析龄、收缩压、舒张压比较无统计学差异,这可能与本研究为单中心研究,且样本量较小有关,也提示PAH与MHD患者年龄、透析龄及血压之间的关系还有待更多研究证实。
本研究多因素Logistic回归分析结果显示,NT-proBNP升高是MHD患者发生PAH的独立危险因素。容量超负荷是导致PAH的主要原因之一[9],而MHD患者急性或慢性容量超负荷均可导致脑钠肽(brainnatriuretic peptide,BNP)或者NT-proBNP升高。近年研究表明,MHD患者PASP与血NT-proBNP相关[13],容量超负荷可能导致慢性肺充血,进而直接引起肺损伤,从而引发PAH。陈新河等[14]研究发现,下调干体质量,改善容量超负荷状态可以有效降低PASP。
相关研究结果显示,MHD患者骨矿物质和钙磷代谢紊乱可能参与了PAH的发生[15]。钙可以异位沉积于肺血管,导致肺动脉钙化、血管僵硬度增加,增加肺循环阻力,从而形成PAH。LI等[1]研究发现,终末期肾脏病患者肺动脉压与血钙水平呈负相关。本研究结果显示,血钙降低是MHD患者发生PAH的独立危险因素。由此推测早期发现并干预钙磷代谢紊乱有助于减少和延缓MHD患者发生PAH。
本研究结果还显示,RDW增大是MHD患者发生PAH的独立危险因素,与沈燕等[16]研究结果相似。LU等[17]研究也表明,慢性肾脏病患者RDW增大与心血管不良事件密切相关。分析原因可能与RDW增大与肾素-血管紧张素-醛固酮系统激活、营养不良和内皮功能紊乱等有关[18]。
陈荣毅等[5]研究结果显示,透析患者外周血CD+8T淋巴细胞占比下降与PAH的发生独立相关。而AUSTIN等[19]在特发性PAH研究中发现,PAH与外周血CD4+T淋巴细胞占比和CD8+T淋巴细胞占比无关,而与活化的效应CD8+T淋巴细胞(CD45RA+CCR7-CD8+T淋巴细胞)占比升高相关。TNF-α是由巨噬细胞和单核细胞产生的促炎细胞因子。近年有研究提示,肺血管的微炎症反应可能参与了PAH的发生发展[5,20]。动物及细胞实验显示,肺动脉管壁中及周围活化的CD8+T淋巴细胞分泌的TNF-α可使肺动脉平滑肌细胞凋亡减少,从而引发PAH[20]。本研究结果显示,两组CD4+、CD8+T淋巴细胞占比比较,差异无统计学意义,但PAH组TNF-α高于非PAH组,且多因素Logisitc回归分析结果显示TNF-α升高是MHD患者发生PAH的独立危险因素,与AUSTIN等[19]研究结果相似,提示PAH的形成与外周血CD4+、CD8+T淋巴细胞占比的改变无关,而与外周血活化的效应CD8+T淋巴细胞(CD45RA+CCR7-CD8+T淋巴细胞)占比升高导致的TNF-α分泌增加相关。
综上所述,NT-proBNP升高、血钙降低、RDW增大和TNF-α升高是MHD患者发生PAH的独立危险因素,对MHD患者进行定期检查、评估,并早期干预容量超负荷状态,调节钙磷代谢紊乱,改善营养状况及微炎症状态,有助于减少PAH的发生。但本研究为单中心研究,且样本量小、数据不够完善(缺乏患者动脉血气分析、肺功能检查结果)等,未来需要多中心、大样本量、前瞻性研究进一步验证本研究结论。
作者贡献:许嵘进行文章的构思与设计、资料收集,撰写论文;邹建洲进行研究的实施与可行性分析;吕文律、曹学森、沈波、许佳瑞、徐辰祺进行资料整理;许嵘、余金波进行统计学处理;邹建洲、李正红进行论文的修订,负责文章的质量控制及审校;许嵘、李正红对文章整体负责,监督管理。
本文无利益冲突。

