成猪INHBA 基因相关长非编码RNA 的筛选
芦春雪,卢丽婷,李希冉,殷淑洁,冯 静,刘 欢,马兆谦,周百灵,任 景,沈丛丛,黄平平,于 雪
(德州学院生物物理研究院/山东省生物物理重点实验室,山东 德州 253023)
卵母细胞和精子质量是决定受精成功的两个主要因素,而胚胎发育和着床有着复杂的生物学途径调控,还取决于子宫内膜的容受性,涉及许多分子的调控(如mRNA、ncRNA 和蛋白质)[1]。在雌性配子发育过程中,卵母细胞经历了从胚胎时期原始卵母细胞的形成到减数分裂启动以及排卵的复杂过程。在胚胎阶段,卵母细胞被包裹在一个卵巢体细胞和颗粒前细胞组成的体系中,然后成长为原始卵泡池。原始卵泡池是包括人类在内的大多数哺乳动物的胚胎期产物,代表了雌性的卵巢储备。而受精后胚胎的质量主要取决于优势卵泡的选择,这一过程受到相关抑制素的调控,研究表明,抑制素在排卵期表达较低,当卵泡排卵或闭锁后,抑制素表达又升高[2]。因此,研究抑制素及其在生殖生理方面的调控机制有利于提高种猪繁育能力[3],增加生猪产量,降低生产成本,使得生猪产业效益最大化。能从最根本上解决生猪养殖产量问题,化解繁殖问题对养猪产业的影响。
抑制素(Inhibin,INH)是性腺分泌的一种糖蛋白激素,具有抑制垂体促卵泡素合成和分泌的作用。由抑制素α 亚基(INHA)、抑制素βA亚基(INHBA)、抑制素βB 亚基(INHBB)组成。笔者前期针对抑制素的INHA、INHBA 两个亚基进行了较为系统的研究,证实两者均在卵泡发育和产仔数方面有重要作用[4],但是针对INH的研究大部分集中在转录水平,转录后水平的调控存在较大空白,而lncRNAs 涉及转录起始、转录中以及转录后多层次调控,将有助于填补这一空白。研究证实lncRNA 可能通过组蛋白修饰和染色
质重塑等方式,在雌性生殖过程中发挥作用[5-6]。文献显示,卵母细胞成熟、精子形成、受精过程和胚胎发育等生殖过程,均受到卵丘细胞和精子细胞中的多种lncRNA 的调控。基于此本研究拟利用生物信息学方法,在NON CODE 数据库中通过INHBA 的序列推导功能关联,综合分析筛选INHBA 相关lncRNAs,再经分子生物学方法在细胞水平进行功能验证,以期丰富猪颗粒细胞增殖凋亡及生殖激素自/旁分泌的lncRNA 调控网络,加深对猪卵泡发育的遗传基础和分子机制的认识,在挖掘、利用繁殖相关分子标志物等方面都具有重要的科学意义。
1 材料与方法
1.1 材料
本研究选择发情间期和发情期的杜长大三元杂交健康母猪的卵巢为实验材料,卵巢采自山东夏津县新希望六和种猪场,采集后首先进行酒精消毒,PBS 缓冲液清洗后,冰上保存,1~2 h 内送回实验室。再用PBS 缓冲液重复清洗2 次,选择明亮的大卵泡,采用10 ml 针管抽吸卵泡液,于超净台内打入15 ml 离心管中,加PBS 混匀,1 200 r/min 离心 3 min,弃上清,重复洗涤1次,将卵巢颗粒细胞平铺于60 mm 培养皿中,加2 ml 完全培养基(Hyclone DMEM/F12 基础培养基+15 % 胎牛血清FBS+2 % 青链霉素),首先用培养液吹打培养基,然后晃动培养皿使细胞分散开来,最后放置于37 ℃ 细胞培养箱中进行培养。
1.2 方法
1.2.1 候选lncRNAs 的筛选 NCBI 在线数据库(https://www.ncbi.nlm.nih.gov/nucleotide/)检索INHBA 基因,通过ORF 获取其3’UTR 序列,根据lncRNA 对靶基因海绵屏蔽效应(ceRNA)的作用机理,利用NONCODE 数据库(http://www.noncode.org/)的BLAST 工具,匹配出与INHBA 3’UTR 序列互补配对的lncRNA。
1.2.2 候选lncRNAs 与INHBA 基因靶位点预测候选lncRNAs 是根据INHBA 基因的3’UTR 序列互补预测得来的,lncRNA 和目的基因之间存在高度同源,为了进一步确定两者之间确实存在相互作用,通过在线软件 IntaRNA(http://rna.informatik.uni-freiburg.de/IntaRNA/Input.jsp ) 对INHBA 上的靶位点进行预测。
1.2.3 细胞RNA 提取及检测 参照天根RNA Easy Fast 动物组织/细胞总RNA 提取试剂盒说明书提取 RNA。吸取 1 µl RNA 洗脱液滴加在Nanodrop 2 000 核酸浓度测定仪样品采集孔,进行浓度和纯度检测。
1.2.4 RNA 反转录为cDNA 反应液需要在冰上配置,在无RNA 酶的PCR 管中加入以下成分混匀:5X Evo M-MLVRT Master Mix,2 µl;Total RNA*1< 500 ng,RNase free water up to 10 µl,反应程序设置:37 ℃ 15 min,85 ℃ 5 sec,4 ℃。
1.2.5 RT-qPCR (1)定量引物的设计。应用在线数据库NCBI 的Primer Blast 软件针对候选lncRNAs 及内参基因β-actin 的序列进行引物设计,送青岛生工生物科技有限公司合成,其引物序列如表1 所示。(2)荧光定量PCR 的反应体系(25 µl)如表2。按照上述体系混匀后加入96 孔板(注意避光),上机检测。(3)荧光定量PCR的扩增条件:荧光定量PCR 采用罗氏 Light-Cycler 96 System 进行,反应条件如表3 所示。利用2-△△Ct方法计算基因相对表达水平,β-actin 为内参基因。
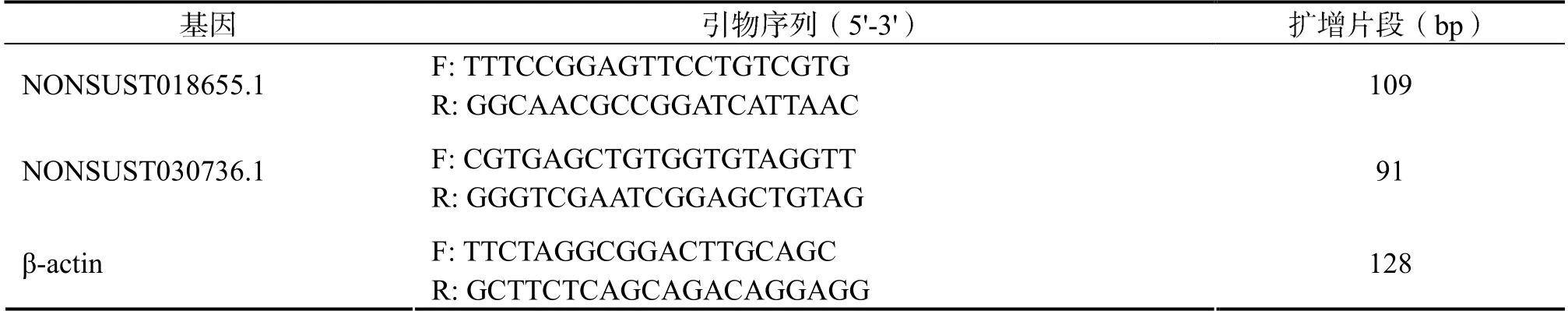
表1 引物序列

表2 RT-qPCR 扩增反应体系
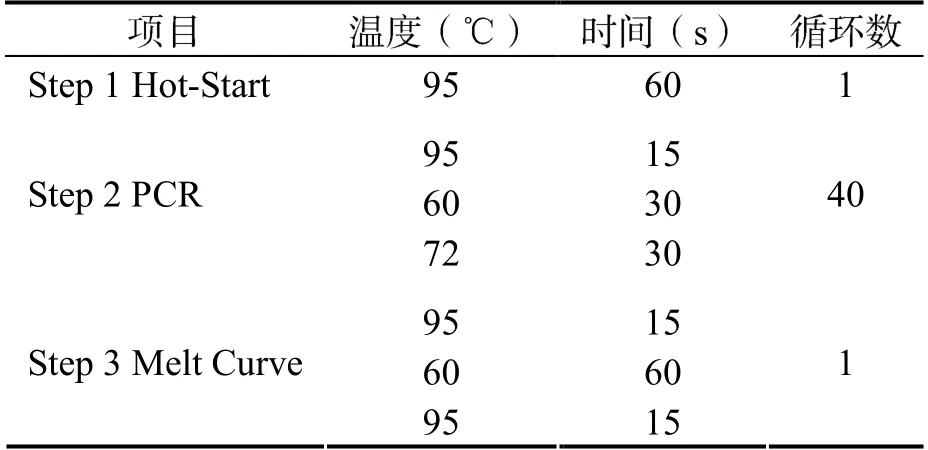
表3 三步法PCR 反应程序
2 结果与分析
2.1 候选lncRNAs 的筛选
在NONCODE 数据库中利用BLAST 功能,如表4 所示,得到与INHBA 匹配度评分较高的5 条lncRNAs,因lncRNA 片段过大不利于后续实验开展,特别是全长的扩增,因此笔者最终选择了NONSUST018655.1 和NONSUST030736.1两条lncRNAs 用于后续实验的分析。
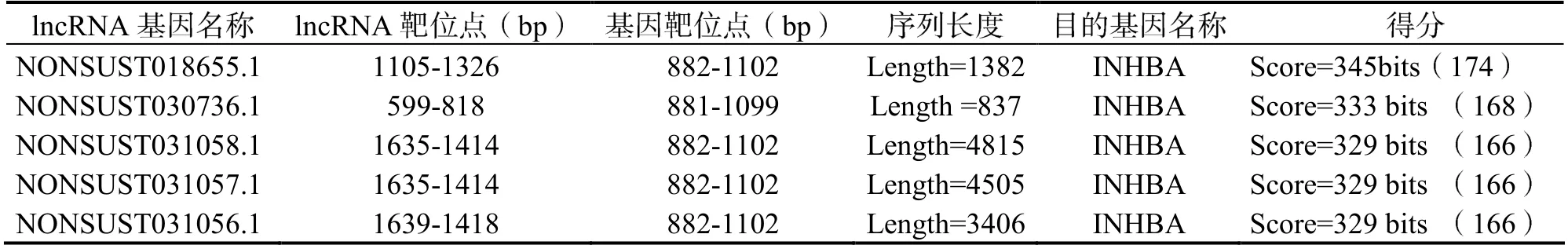
表4 lncRNA 基因筛选结果得分
2.2 候选lncRNAs 对INHBA 作用靶位点的预测
通过在线软件IntaRNA 对候选lncRNAs 在INHBA 基因上的作用靶位点的预测,笔者得知NONSUST018655.1 的1105-1326 bp 与INHBA 基因的882-1102 bp 区间存在直接调控作用;NONS UST030736.的599-818 bp 与INHBA 基因的881-1 099 bp 区间存在直接调控作用。
2.3 猪颗粒细胞培养
取发情期和发情间期猪卵巢,消化培养猪颗粒细胞,可看到消化所得细胞密度适中,完全具有扩增能力。原代培养 3d 的猪颗粒细胞(PGCs)形态,可见贴壁伸展发育的形态。传4代后细胞状态,可见细胞形态正常,仍然可以维持增殖,用于后续实验的开展。
2.4 候选lncRNAs 在颗粒细胞中的表达分析
利用RT-qPCR 方法进行检测候选lncRNAs在发情间期和发情期卵巢颗粒细胞中表达水平,结果如图1 所示,NONSUST018655.1 和NONS UST 030736.1 在发情期卵巢颗粒细胞中表达水平显著上升,提示这两个lncRNAs 可能对INH 存在调控功能,可以作为后续功能试验验证。
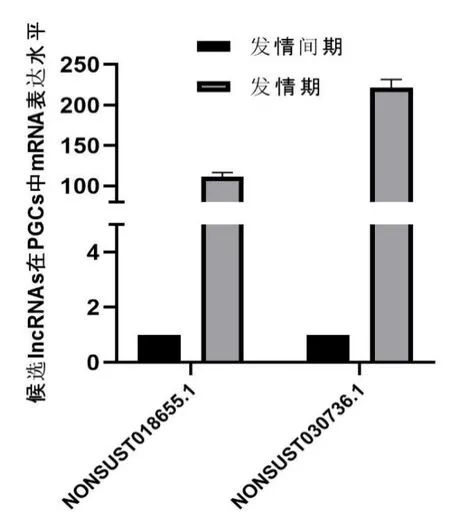
图1 候选lncRNAs 在发情间期和发情期卵巢颗粒细胞中表达水平
3 讨论与结论
lncRNA 的预测方法有很多[7],包括通过序列预测其功能,其中已知lncRNA 转录本信息来自于Ensembl 数据库,数据库中标记“antisense”和“lincRNA”被认为是已知的或者潜在已知的lncRNA 转录本;有通过在UCSC 数据库对基因上下游进行搜索,还有通过在NONCODE 数据库进行序列BLAST(3’-UTR 结合)来分析预测,这也是本研究采用的预测方式。另外,lncRNA的调控机制也有多种,在不同的生理环境下都会有不同的作用机制。部分 lncRNA 可以作为miRNA 的海绵,通过海绵效应来吸附miRNA,进而对生理活动有所影响,最终影响生物表型的变化[8],比如在HCC(原发性肝癌当中最常见的一种肝细胞癌)中自噬的调节机制中,结合荧光素酶测定的结果表明miR-181a-5p 被CCAT1 通过海绵效应吸附调节自噬,进而增加ATG7 的表达[9]。有的lncRNA 可以通过直接和多层次生物分子,比如蛋白质分子、核酸分子等物质结合,以此来调控lncRNA 对目标基因的作用,最后参与目标基因转录等生理活动来调控生物表型[10]。本研究结果显示 NONSUST018655.1 和 NONSUST 030736.1 表达量在发情间期表达水平较低,而发情期卵巢颗粒细胞中表达水平显著上升,这一表达规律与INH 表达规律呈负相关,且本身与INHBA 又有作用位点,因此提示这两个候选lncRNAs 极有可能对INH 存在结合调控功能。但对于NONSUST018655.1 和NONSUST0 30736.1的信息十分有限,有待后续其他功能性验证,才能进一步明确其调控机制。

