等离子体驱动催化还原合成绿色氨的研究
刘国杰,李艳伟,朱化丹
(东明中信国安瑞华新材料有限公司,山东 菏泽 274500)
引言
氨是全球最重要的生产化学品之一。它是农业中必不可少的肥料,也是化学和制药工业的重要组成部分,同时也是一种无碳可再生燃料的替代品。因此,积极探索更绿色、更可持续的氨生产途径非常必要。另外,氨合成的电气化也可以通过电催化或等离子体技术实现。等离子体是一种电离气体,由电子、离子、中性气体分子、激发态分子、自由基和原子以及光子组成,人们对等离子体的巨大兴趣是由于它们独特的特性[1-2]。等离子体产生高活性物质,有利于N2固定,可以在大气压下操作,可以用可再生电力供电,这使得它非常适合分散和间歇生产。等离子体放电制备NH3的最新进展与等离子体直接驱动N2与H2反应有关,甚至与用H2O 代替H2有关。等离子体辅助工艺已被提出被用以提高性能。等离子体催化中,在等离子体反应器中引入催化剂以促进所期望的反应。N2和H2合成NH3在热力学上是有利的。然而,由于动力学缓慢,需要大量的能量来激活相对惰性的N2分子。等离子体可以克服这个问题,因为应用的电能主要是加热光电子,光电子通过电子冲击离解、电离和激发激活N2分子,生成N 原子、离子和被激发的物种,这些物质很容易反应成其他化合物,如NH3等。然而,目前最先进的等离子体催化NH3合成技术清楚地表明,它存在一个主要缺陷:在低能耗和反应产物中高的氨浓度之间存在明显的折中。NH3产率超过10%的同时,能耗超过80 MJ/mol NH3[3-5]。
等离子体驱动的氨合成在目前的状态下需要很高的能量,因此需要一种替代方法。在这项工作中,本文提出PNOCRA 工艺(等离子体氮氧化和催化还原氨):一种将等离子体与发动机尾气后处理技术相结合的新工艺,以克服等离子体工艺合成氨的低效率。等离子体非常适合于氧化反应,而不是化学还原反应。首先将N2氧化为NOx,然后将氨还原为NH3,合成氨用于减少汽车尾气中的NOx排放。
1 试验方法
等离子体驱动N2氧化为NO 以生产氮基肥料,在两个同轴电极之间形成电弧,由水冷却铜管组成,由高压(5 kV)交流电供电,主频(50 Hz)。电弧通过一个与电极成直角放置的电磁铁产生的强静态磁场(~0.45 T/cm2)扩散到一个几厘米厚、直径约1.8 m 的圆盘上。空气从圆盘的两侧流过。在1 100 ℃左右离开折光反应器的气流中含有体积分数为1%~2%的NO 废气被允许通过废热锅炉产生的蒸汽用于操作涡轮发电机为(再)生产电能。在下一步中,NO 在氧化室中缓慢地氧化生成NO2。在200 ℃左右离开省煤器的氧化物在冷却塔中进一步冷却到50 ℃,因为吸收率随着温度的降低而增加。气体与水密切接触,通过反应式(1)反应生成硝酸(HNO3):

与水反应的NO2有1/3 还原为NO,需要再氧化。因此,释放出来的气体进行氧化和再氧化,直到完全被吸收。所得产物含有约30%的浓硝酸Birkeland-Eyde反应的能量消耗约为2.4 MJ/mol NO。
2 结果与讨论
利用加氢催化剂可以将NOx选择性地转化为NH3。从等离子体反应堆离开的空气中存在大量未反应的氧气。在加氢过程中,需要分离NOx和O2以节省氢气。汽车工业已经解决了一个类似的问题,即在空气过剩的情况下运行的稀薄燃烧发动机的排气中,将氮氧化物转化为氮。所谓的“精益氮氧化物捕集器”具有双重功能,并以循环模式运行。它有能力选择性地从存在O2的气体混合物中吸附NOx,并在循环的第二阶段,在还原条件下催化将被吸附的NOx还原为N2。这种催化剂通常由γ-氧化铝涂层上的氧化钡组成,支撑着精细分散的铂。它安装在堇青石蜂窝整体块上,以最大限度地减少压力。在目前的情况下,目的是将NOx降低为N2而不是NH3,但这与加氢催化剂的选择性有关。所需反应如式(2)~式(5)所示。

一些精益NOx捕集器的主要产品是NH3。在最低的Pt 分散中,对NH3的最高选择性为87%。等离子体和LNT 装置的耦合以及两相PNOCRA 过程的装置如图1 所示。在第一阶段,O2/N2气体混合物(如空气)被供应给运行在800 ℃~1100 ℃的等离子体反应器,在那里被部分转化为NO。在这个温度下NO 是热力学上有利的氮氧化物化合物。等离子体反应器排出的气体通过热交换器,在热交换器中冷却到175 ℃,该温度适合于吸附NOx,也适合随后在Pt/BaO/Al2O3LNT[公式(4)]上合成NH3,部分NO 自发地与NO2反应,形成NOx混合物(NO+NO2)。在第一阶段结束时,精益氮氧化物捕集器已饱和。贫氮氧化物捕集器非常有效地从气体流中吸附氮氧化物,从而使低残余氮氧化物浓度被忽略。在第二阶段,向精益氮氧化物捕集器注入氢气,以将捕获的氮氧化物还原为NH3[式(4)]。这种氢气可以通过可再生电力对水进行电解产生。电解装置产生的氧气作为等离子体反应器的进气原料,提高进气氧气含量。从精益氮氧化物捕集器回收的气体可以最大限度地利用氢气。这样,在再生过程中,LNT 上的H2浓度可以保持在较高的水平,并且在LNT 入口的H2摩尔分数在50%以上,有利于降低存储的NOx。部分气流被吹扫,以避免惰性N2在工艺循环中积聚,这些惰性N2是通过式(5)在精益氮氧化物捕集器中形成的。

图1 等离子体和LNT 装置的耦合及两相PNOCRA 过程
图1 中PNOCRA 过程有两个阶段:第一阶段,等离子体辅助N2氧化,然后在LNT 上吸附NOx;第二阶段,通过LNT 催化操作,以H2将吸附的NOx还原为NH3,然后用水萃取NH3。
在汽车工业中,精益氮氧化物捕集器通常以60 s的精益阶段(阶段1)和10 s 的富阶段(阶段2)为周期运行。然而,如此频繁地重启等离子体反应器和电解槽是很不方便的。这个问题可以通过并行安装精益NOx捕集器来解决。例如,总共有7 台机组,其中6 台运行在第一阶段,1 台运行在第二阶段,通过每10 s将NOx饱和LNT 切换到第二阶段,可以确保连续运行。萃取柱入口处NH3摩尔分数为6.3%是符合实际的。根据亨利定律计算,在40 ℃的温度下,NH3在液体出口的最大摩尔分数限制在3.3%。为保证NH3有足够的动力向液相移动,取液出口摩尔分数为3%或摩尔浓度1.67 mol/L。由于NH3是弱碱,pH 从液体入口的7 增加到液体出口的11.6。在下游的蒸馏步骤中得到纯氨。在常压下,精馏塔冷凝器消耗0.13 MJ/mol NH3的冷却能量,在-33 ℃提供。在99 ℃温度下,再沸器消耗0.2 MJ/mol NH3的热量。这种热量可以很容易地由PNOCRA 过程中存在的热交换器之一提供。支持信息中提供了对该列及其操作参数的详细描述。PNOCRA 基本上包含三个能耗单元操作:等离子体反应器;用于反应物生产(H2和O2)的电解槽;NH3提取步骤,随后是蒸馏以生产纯NH3。图2 显示了不同单元操作的作用。等离子体反应器的能耗占总能耗的60%,其次是电解槽(37%),而NH3分离只占总能耗的一小部分(3%)。PNOCRA 的总能耗估计为4.61 MJ/mol NH3。

图2 最佳可用技术(BAT)用于等离子催化生产NH3 的能耗
目前,等离子体催化H2和N2合成NH3的最佳技术(BAT)的能量成本为18.6 MJ/mol NH3,产率为1.4%加上反应物生产能耗(0.51 MJ/mol NH3)和产物分离能耗(0.54 MJ/mol NH3),总能耗为19.65 MJ/mol NH3。PNOCRA 的能耗比目前用于NH3合成的BAT 降低了4 倍以上。如果LNT 催化剂对氨的选择性可以提高,PNOCRA 所需的LNT 催化剂的数量似乎是现实的。
尽管等离子体驱动的氨合成过程的能量需求显著降低,PNOCRA 的能量需求仍然比通电的H-B 过程(0.70 MJ/mol)高约4.5 倍,在该过程中,通过H2O电解产生H2。比传统的化石燃料H-B 工艺(0.52 MJ/mol~0.81 MJ/mol)高9 倍。然而,H-B 工艺只有在非常大的规模下才具有成本效益。由于PNOCRA 工艺同时采用氮氧化生成NOx和还原生成NH3,因此特别适合于分散式化肥生产。全球生产的NH3约80%用于生产氮肥,只有3%直接用作肥料。其中最常见的肥料是硝酸铵(NH4NO3),占氮肥总量的43%。除了如上所述使用等离子体反应器中的NOx进行氨合成外,NOx还可以与O2[式(6)和H2O 式(7)]反应生成硝酸水溶液,就像原来的Birkeland-Eyde 工艺一样。当该溶液用于第二阶段NH3的提取时(图1),硝酸铵形成式(8)。
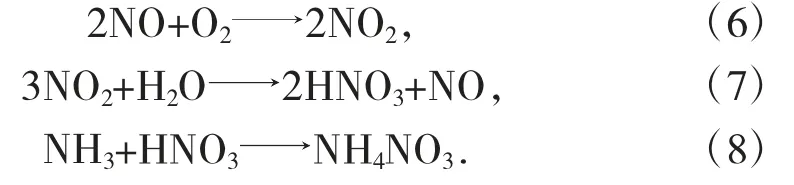
NOx等离子体反应器用于分散硝酸铵生产,将NOx与肥料中的铵进行反应,以减少以化石燃料为基础的氮肥的使用,这已经是一种经济可行的选择。同样,PNOCRA 过程可以以一种经济的方式帮助取代以化石燃料为基础的氮肥。PNOCRA 是基于化石燃料的Haber-Bosch 工艺的颠覆性替代技术,它的实施将伴随着工业和市场转型。可能有一种技术目前还不足以带来足够的颠覆性,因此,需要整合各种创新理念,取长补短,以补充集中氨生产的H-B 电气化工艺。
3 结论
本文提出了采用PNOCRA 工艺进行小型绿色氨生产。PNOCRA 本身没有二氧化碳足迹,依靠空气、水和可再生电力运行。等离子体驱动NH3合成是一种新型的、节能的途径,包括等离子体氧化N2和在LNT中催化将临时储存的NOx转化为NH3的两相循环过程。PNOCRA 的能源性能明显优于直接从N2和H2中产生的基于等离子体的NH3。新工艺对中小型分散氨合成具有特别的吸引力,为分散生产硝酸铵肥料提供了独特的机会。

