阿魏酸结合吡咯啉-5-羧酸还原酶1抑制乳腺癌细胞增殖
杨睿鹏, 安 宁, 单树花, 史江颖, 李汉卿, 贺水玲, 李卓玉
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室, 太原 030006)
乳腺癌(breast cancer)是威胁女性健康最常见的癌症之一。据统计,在全球范围内,乳腺癌患者占各类女性癌症的30%,由乳腺癌引起的死亡率约占女性死因的15%[1]。临床上,根据激素受体雌激素受体(estrogen receptor,ER)、孕激素受体(progestogen receptor, PR)和人表皮生长因子(human epidermal growth factor receptor-2,HER2),乳腺癌可分为luminal ER阳性和PR阳性,又能细分为luminal A型、luminal B型、HER2阳性型和三阴性型[2]。乳腺癌靶向治疗凭借其特异性高、靶向性强的特点,已经被广泛认为是一种新兴的治疗策略,尤其是针对HER2阳性和三阴性乳腺癌[3-4]。近年来,由于其高效、低毒和经济等特点,从植物中挖掘抗肿瘤天然药物越来越受到研究者的关注。目前,已经被成功开发并应用于临床的一线药物有紫杉醇、长春新碱和依立替康等。已有研究表明,从植物中提取多酚类物质具有多种生理活性功能,例如:张等人[5]报道了从茶中提取的多酚具有抗氧化、抗肿瘤、抗菌等多种活性;葡萄籽多酚也被报道具有抗肿瘤、抗病毒、抗炎杀菌、保护心脑血管等作用[6]。一致的是,在不同的活性植物源多酚中都发现了阿魏酸是其中最常见的活性化合物之一[7]。
阿魏酸(ferulic acid, FA,C10H10O4)是普遍存在于植物中的一种酚类化合物,分子量194.184。课题组前期研究发现,从谷加工成米过程中,脱下的副产品谷糠中提取的多酚类物质具有显著的抗炎和抗肿瘤活性[8],且谷糠多酚中的活性物质主要是阿魏酸[9]。进一步的研究证实,阿魏酸具有抑制结肠癌细胞增殖的活性。在本研究中,继续探讨了阿魏酸抑制乳腺癌细胞的生理活性。选用人乳腺癌细胞系MCF-7和小鼠乳腺癌细胞系4T1,通过Pull-down实验确定了阿魏酸在肿瘤细胞中的潜在靶点PYCR1, 酶活力检测结果进一步证实,阿魏酸通过结合PYCR1引起其酶活性降低,从而抑制乳腺癌细胞的增殖。通过分析人类癌症数据库(TCGA)证实,在乳腺癌患者中,PYCR1异常表达并伴有更差的不良预后。这些提示我们,阿魏酸可作为靶向PYCR1治疗乳腺癌的天然候选药物。
1 材料与方法
1.1 材料
阿魏酸;改良型RPMI-1640 培养基;无支原体胎牛血清;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyltetrazolium bromide, MTT);二甲基亚砜(dimethyl sulfoxide, DMSO);银染试剂盒;胰蛋白酶;青链霉素(100X);福林酚试剂;结晶紫。
1.2 细胞系与细胞培养
本研究选用了人源乳腺癌细胞系MCF-7和小鼠源乳腺癌细胞系4T1作为研究对象,细胞株购自中科院细胞库。MCF-7用含10% FBS的DMEM完全培养基,4T1细胞用含10% FBS的1640完全培养基。所有细胞在5% CO2,37 ℃的培养箱中孵育培养。当细胞生长达到90%时进行细胞传代,传代过程中使用胰酶进行消化,用含胎牛血清(fetal bovine serum, FBS)的培养基中和消化反应。
1.3 细胞存活实验
取对数期细胞制备成悬液,计数并使终浓度为6 000个/100 μL,每个孔内加100 μL细胞悬液置于细胞培养箱过夜,待细胞贴壁,分别用0.15、0.3、0.6 mg/mL阿魏酸处理细胞48 h。处理结束,换用100 μL新培养液,再加入20 μL MTT(5 mg/mL),37 ℃避光4 h;孵育结束,吸出孔内的液体,加入150 μL DMSO,震荡10 min,测量570 nm处的吸光度并计算细胞存活率;
1.4 克隆形成实验
取生长状态良好的细胞,消化成单细胞悬液并计数,以每孔5 000个细胞接种于24孔板中,使细胞均匀分布,37 ℃过夜培养。加入不同浓度的阿魏酸处理细胞。连续处理6 d,弃去上清,用冷PBS清洗3次,并加入300 μL 4℃预冷的甲醇固定细胞30 min。固定结束,吸除甲醇,加入0.1%的结晶紫溶液处理15 min,吸除多余溶液并烘干,在显微镜下拍照并记录。
1.5 Pull-down实验
根据之前的报道,进行了阿魏酸与细胞总蛋白质结合的实验并做了适当调整[10]。具体步骤如下:取2个1.5 mL干净EP管。其中,一管加入2 mg阿魏酸,然后每管加入100 μL的乙醚,轻轻摇匀,挥发掉管中乙醚;收集对数期生长的乳腺癌细胞MCF-7和4T1,加入适量的细胞裂解液于冰上裂解30 min, 然后,在4 ℃,12 000 r/min条件下离心15 min,收集上清获得蛋白质提取液;在上述EP管中分别加入等量的蛋白质提取液后封口,在4 ℃条件下使用垂直混合仪过夜,孵育结束后离心(4 ℃,12 000 r/min,15 min)弃上清,沉淀用PBS清洗2次,制备成蛋白质样品进行SDS-PAGE凝胶电泳,使用快速银染试剂盒并按照说明书进行银染操作;观察并标记差异条带,割胶保存差异条带并进行后续鉴定分析。
1.6 质谱鉴定
由上海中科新生命生物科技有限公司提供质谱鉴定服务。首先将凝胶进行还原和烷基化处理,即加入10 mmol/L二硫苏糖醇还原蛋白质,再加入55 mmol/L碘乙酸铵烷基化,最后加入胰蛋白酶(质量比1∶50)在37 ℃ 条件下,酶解20 h。酶解产物经脱盐后冻干,复溶于0.1%甲酸溶液中,使用液相色谱-串联质谱技术(Liquid Chromatography-Tandem Mass Spectrometry LC-MS/MS)(nanoLC-QE)进行质谱分析(上样缓冲液A液为0.1%甲酸的水溶液, B液为0.1%甲酸的乙腈水溶液)。通过全扫描采集多肽碎片的质量电荷比图谱,随后将获得的原始文件用Proteome Discoverer1.4软件检索在线蛋白质数据库Uniprot,最后得到鉴定的蛋白质结果。搜库参数为:Enzyme: Trypsin; Databaseuniprot_Homo_sapiens_ 194324_20210106;Fixed modifications: Carbamidomethyl (C); Dynamical modifications: Oxidation (M); Phospho (ST);Phospho (Y);GlyGly (K);Acetyl (K);Acetyl (Protein N-term); Max Missed Cleavages: 2; Filter by Peptide Confidence=High。
1.7 分子对接
分别从pubChem (https://pubchem.ncbi.nlm.nih.gov) 下载SDF格式的FA结构文件和Protein Data Bank(PDB, https://www.rcsb.org)数据库下载PDB格式的PYCR1结构文件。使用AutoDock Vina软件分别对FA和PYCR1进行去水、加氢和结构优化处理,并保存为PDBQT文件。进一步采用AutoDock Vina软件进行FA和PYCR1的分子对接,设置格点间隔值。设置Grid参数:center_x = 8.177,center_y = 44.722,center_z = 13.231,size_x = 92.15,size_y = 92.15,size_z = 82.45。运行程序模拟对接并保存对接结果。比较筛选结合能最低的结合构象,并保存为PDBQT文件。最后通过PyMOL软件对结合构象进行卡通(cartoon)展示并生成图片。
1.8 生物信息学分析
对PYCR1的基因表达分析采用在线分析工具GEPIA(http://gepia.cancer-pku.cn/)。选择“SingleGene Analysis”,选择Boxplot, 设定基因名 =PYCR1, Log2FC = 1,p-value = 0.01, Datasets = BRCA, 在线生成并导出PYCR1基因在乳腺癌患者和健康对照个体中差异表达的箱线图。选择Boxplot生成PYCR1在不同肿瘤分级中的差异表达的小提琴图。生存分析使用在线工具Kaplan-Meier Plotter (http://kmplot.com/analysis/)。选择“Breast cancer”,进入“KM Plotter”, 设定搜索条件Gene symbol=PYCR1,其余选项设置为默认,在线绘图并导出生存分析结果图。
1.9 酶活力检测
PYCR1具有噻唑烷-4-羧酸脱氢酶活性,催化噻唑烷-4-羧酸的脱氢反应,同时将辅酶Ⅰ(烟酰胺腺嘌呤二核苷酸,nicotinamide adenine dinucleotide, NAD)转化为还原型辅酶Ⅰ(nicotinamide adenine dinucleotide, NADH)。酶活性检测采用试剂盒(苏州科铭生物技术有限公司),并按照厂家说明书操作。具体步骤如下,取对数期生长的细胞,消化成单细胞悬液,以每皿106个细胞,接种于35 mm培养皿,37 ℃过夜培养,待细胞贴壁后加入不同浓度的阿魏酸处理24 h。处理结束后每皿加入1 mL酶提取液,超声破碎后12 000g,4 ℃离心并收集上清。将每104个细胞,每min产生1nmol NADH定义为1个酶活力单位,通过测定450 nm下吸光值增加率来检测酶的活性。
1.10 统计学方法
进行3 次以上独立的重复实验,数据由Origin 8.0 作图,数据图中用误差棒表示标准差,SPSS17.0 对数据进行统计分析,单因素方差分析采用t检验,*P<0.05,**P<0.01 表示具有统计学意义。
2 结果
2.1 阿魏酸体外抑制乳腺癌细胞的增殖
为了确定阿魏酸对乳腺癌的影响,使用不同浓度的阿魏酸处理人乳腺癌细胞MCF和小鼠乳腺癌细胞4T1。Fig.1A和B 的MTT结果显示,随着阿魏酸的浓度增加,乳腺癌细胞的存活率降低,且阿魏酸抑制MCF-7细胞存活的活性更强。SPSS拟合结果显示,阿魏酸对MCF-7的半抑制浓度(half maximal inhibitory concentration,IC50)为0.529 mg/mL, 对4T1的IC50值为0.631 mg/mL(Table 1)。为了进一步确定阿魏酸对细胞增殖的影响,本文进行了克隆形成实验,分别用不同浓度的阿魏酸处理4T1和MCF-7细胞。结果显示,阿魏酸呈剂量依赖式抑制乳腺癌细胞的增殖。当FA浓度达到0.6 mg/mL时,细胞集落形成能力被明显抑制(Fig.1C)。综上所述,这些结果表明,阿魏酸在体外可以有效抑制乳腺癌细胞的增殖。
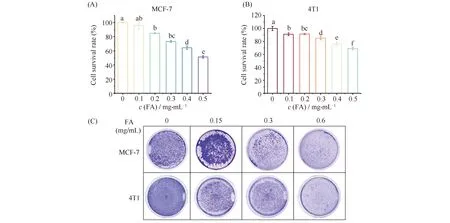
Fig.1 Detecting the inhibitory effects of ferulic acid on breast cancer cells (A, B) Human MCF-7 and mouse 4T1breast cancer cells (6 × 103 cells/well) were plated into 96 wells and the cells were exposed for increasing concentration of ferulic acid for 48 hours, respectively. (C)The colony-formation assay was used to test the inhibition of FA. Cells were treated with 0, 0.15, 0.3, 0.6 mg/mL FA for 6 days and the results showed that FA could decrease colonyformation of MCF-7 and 4T1.Data were presented as the means ± SD (n ≥ 5) and analyzed by ordinary one-way ANOVA with Tukey’s multiple comparisons. P< 0.05 was considered to be significant

Table 1 IC50values of FA on MCF-7 and 4T1 cells lines
阿魏酸对MCF-7的半抑制浓度(half maximal inhibitory concentration,IC50)为0.529 mg/mL, 对4T1的IC50值为0.631 mg/mL(Table 1)
2.2 阿魏酸靶向乳腺癌细胞中吡咯啉-5-羧酸还原酶1蛋白质
由于小分子物质靶向肿瘤细胞的特点,为进一步通过寻找阿魏酸的作用靶点,揭示其抑制乳腺癌细胞增殖的分子机制。结果正如Fig.2A和Pull-down结果所述,通过阿魏酸与细胞总蛋白质提取液共孵育,对孵育后的结合物进行凝胶电泳SDS-PAGE和快速银染。正如Fig.2B结果显示,与对照组相比,阿魏酸与蛋白质共孵育后,在30~35 kD之间出现了明显的差异条带。随后,通过LC-MS-MS(nanoLC-QE)检测, 并将检测结果与uniprot_Homo_sapiens_194324_20210106蛋白质数据库进行比对分析,筛选到了吡咯啉-5-羧酸还原酶1(pyrroline-5-carboxylate reductase,PYCR1),该蛋白质的分子量为33.4 kD。进一步结果(Fig.2C)显示,4T1细胞中用于定性PYCR1的肽段有15条,共检测到128个氨基酸 (amino acid, AA),占PYCR1全部319个AA的40.13%;MCF-7细胞中用于定性PYCR1的肽段有6条,共检测到69个AA,占总序列的21.63%(Fig.2D)。Fig.2C 和 D分别展示了4T1细胞和MCF-7细胞中PYCR1代表性肽段的二级质谱图。Fig.2E为该分子的3D结构图。

Fig.2 PYCR1 is one of the targets of FA in breast cancers (A)The pull-down assay was performed to find the target. Crystals of FA (2 mg) were dissolved with 100 μL diethyl ether in an EP tube, volatilized the diethyl ether to attach FA to the tube wall. FA was incubated with protein lysates overnight, then the mixture was centrifuged and collected, and the deposition was washed with PBS for three times. Then the mixture was separated on a 10% SDS-PAGE and stained with silver staining. The differential band was cut and analyzed using LC-MS/MS spectrometer by Shanghai Applied Protein Technology Co Ltd. (B)The representative images of silver staining gels. The markedly differential candidate protein was PYCR1.Two independent experiments were performed with consistent results.(C)Representative images of the secondary mass spectrometry of peptide fragments and the identified amino acid sequences in 4T1 cells. (D) Representative images of the secondary mass spectrometry of peptide fragments and the identified amino acid sequences in MCF-7 cells. (E)3D Structure diagram of the PYCR1 complex
2.3 阿魏酸靶向结合吡咯啉-5-羧酸还原酶1降低其酶活性
为了解阿魏酸和PYCR1的结合方式,本文采用AutoDock Vina 软件模拟阿魏酸和PYCR1的分子对接过程,结果正如Fig.3A所示,分子对接模拟完成,本文使用PyMOL对结果进行分析并可视化展示。结果显示,PYCR1与阿魏酸分子存在直接相互作用。阿魏酸分子通过与PYCR1蛋白质上的246 位谷氨酸和 251精氨酸发生直接的相互作用。由于PYCR1的主要功能是催化脯氨酸的生物合成,同时可以将NAD转化为NADH。因此,本文进一步通过检测NADH的产生评估了阿魏酸对PYCR1酶活力的影响,结果正如Fig.3 B和C所示,阿魏酸对PYCR1酶活性的抑制效应存在浓度依赖性,且当阿魏酸浓度达到0.6 mg/mL 时,MCF-7和4T1细胞中PYCR1的催化活性分别降低69.73%和64.65%。以上结果说明,阿魏酸通过和PYCR1发生直接相互作用从而抑制其酶活性。

Fig.3 FA bindsPYCR1 to suppress its catalytic activity in breast cancer cells (A)Binding model of FA-PYCR1. The left panel is the global view of the entire PYCR1 structure. The right panel is the focused view of FA in the binding site (FA in green). (B,C)The PYCR1enzyme activity was detected using a PYCR1 kit. Data were presented as the means ± SD (n ≥ 5) and analyzed by ordinary one-way ANOVA with Tukey’s multiple comparisons. P< 0.05 was considered to be significant
2.4 吡咯啉-5-羧酸还原酶1高表达与乳腺癌患者的不良预后正相关
PYCR1作为催化脯氨酸生物合成的一种还原酶,同时参与维持细胞内氧化还原电位和线粒体完整性,已经被报道在多种肿瘤组织中高表达。为了确定PYCR1表达和乳腺癌的关系,本文进一步分析了人类肿瘤基因图谱(TCGA)数据库中PYCR1和乳腺癌的相关关系。Fig.4A纳入1 085名乳腺癌患者和291名健康对照人群的PYCR1基因表达分析。结果显示,与健康个体相比,乳腺癌患者体内PYCR1的表达量明显升高。值得注意的是,PYCR1基因表达水平在乳腺癌发展的不同阶段未见显著性差异(Fig.4B)。同时,Fig.4C也表明,PYCR1高表达与乳腺癌患者的不良预后高度正相关。这些结果进一步说明,PYCR1可以作为乳腺癌治疗的一个潜在靶标候选。

Fig.4 Over-expression of PYCR1 was observed in the human breast cancer in TCGA data set (A) PYCR1 protein expression in normal tissues and breast cancers. (B) PYCR1 expression in different histological grades of breast cancers. (C) The survival rate was analyzed and compared between patients with low (n = 2466) and high (n = 2463) levels of PYCR1 in breast cancer samples. Log-rank test, P< 0.0001
3 讨论
近年来,随着医学和分子生物学的发展,肿瘤的发生机制和发展过程逐渐被揭示,这促进了抗肿瘤靶点的寻找及相应的治疗手段的快速发展。受到紫杉醇在抗癌研究中取得的重大成功的启发,越来越多研究者聚焦于从天然物质中获得有效成分。托泊替康(topotecan)、多西他赛(docetaxel)、泰索帝(taxotere)等抗肿瘤药物的相继问世,使得肺癌、乳腺癌、前列腺癌和结直肠癌等发病率较高的肿瘤治疗取得了良好的效果。针对乳腺癌的靶向治疗,20世纪90年代,从红豆杉中提取的紫杉醇通过诱导和促进微管蛋白的聚合和装配,使微管处于动态平衡状态,从而抑制细胞的有丝分裂和肿瘤细胞增殖,已在临床上成为治疗乳腺癌、宫颈癌和卵巢癌的首选特效化疗药[11]。针对乳腺癌对激素的依赖性,研究发现一种非甾体类药物他莫昔芬(Tamoxifen)可以经口服进入体内,并由肝代谢活化,形成一种ER的竞争性抑制剂,通过与雌激素竞争结合ER,阻止E2与ER的结合,干扰并阻断E2依赖性的乳腺癌生长[12-13]。这些发现进一步提示,对于乳腺癌的治疗,新的抗肿瘤靶点的寻找和相应的靶向药物的研发,对于提高乳腺癌治疗效率和改善患者预后有非常重要的临床意义。
基于上述研究,课题组长期致力于寻找天然作物谷子中的抗肿瘤活性成分。前期研究发现,谷糠中提取的结合态多酚具有良好的抑制结肠癌细胞生长和逆转细胞化疗耐药的能力。通过LC-TOF-MS系统鉴定出谷糠多酚中的活性抗肿瘤药物为阿魏酸和对香豆酸,且阿魏酸的抗肿瘤活性更高[9]。已有研究报道,阿魏酸具有抗炎、抗氧化、抗菌和抗肿瘤的药理活性[14-16]。但PYCR1是否作为FA的潜在靶点之一尚未见报道。本研究通过乳腺癌细胞发现了FA和PYCR1的直接作用,并进一步阐明了FA结合后对PYCR1的影响。
PYCR1在细胞的正常生理功能和各种疾病的发生发展中发挥着重要作用[17-18]。以往的研究报道,PYCR1与多种癌症例如前列腺癌、淋巴癌和乳腺癌的发生发展有关[19-21]。最近,又有文献报道,PYCR1可以作为疾病诊断和治疗的靶点。临床上,PYCR1的上调与肿瘤患者的性别、年龄和临床分型等因素相关[22]。因此,靶向PYCR1有可能作为乳腺癌患者的潜在治疗策略之一。我们发现,来源于植物中天然小分子物质阿魏酸可以在乳腺癌细胞中靶向PYCR1,引起其酶活性降低,从而抑制乳腺癌细胞的存活和增殖。然而,为了明确FA靶向PYCR1诱导乳腺癌细胞死亡的分子机制,进一步的研究是有必要的。同时,有研究报道称,PYCR1与上皮间质转化(EMT)密切相关[23],而EMT在乳腺细胞的侵袭性转移过程中扮演了重要角色[24]。因此,通过进一步的研究揭示阿魏酸对乳腺癌细胞的侵袭和转移是我们接下来的兴趣方向之一。值得注意的是,本文目前的研究聚焦于阿魏酸对人乳腺癌细胞MCF-7和小鼠乳腺癌细胞4T1的影响,因此,未来对于阿魏酸的抗乳腺癌效应需要纳入更多的肿瘤细胞以进一步评估。同时,建立动物乳腺癌模型,从而最大程度模拟阿魏酸在体内的抗肿瘤功效也是我们未来需要解决的问题之一。总之,本文的研究发现,天然小分子化合物阿魏酸通过直接结合乳腺癌细胞的受体PYCR1,从而抑制肿瘤细胞的恶性增殖,为乳腺癌的靶向治疗提供了新的理论基础,对于天然绿色、低毒高效的活性抗肿瘤药物开发提供了新思路。

