18氟-氟代脱氧葡萄糖 PET/CT代谢体积参数与宫颈癌 临床分期及血清鳞状细胞癌抗原的相关性研究
陈雪梅,訾 刚,李 辉,袁 超
(蚌埠医学院第一附属医院核医学科,安徽 蚌埠 233004)
目前,宫颈癌(cervical carcinoma,CCA)的发病率、死亡率在全世界女性恶性肿瘤中排名第4位[1]。现CCA的治疗主要依据患者的临床分期及是否伴有中高危因素等,以提高患者的生活质量为目的进行综合性的判断[2]。在精准医疗的时代背景下,准确可靠的临床诊断及疾病分期在为不同分期的患者制订个性化诊疗方案中起着关键性的作用[3]。在临床上,患者治疗前的病情评估一般按国际妇产科联合会(FIGO)的标准进行分期,但受医生经验和客观检查条件的限制,分期准确率有较大的局限性。正电子发射断层显像/计算机体层摄影术(PET/CT)作为目前多模态影像的代表,能够充分发挥X-CT的空间分辨率、密度分辨率高的优点,同时PET能够发挥其分子影像的特长,能通过病灶的葡萄糖及其他标记分子的影像学特点,帮助临床判断病灶良恶性[4]。并且PET/CT可以进行全身显像,对肿瘤的临床分期有很大的帮助[5]。研究表明,将18氟-氟代脱氧葡萄糖(18F-FDG) - PET/CT纳入CCA治疗前评估可提高约一半患者的分期准确性[6]。PETCT在CCA术前分期与病理分期符合率可达87.80%,高于术前FIGO分期的82.93%[7]。而在CCA诊断中,血清鳞状细胞癌抗原(SCC-Ag,以下简称“SCC”)水平,能为临床治疗CCA提供依据支持[8]。本研究拟对初诊的85例宫颈鳞癌患者的18F-FDG PET/CT全身显像及血清SCC检测结果进行回顾性分析,探讨18F-FDG PET/CT的半定量参数与CCA临床分期及血清学SCC之间的相关性。
1 资料与方法
1.1 一般资料选取2018年7月至2021年12月蚌埠医学院第一附属医院收治的85例初诊CCA患者为研究对象进行回顾性研究,所有患者病理活检结果均为鳞状细胞癌。按临床分期不同分为I期组(4例,临床期Ⅰ期)、Ⅱ期组(24例,临床Ⅱ期)、Ⅲ期组(49例,临床Ⅲ期)及Ⅳ期组(8例,临床Ⅳ期)。临床分期标准采用2018年国际CCA分期FIGO标准[9]。本研究经蚌埠医学院第一附属医院医学伦理委员会批准,患者及其家属均签署知情同意书。纳入标准:①均进行宫颈活组织检验,并且经病理类型证实为鳞状细胞癌;②治疗前所有患者常规行血清SCC检测,且所有患者均进行了18F-FDG PET/CT全身显像。排除标准:经治疗或干预的CCA患者。
1.2 检查方法所有患者均采用PET/CT(德国西门子公司,型号:Biograph mCT)进行检查。显像剂采用18F-FDG,由南京江原安迪科正电子研究发展有限公司生产提供,放化纯大于95%。显像前所有患者均禁食6 h以上,注射前检查患者血糖,并控制在9.0 mmol/L以下。经静脉三通管,在患者平静状态下注射显像剂18F-FDG,剂量按3.7 MBq/kg计算。药物注射后患者在候诊室内处于安静休息状态40~60 min,室内保持安静、弱光线,并且室温保持在25 ℃。检查前饮水500 mL,排空小便,然后行PET/CT全身显像。PET扫描采用3D采集模式,依据患者身高通常6~7个床位(每个床位2 min)。CT常规扫描条件为120 kV、100 mA、层厚5 mm。采集完成后应用同机X-CT的数据对PET的采集数据进行衰减校正,而后由计算机采用有序子集最大期望值迭代法(OSEM)进行图像重建,最终获得冠状面、横断面与矢状面影像及PET与CT的融合图像。
1.3 图像的观察所有原始数据上传致MedEx图像处理工作站,帧对帧进行图像的对位与融合显示,利用 MedEx软件后处理系统对PET和CT数据进行处理,沿CCA病灶区域进行感兴趣勾画,采用固定阈值法,以最大标准摄取值(SUVmax)的45%作为阈值,由MEDEX后处理系统在横断位、矢状位和冠状位上对病灶进行自动容积分割,得出原发病灶的SUVmax,平均标准摄取值(SUVmean)和肿瘤的糖代谢体积(MTV)。计算糖酵解总量(TLG),TLG=MTV×SUVmean。
1.4 统计学分析采用SPSS 26.0统计学软件进行数据分析。计量资料以()表示,多组间比较采用方差分析,两两比较采用LSD-t检验;计数资料以[例(%)]表示,多个样本资料的比较采用Kruskal-Wallis检验,采用Spearman级矩相关分析评价各参数间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 CCA患者年龄及SCC升高情况比较收集未进行任何治疗的CCA患者共85例,其中>60岁患者共49例,≤60岁患者共36例。85例患者SCC水平均升高。其中Ⅰ期组患者共4例,Ⅱ期组患者24例,Ⅲ期组患者49例,Ⅳ期组患者8例。各组之间年龄比较,差异无统计学意义(P>0.05)。并且,各组间患者SCC水平升高占比比较,差异无统计学意义(P>0.05),见表1。

表1 CCA患者年龄及SCC升高情况比较
2.2 4组患者18F-FDG PET /CT 显像结果与临床分期比较4组患者病灶FDG摄取的SUVmax值比较,差异无统计学意义(P>0.05),Ⅲ期组及Ⅳ期组患者的MTV、TLG、SCC水平高于Ⅱ期组及I期组,差异有统计学意义(P<0.05),见表2、图1、图2。进一步的Spearman级矩相关性分析结果显示,FDG摄取的代谢体积参数MTV。TLG及SCC与临床分期呈正相关,而FDG摄取的SUVmax与临床分期无显著的相关性。同时,FDG摄取的代谢体积参数MTV、TLG与SCC呈正相关,见表3。
表2 CCA患者不同临床分期间病灶FDG摄取参数 及SCC比较()

表2 CCA患者不同临床分期间病灶FDG摄取参数 及SCC比较()
注:SUVmax:最大标准摄取值;MTV:肿瘤的糖代谢体积;TLG:糖酵解总量;SCC:鳞状细胞癌抗原。

表3 CCA患者不同临床分期与病灶FDG摄取参数及SCC的相关性分析
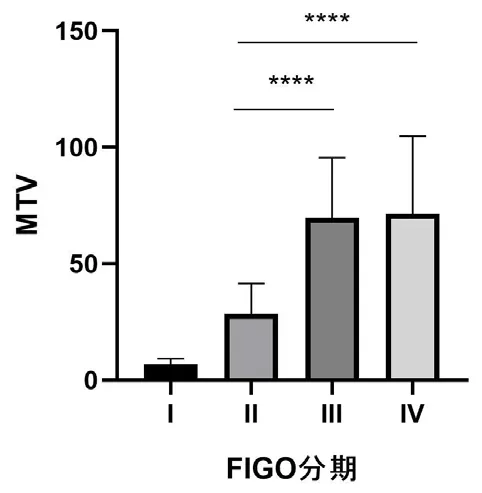
图1 各组MTV的比较

图2 各组TLG的比较
3 讨论
目前对于初诊CCA患者临床采用FIGO分期指导治疗方案的选择,而与最终的手术分期比较,FIGO分期的错误率在20%左右[10]。PET/CT作为目前最先进的多模态影像设备,不但能够显示患者的精确解剖影像,而且可以显示患者的功能影像。研究发现,将18F-FDG PET/CT纳入CCA治疗前的评估可提高约半数患者的分期准确性,对CCA分期有重要意义[11]。本研究回顾性分析了85例CCA初诊患者的PET/CT显像及血清SCC的结果,旨在探讨PET/CT的代谢参数与CCA临床分期及血清SCC之间的相关性,以期用于提高初诊CCA临床分期的准确性。
首先,PET/CT显像可以清楚显示宫颈肿瘤的精确解剖部位、大小及侵犯程度,而且能显示FDG的摄取强度和均匀性。其次,可以明确局部及全身淋巴结的转移范围和FDG代谢增高的程度。最后还可以发现全身其他脏器有无转移病灶,因此,FDG PET/CT显像为CCA的诊断和分期提供了更加可靠的客观依据,有利于临床制订合理的治疗方案[12]。
然而,常规FDG半定量指标SUVmax仅能反映病灶中葡萄糖代谢单位体积的最大值,对宫颈原发病灶的定性诊断有重要的意义,但本研究结果表明,它与不同分期的CCA之间无相关性。进一步的统计结果表明,CCA的临床分期与肿瘤的代谢参数MTV、TLG之间存在显著的相关性。MTV及肿瘤的TLG是另一类PET/CT代谢参数,它们引入了包含病灶体积的因素:MTV是指肿瘤组织中具有代谢活性组织的体积,是集代谢与体积为一体的半定量参数,反映异常代谢的肿瘤细胞数量;而TLG是指以肿瘤代谢体积为基础的糖酵解总量,是一个既能反映肿瘤代谢活性又能反映肿瘤代谢体积的综合参数。不同于SUVmax,肿瘤的代谢体积参数MTV是在肿瘤代谢活性的基础上测量肿瘤的体积,也与常规影像CT或MRI仅计算肿瘤体积有一定的区别[13]。TLG则结合了肿瘤的代谢体积及18F-FDG代谢摄取的综合因素后,可以更全面分析病变整体的糖代谢及负荷情况[14]。MTV和TLG作为预后因素在某些肿瘤中已被证明优于SUVmax[15]。而本研究则表明不同CCA样本的MTV、TLG参数差异具有统计学意义,进一步的相关性分析发现,随着分期提高,MTV、TLG也随之提高。这为妇科医生在初诊CCA的临床分期评估中增加一个重要的客观指标。
SCC广泛存在于不同器官的正常组织中,它可以通过抑制肿瘤细胞的凋亡,参与肿瘤的恶性生物学过程。在CCA患者血清中SCC显著高表达,目前血清SCC指标已广泛用于CCA患者的复发、预后判断,受到了临床高度认可和重视。近期有学者进一步研究认为血清SCC的表达水平也与患者临床分期有显著的相关性[16]。据此本研究进一步分析了CCA患者术前18F-FDG PET-CT的代谢参数与血清 SCC表达水平间的相关性,结果发现18F-FDG PET-CT的常规代谢参数SUVmax与血清SCC值无相关性,而代谢体积参数MTV、TLG与血清SCC值之间存在显著的相关性。其可能的原因是肿瘤的常规代谢参数SUVmax仅代表原发病灶内肿瘤细胞的异质性,与肿瘤的实质体积无关;而体积代谢参数MTV、TLG及血清SCC值的高低均与肿瘤实质的体积及分化程度相关。这也为我们今后进一步研究18F-FDG PET-CT联合血清SCC检测进一步提高初诊CCA患者的临床分期的准确性提供了新的可能。
综上所述,不同分期CCA样本的MTV、TLG参数差异具有相关性,且随着分期提高,MTV、TLG也随之提高,同时,而代谢体积参数MTV、TLG与血清SCC值之间也存在显著的相关性。因此,FDG PET/CT显像为CCA的诊断及病情评估提供了更加可靠的客观依据,有利于临床制订合理的治疗方案。

