小鼠横向主动脉弓缩窄与异丙肾上腺素注射构建心肌肥厚模型方法的比较
曾文如,王东伟,邵晓奇
(广东药科大学中医药研究院,广东广州 510006)
心力衰竭是临床发病率和病死率较高的常见疾病之一,流行病学调查结果显示,由心肌肥厚导致的慢性心力衰竭(chronic heart failure,CHF)是多种心血管疾病的共同结局,也是心血管疾病死亡的主要原因,并且其发病率逐年上升,严重危害人类生命健康[1-2]。由于慢性心力衰竭的发病机制十分复杂,且不同动物模型的心脏功能变化和触发的信号通路也不尽相同。因而,CHF 动物造模限制了抗心衰药物的研发进展[3-4]。小鼠是最常用的模拟人类疾病模型的实验动物,小鼠心衰模型的建立有多种方法[5-6],目前主要采用两种方法:化学药物诱导和物理手术。异丙肾上腺素(isoproterenol,ISO)是一种非选择性β 受体激动剂,通过激动心脏β 受体,使心率加快,心肌耗氧量增强,引起心肌损伤,其发病机制主要与炎症反应、氧化应激和凋亡有关,可直接或间接作用于心肌组织,造成心肌轻度损伤,引起心肌肥厚,引起心力衰竭[7-8]。ISO 诱导心衰模型,具有简单、易操作、无创伤、重复性高等优点,但其缺点是建模时间不一致,因个体反应性而存在差异。主动脉弓缩窄术(transverse aortic constriction,TAC)是通过定量缩窄主动脉,模拟心脏在长时间压力和容量负荷下,转变为心力衰竭所致的心肌肥厚[9-10]。TAC 手术能模拟由于后负荷增加而导致的心肌肥厚,以及失代偿转变的慢性心衰过程,具有重复性高的优点,但对实验人员的技术要求严格、学习周期长、手术后死亡率高[11]。本研究采用C57BL/6 小鼠TAC 或IS O 制备小鼠CHF 模型,旨在研究两种小鼠模型在超声心动图、炎症肥大指标和病理等方面的差异,以及不同方法制备的CHF 动物模型进行心功能改变和特点的探讨,更好地模拟临床上不同发病原因的心衰患者,为慢性心衰的治疗策略提供新的角度。
1 材料与方法
1.1 实验动物
C57BL/6 小鼠40 只,SPF 级,雄性,8 周龄,体质量(20±2)g,购于广东省医学实验动物中心,生产许可证号:SCXK(粤)2020-0051。小鼠实验前适应性饲养1 周,饲养于SPF 级动物房,伦理委员会批准号:gdpulacspf2017277。
1.2 药物、主要试剂、仪器
盐酸异丙肾上腺素(规格:5 g,货号SIGMAI5627,Sighna 公司);异氟烷麻醉剂(规格:100 mL,货号R510-22-10,瑞沃德公司);叔戊醇(规格:100 mL,货号S140673-100 mL,上海阿拉丁);医用超声耦合剂(规格:250 mL,货号TM-100 型,天津津亚);脱毛膏(规格:2 5 g,货号X S-0 0 6 1,广州科荣生物有限公司-薇婷);氯化钠注射液(规格:500 mL,货号LS-366966-1,广州源满生物科技有限公司);3M 医用胶带(规格:1.2 cm 宽3 卷/组,货号ZJ2652,江西奥斐特商贸有限公司);Vevo2100 小动物超声影像系统(Canada Visual Sonics);3R210-06气体麻醉机(Midmark);SI-0256涡旋混匀器(VORTEX-GENIE);FA2204 十万分之一分析天平(上海市安亭电子仪器厂)。
1.3 动物模型的建立
1.3.1 TAC 模型 随机将小鼠分为假手术组和TAC手术组,每组各10只,小鼠进行异氟烷气体麻醉后,置于水平固定鼠板上,将27G 垫针置于右头臂动脉与左颈总动脉之间,并将主动脉弓结扎,随后抽出缩窄针,用碘伏擦拭创面,逐层关闭胸腔,缝好皮肤,并置于暖光灯旁[6]。
1.3.2 ISO 诱导模型 随机将小鼠分为正常对照组、ISO 组,每组各10 只。小鼠皮下注射剂量8 mg/mL ISO(0.1 mL/20 g),连续注射14 d,对照组小鼠给予等剂量的生理盐水,不作其他处理[7]。
1.4 超声心动图及相关指标的检测
通过超声检查B型、M型切面,定量分析心脏功能指标。观察舒张期和收缩期的室间隔厚度(IVSd、IVSs)、左心室内径(LVIDd、LVIDs)、左心室壁厚度(LVPWd、LVPWs)、射血分数(EF%)、短轴缩短分数(FS%)和E/A(E 峰:左室舒张早期快速充盈的充盈峰,A 峰:舒张晚期心房收缩充盈的充盈峰)的变化。
1.5 炎症因子的检测
小鼠TAC 术后12 周和ISO 给药14 d 后,通过qRT-PCR 实验检测小鼠心脏组织中IL-1β、IL-18、TNF-α等炎症因子的表达水平。
1.6 标本采集与处理
TAC术后12周,连续注射ISO 2周后,收集小鼠心脏,将其中一部分冷冻于-80 ℃,用于后续实验,其余心脏组织浸于4%(φ)多聚甲醛中,用于后续病理组织学分析。
1.7 病理组织学检测
通过HE 和Masson 实验观察TAC 手术和ISO给药小鼠心脏组织中的心肌细胞的排列、炎症浸润和纤维化情况。
1.8 统计学分析
采用GraphPadPrism7 软件进行分析,两组之间的差异比较采用非配对T检验,多组间采用单向方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 超声观察
2.1.1 TAC小鼠超声心动图观测 在TAC术后第0、2、4、6、8、10、12 周,通过超声心动图验证TAC 造模手术成功,并进行心脏功能检测。超声心动图显示,TAC 手术12 周心脏出现收缩和舒张功能障碍(图1)。

图1 Sham组和TAC小鼠组超声结果图Figure 1 Ultrasound findings in sham and TAC mice groups(n=10)
2.1.2 TAC 小鼠超声心动图观察不同时间点心脏的结构和功能变化情况 结果显示,小鼠心室壁厚度和心腔宽度随着时间不断变化,心室壁由薄变厚再变薄,心室腔由宽变窄再变宽,说明小鼠心脏功能从代偿期向失代偿期转变,逐渐发展为心力衰竭。EF%结果显示心脏收缩功能先升高后降低(图2)。
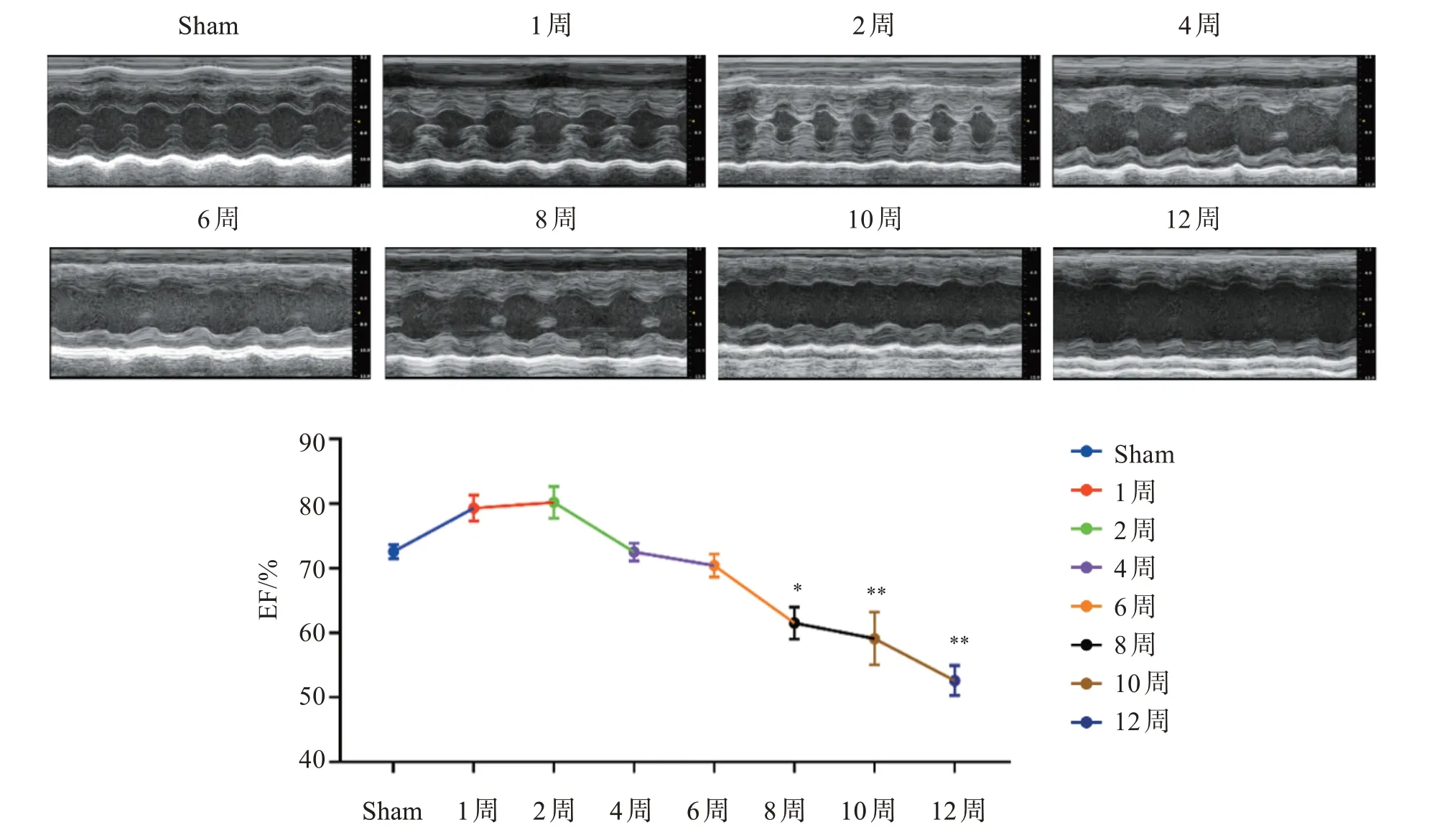
图2 TAC小鼠0~12周M-Mode胸骨旁长轴切面超声图及EF%随时间变化情况Figure 2 Changes of M-Mode parasternal long axis ultrasound and EF% with time in mice at 0-12 weeks(,n=10)
2.1.3 ISO 小鼠超声心动图观测 小鼠腹腔注射ISO 后第0、14 天,通过超声心动图对小鼠进行心脏功能检测,ISO 小鼠在造模后发生了明显的心室扩张,心室壁变薄,并且E/A 峰比值下降,结果表明模型组小鼠心脏发生了结构变化和功能障碍(图3)。

图3 Sham组和ISO小鼠超声结果图Figure 3 Ultrasound results of sham mice and ISO mice(n=10)
2.2 TAC模型与ISO模型小鼠一般指标比较
2.2.1 两种模型肥大指标比较 与假手术组和正常对照组小鼠相比,TAC 手术组和ISO 给药组小鼠的心脏质量与体质量的比值(HW/BW)和心脏质量与胫骨长度比值(HW/TL)明显升高。通过观察HE 局部放大图发现ISO 和TAC 小鼠心脏肌肉长度较Sham组显著增加,表明小鼠的心脏发生肥大。实验结果表明,HW/TL 和HW/BW 在两种模型中变化基本一致,说明两种造模方法都具有比较好的重复性和可靠性(图4)。

图4 两组模型小鼠的HW/BW、HW/TL及HE染色、乳头肌放大图Figure 4 HW/BW,HW/TL and HE staining,enlarged papillary muscle of two groups of model mice(,n=10)
2.2.2 两种模型心脏功能指标比较
与假手术组小鼠相比,TAC 术后12 周或ISO 给药14 d 后EF%、FS%下降,E/A 峰比值下降;左心室壁变薄同时心腔容积明显增大,心脏发生明显的舒张功能障碍。两种手术后的降低程度基本一致,说明两种造模方法都能诱导心衰(图5)。

图5 两组模型小鼠EF%、FS%和E/A峰比值Figure 5 EF%,FS%and E/A peak ratio of two groups of model mice(,n=10)
2.2.3 两种模型心脏室壁变化比较
假手术组小鼠心腔无明显扩张,室间隔厚度(IVS)和LVPW、LVID均在正常范围内;与假手术组小鼠相比,TAC 手术后其心脏收缩能力、室间隔厚度、左心室室壁厚度均有明显上升,心腔微幅扩张,表现出典型的向心性肥厚。并且TAC 手术12 周后左心室壁变薄,心腔容积明显增大。而ISO给药小鼠的心脏功能与对照组小鼠相比,存在明显的功能紊乱并显示出心室容积增加,室间隔厚度和左心室壁厚度有小幅下降的趋势,这说明ISO组的小鼠存在心脏舒张功能障碍。TAC 小鼠与ISO 小鼠相比,IVS、LVPW 在收缩舒张变化不大,LVID 在舒张收缩时有显著差异性(P<0.01),这说明两种不同模型诱导肥厚或纤维化的起始部位可能存在差异性(图6)。

图6 两组模型小鼠IVS、LVPW、LVIDFigure 6 IVS,LVPW and LVID of two groups of model mice(,n=10)
2.3 两组模型小鼠心脏组织病理学观察
HE 染色结果显示,假手术组和正常对照组小鼠的心肌细胞排列整齐,细胞核无明显皱缩现象,细胞形态正常;而TAC 组和ISO 组小鼠的心肌细胞排列紊乱,细胞核变大,细胞体积明显增大,并伴随明显的炎症细胞浸润。Masson染色结果表明,假手术组和正常对照组小鼠的肌纤维呈鲜红色,而TAC组小鼠的心脏组织出现大面积的蓝色阳性信号,发生明显的胶原纤维沉积,ISO 模型小鼠心脏组织中也观察到类似的现象。通过对比发现ISO诱导小鼠发病部位为心室内壁以及右心室,而TAC 诱导的模型小鼠发病部位主要为乳头肌及左心室,尽管最终计算出相同的心功能参数,两种模型的致病机理和分子机制可能不同(图7)。

图7 两组模型小鼠HE染色和Masson染色结果图Figure 7 HE and Masson staining results of two groups of model mice(n=3)
2.4 两组模型小鼠心脏组织中炎症反应的变化
与假手术组小鼠相比,TAC IL-1β、IL-18、TNF-α的mRNA表达水平升高。ISO组小鼠心脏中也观察到类似的IL-1β升高情况,但IL-18、TNF-α趋势表达相反(图8)。
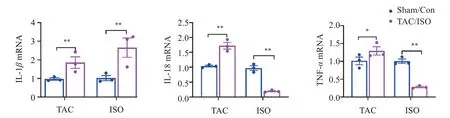
图8 两组模型小鼠炎症相关因子IL-1β、IL-18、TNF-α的表达Figure 8 Expression of inflammatory related factors IL-1β,IL-18 and TNF-α in two groups of model mice(n=10)
3 讨论
小鼠动物模型是模拟研究临床疾病发病机理、开展药物研制的重要依据。由于人口老龄化加剧,心血管发病率和病死率逐年上升,严重危害人类的生命健康。心血管疾病引起的心力衰竭往往是患者死亡的主要原因。心力衰竭是指心脏的收缩或舒张功能障碍,使心脏输出量减少,从而导致心脏血液循环障碍[12]。目前,慢性心力衰竭及其发病机制尚未完全明确,建立和评价小鼠心衰模型意义重大。本研究通过TAC 和皮下注射ISO 建立慢性心衰模型,通过超声心动图对不同造模条件下小鼠心脏功能的变化进行评估,并通过HE染色、Masson染色和qRT-PCR 实验对炎症和纤维化相关标志物的变化进行检测。
超声心动图检测是评价心脏功能的指标之一。本研究连续12 周对TAC 诱导的小鼠进行心功能检测,反映小鼠心室壁厚度、心腔宽度随时间变化等特点。常用HW/BW、HW/TL 的变化来评价心脏肥大的程度[13-14],TAC 和ISO 的造模方式都对小鼠心肌肥大有明显的诱导作用。但根据Masson 染色的结果,TAC 诱导心肌纤维化的好发部位是乳头肌,ISO 则是心室内壁。由于TAC 是模拟心脏后负荷增加,还原高血压引起的心力衰竭,所以这种方法比较符合临床上充血性心力衰竭的病理变化过程。而ISO 腹腔注射引起的心脏衰竭,尽管操作简单,但其发病机理复杂,尚需深入研究。研究表明心脏逐渐积累的炎症是导致心脏衰竭的关键因素之一,PCR 结果显示,炎症因子IL-1β在两个模型中的表达明显增加,而ISO 诱导的模型中IL-18、TNF-α的表达明显减少,考虑到两个模型诱导的时间不同,纤维化部位不一致可能是炎症信号通路不同所致。推测在心肌肥厚模型中起主导作用的致病因子为IL-1β,但其具体的分子机理仍需进一步探究。炎症是心脏多种急慢性疾病的共同致病因素。本研究表明,不同诱因引起的炎症类型和炎症因子不同,需要密切结合研究内容进行课题设计。

