去氢木香内酯通过PI3K/Akt/mTOR 通路对鼻咽癌细胞自噬和凋亡的影响及机制
李征,蔡晓航,李钢,赵爽
(1.南阳市第一人民医院耳鼻咽喉科,河南南阳 473000;2.河南省肿瘤医院头颈甲状腺外科,河南郑州 450000)
鼻咽癌是一种起源于鼻咽上皮细胞的高度侵袭性和转移性癌症,在东南亚和华南地区高发[1],发病机制尚不完全清楚,化疗和放疗为其主要治疗策略,然而鼻咽癌患者的5 年总生存率仍然很低[2],积极探索潜在的新型鼻咽癌治疗靶点具有重要意义。自噬是细胞在自噬相关基因控制下利用溶酶体降解受损细胞器和大分子物质的过程,与癌细胞增殖、侵袭和耐药相关[3]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycinm,mTOR)信号通路与调节多种癌症中的自噬、凋亡、化疗耐药性及转移相关[4],有研究表明抑制该信号通路可增加癌细胞自噬通量,并诱导癌细胞凋亡[5]。去氢木香内酯(dehydrocostuslactone,DCL)为木香主要活性成分,具有抗炎、抗菌、改善胃肠功能以及抗肿瘤等广泛生物学作用[6]。研究发现,其可诱导胃癌细胞自噬和凋亡[7],但关于其是否可介导PI3K/Akt/mTOR 通路诱导鼻咽癌细胞自噬和凋亡尚待探究。故本研究拟体外培养鼻咽癌细胞系CNE1,经不同浓度DCL培养,观察其对CNE1细胞自噬、凋亡及通路相关蛋白表达的影响,以期为鼻咽癌进展分子机制及临床用药选择提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 细胞系 人鼻咽癌细胞株CNE1 购自ATCC细胞库。
1.1.2 主要试剂 DCL(质量分数≥98%,YRQ002)购自成都仪睿生物科技有限公司;Matrigel 基质胶(356234)购自美国BD 公司;Hoechst 33258 染色液(B8030)、AnnexinV-FITC/PI 流式细胞凋亡检测试剂盒(CA1020)购自北京索莱宝生物科技公司;微管相关蛋白1A/1B 轻链3(microtubule associated protein 1A/1B light chain 3,LC3)(ab63817)、p62(ab264313)、B 细胞淋巴瘤/白血病-2 基因(B-cell leukcmia/lymphoma 2,Bcl2)(ab196495)、Bcl2 相关X 蛋白(Bcl2 associated X protein,Bax)(ab53154)、cleaved caspase-3(ab49822)抗体购自美国Abcam 公司;PI3K(bs-10657R)、p-PI3K(bs-6417R)、p-Akt(bs-2720R)、mTOR(bs-1992R)、p-mTOR(bs-3494R)购自北京博奥森生物技术有限公司;Akt(AA326)购自上海碧云天生物科技有限公司。
1.1.3 主要仪器 550 型全自动酶标仪购自美国Bio-Rad 公司;CytoFLEX 流式细胞仪购自美国贝克曼库尔特公司;FluorChem HD2 化学发光凝胶成像系统购自美国ProteinSimple公司。
1.2 方法
1.2.1 细胞培养 CNE1 细胞接种于含有10%(φ)胎牛血清的RPMI 1640 培养基中(100 u/mL 青霉素、100 μg/mL 链霉素),于37 ℃在体积分数为5%CO2的加湿培养箱中培养,待细胞生长至70%~80%汇合时,以1∶3比例进行消化传代。
1.2.2 CCK8法检测CNE1细胞存活率 于对数生长期收集CNE1细胞,以每孔2×103个细胞接种100 μL单细胞悬液至96 孔板,不同浓度DCL(0、5、10、20、40 μmol/L)培养液培养48 h,于孔内直接加入10 μL CCK8 试剂并孵育2 h。全自动酶标仪测定450 nm处的吸光度值(A),细胞存活率(%)=实验组吸光度值/对照组吸光度值×100%(实验组指DCL 培养组,对照组不含DCL),重复3次。
1.2.3 Hoechst 33258 荧光染色法观察细胞凋亡形态 CNE1 细胞以1×104个细胞/mL 密度接种至6 孔板,不同浓度DCL(0、5、10、20、40 μmol/L)培养液培养48 h,磷酸盐缓冲溶液(phosphate buffer solution,PBS)洗涤并收集细胞沉淀,4%(φ)甲醛固定10 min,PBS 洗涤,0.5 mL Hoechst 33258 溶液避光染色15 min。倒置荧光显微镜下观察细胞凋亡,凋亡细胞的细胞核呈碎片状固缩,显示为强荧光。
1.2.4 流式细胞仪检测细胞凋亡率 CNE1 细胞以5×104个细胞/mL 密度接种至6 孔板,不同浓度DCL(0、5、10、20、40 μmol/L)培养液培养48 h,收集细胞,PBS 洗涤并收集细胞沉淀,重悬于200 µL 含有10 µL Annexin V FITC 和5 µL PI 的结合缓冲液中,室温下避光孵育30 min 后,进行流式细胞术分析以评估细胞凋亡率。
1.2.5 透射电子显微镜观察细胞自噬体形成 CNE1细胞以5×104个细胞/mL 密度接种至6 孔板,不同浓度DCL(0、5、10、20、40 μmol/L)培养液培养48 h,收集细胞沉淀,2.5%戊二醛中固定2 h,2%四氧化锇在0.1 mol/L 碳酸钙酸钠缓冲液中处理,梯度丙酮脱水,后嵌入Epon 812 环氧树脂,Leica EM UC7 超薄切片机上制备65 nm 超薄切片并进行透射电子显微镜分析。
1.2.6 Western blotting 技术检测相关蛋白表达情况收集经不同浓度DCL(0、5、10、20、40 μmoL/L)培养液培养48 h后的细胞沉淀,RIPA裂解液提取细胞总蛋白,BCA 法测定蛋白浓度,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离等量的蛋白质并转移到聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭2 h,然后与一抗(均1∶1 000 稀释)孵育过夜,后与辣根过氧化物酶标记的二抗(1∶10 000稀释)室温孵育2 h,增强的化学发光试剂显影,化学发光凝胶成像系统曝光,Image J 分析条带灰度值,以目的蛋白与内参β-actin 灰度值比值表示蛋白相对表达量,以磷酸化蛋白相对表达量与全蛋白相对表达量比值表示蛋白活性水平。
1.3 统计分析
采用SPSS 26.0 软件进行数据统计学处理,计量资料比较采用单因素方差分析,两组间比较采用LSD-t检验,计量资料以表示。P<0.05为差异有统计学意义。
2 结果
2.1 DCL对CNE1细胞存活率的影响
CCK8检测结果显示,CNE1细胞存活率随DCL作用浓度增大而降低(P<0.05)。见表1。
表1 不同浓度DCL培养下CNE1细胞存活率Table 1 Survival rate of CNE1 cells under different concentra‐tions of DCL(,n=5) %

表1 不同浓度DCL培养下CNE1细胞存活率Table 1 Survival rate of CNE1 cells under different concentra‐tions of DCL(,n=5) %
与0 μmol/L DCL 比较:*P<0.05;与5 μmol/L DCL 比较:#P<0.05;与10 μmol/L DCL 比较:@P<0.05;与20 μmol/L DCL 比较:&P<0.05。
2.2 DCL对CNE1细胞凋亡形态的影响
Hoechst 33258染色结果显示,未添加DCL培养组细胞生长良好,细胞核完整,染色质分布均匀;DCL 作用48 h 后,细胞核质凝聚呈碎片状固缩,形成凋亡小体,随着DCL 浓度的增加,细胞染色和荧光增强,凋亡细胞逐渐增多。见图1。

图1 不同DCL作用浓度下CNE1细胞核Hoechst 33258染色结果(200×)Figure 1 Hoechst 33258 staining of CNE1 nuclei at different DCL concentrations(200×)
2.3 DCL对CNE1细胞凋亡率的影响
流式细胞术检测结果显示,CNE1 细胞凋亡率随DCL浓度增大而升高(P<0.05)。见图2,表2。
表2 不同浓度DCL培养下CNE1细胞凋亡率Table 2 Apoptosis rate of CNE1 cells under different concen‐trations of DCL(,n=3) %

表2 不同浓度DCL培养下CNE1细胞凋亡率Table 2 Apoptosis rate of CNE1 cells under different concen‐trations of DCL(,n=3) %
与0 μmol/L DCL 比较:*P<0.05;与5 μmol/L DCL 比较:#P<0.05;与10 μmol/L DCL 比较:@P<0.05;与20 μmol/L DCL比较:&P<0.05。

图2 不同DCL作用浓度下CNE1细胞凋亡情况Figure 2 CNE1 cell apoptosis under different DCL concentrations
2.4 DCL对CNE1细胞自噬体形成的影响
透射电子显微镜观察结果显示,自噬体随DCL作用浓度增大而逐渐积累。见图3。

图3 不同浓度DCL培养下CNE1细胞自噬体形成情况Figure 3 Autophage formation of CNE1 cells under different concentrations of DCL(30 000×)
2.5 DCL 对PI3K/Akt/mTOR 信号通路相关蛋白表达的影响
Western blotting 检测结果显示,PI3K、Akt 和mTOR 蛋白活性水平均随DCL 作用浓度增大而降低(P<0.05)。见图4,表3。
表3 不同浓度DCL培养下CNE1细胞通路相关蛋白活性水平Table 3 Activity levels of CNE1 cell pathway related proteins under different concentrations of DCL(,n=3)

表3 不同浓度DCL培养下CNE1细胞通路相关蛋白活性水平Table 3 Activity levels of CNE1 cell pathway related proteins under different concentrations of DCL(,n=3)
与0 μmol/L DCL 比较:*P<0.05;与5 μmol/L DCL 比较:#P<0.05;与10 μmol/L DCL 比较:@P<0.05;与20 μmol/L DCL比较:&P<0.05。

图4 不同浓度DCL培养下CNE1细胞通路相关蛋白条带Figure 4 Protein bands related to CNE1 cell pathway under different concentrations of DCL
2.6 DCL对自噬及凋亡相关蛋白表达的影响
Western blotting 检测结果显示,LC3Ⅱ/LC3Ⅰ比值、Bax 和cleaved caspase-3 蛋白相对表达水平随DCL 作用浓度增大而升高,p62、Bcl2 蛋白相对表达水平随DCL 作用浓度增大而降低(P<0.05)。见图5,表4。
表4 不同浓度DCL培养下CNE1细胞通路自噬和凋亡蛋白相对表达水平Table 4 Relative expression levels of autophagy and apoptosis proteins in CNE1 cells under different concentrations of DCL(,n=3)

表4 不同浓度DCL培养下CNE1细胞通路自噬和凋亡蛋白相对表达水平Table 4 Relative expression levels of autophagy and apoptosis proteins in CNE1 cells under different concentrations of DCL(,n=3)
与0 μmol/L DCL 比较:*P<0.05;与5 μmol/L DCL 比较:#P<0.05;与10 μmol/L DCL 比较:@P<0.05;与20 μmol/L DCL 比较:&P<0.05。
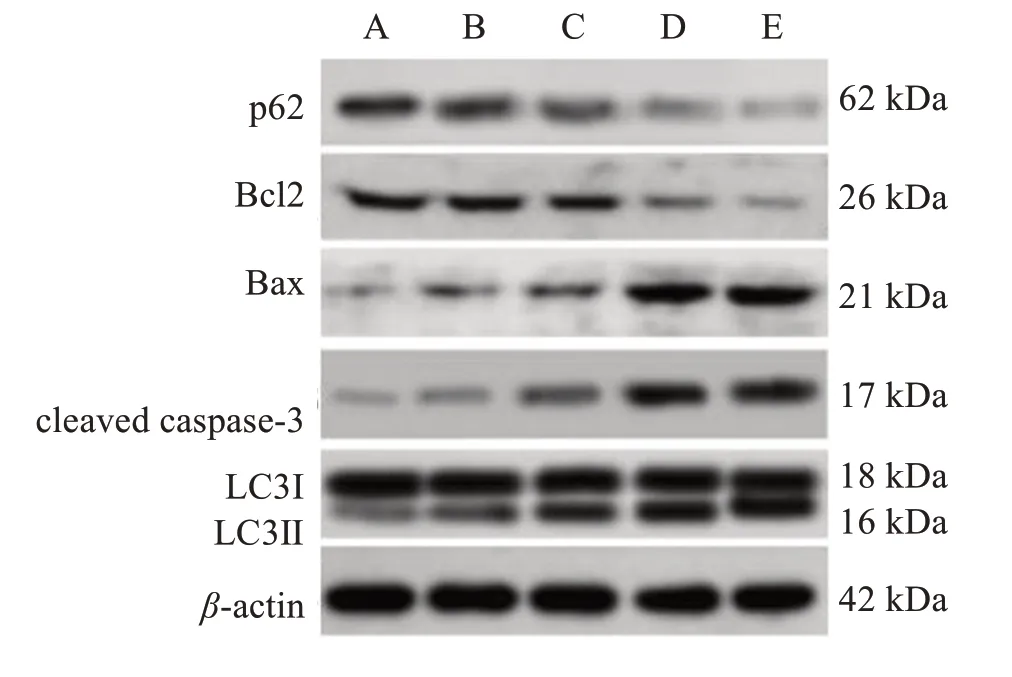
图5 不同浓度DCL培养下CNE1细胞自噬和凋亡相关蛋白条带Figure 5 Autophagy and apoptosis related protein bands of CNE1 cells cultured with DCL at different concentrations
3 讨论
以顺铂或5-氟尿嘧啶为基础的同步放化疗被认为是局部晚期鼻咽癌的标准治疗方案,然而耐药性的发生严重制约其有效性[8]。近年来,中草药因其在癌症治疗中高效、低毒的作用而备受研究者关注。DCL 药理活性广泛。在本研究中,DCL 作用鼻咽癌CNE1细胞后,细胞存活率呈剂量依赖性降低,表明其对CNE1 细胞增殖具有积极抑制作用,提示DCL 可能是一种有效且可靠的抗鼻咽癌进展药物,对鼻咽癌临床治疗具有重要的参考价值。
一般来说,自噬可启动多个双膜液泡的形成,这些液泡与溶酶体融合形成称为“自噬体”的细胞内体,可用于消除多余或受损的细胞器,以维持细胞内环境稳态[9],但研究发现,自噬还可以通过降解细胞存活因子和抗凋亡蛋白来促进细胞凋亡[10]。自噬和细胞凋亡分别控制细胞内细胞器和蛋白质的更新,以及生物体内细胞的更新,许多应激途径依次引发同一细胞内的自噬和细胞凋亡,特殊情况下,自噬或自噬相关蛋白可能有助于诱导细胞凋亡或坏死,而自噬已被证明会过度降解细胞质,导致“自噬性细胞死亡”[11],因此,自噬介导的细胞凋亡可能是一种很有前景的鼻咽癌治疗策略,故在探究DCL 抗鼻咽癌作用机制时,本研究侧重检测并观察细胞自噬和凋亡相关变化。在自噬过程中,自噬体吞噬细胞质成分,导致胞质形式的LC3I与磷脂酰乙醇胺结合形成LC3Ⅱ,LC3Ⅱ/LC3I 比值与自噬体数量呈正相关[12];p62 是一种泛素结合蛋白,当自噬被诱导时,p62 蛋白水平会降低[13],另可作为细胞信号转导开关,通过募集和与细胞分子寡聚化来控制细胞存活、凋亡和自噬过程[14]。细胞凋亡通常通过可见的形态特征和生化标志物来证实,通常,细胞凋亡过程涉及核膜破裂和DNA 片段化,染色质凝聚、固缩是细胞凋亡的最突出特征[15];Bcl-2 是调节细胞死亡途径执行的抗凋亡蛋白,Bax 通过诱导细胞色素C 从线粒体易位到胞质而发挥促凋亡功能;凋亡过程激活涉及的死亡受体途径或线粒体凋亡途径均会导致下游主要效应蛋白酶caspase-3 的裂解和激活[16]。在本研究中,DCL 作用CNE1 细胞后,经Hoechst 33258 荧光染色可见细胞核染色质凝聚呈碎片状固缩,且经流式细胞术检测后发现,CNE1 细胞凋亡率随DCL 作用浓度增大而升高,提示DCL可呈剂量依赖性促进细胞凋亡发生;经透射电子显微镜观察后,细胞内自噬体形成数量增加,LC3Ⅱ/LC3Ⅰ比值及Bax、cleaved caspase-3蛋白较无DCL作用时表达明显升高,提示DCL可增强细胞自噬。结合上述讨论,提示DCL可能通过促进鼻咽癌细胞自噬激活并诱导凋亡从而发挥抗癌活性。
PI3K/Akt/mTOR 通路是癌症中最频繁激活的信号通路之一,负责肿瘤发展、细胞转移和增殖[17]。据报道,该通路也可调节癌细胞自噬和凋亡,在致瘤细胞中,PI3K 被激素、生长因子和其他刺激物激活,激活的PI3K 产生信使PIP3,使非活性Akt 发生构象转变,后Ser124/Thr450 和Thr308/Ser473 位点依次磷酸化,导致Akt 信号激活,激活的Akt 进一步触发mTOR 的磷酸化激活,进而调节肿瘤发展中的细胞生长、凋亡和自噬[18]。Lin 等[19]研究发现,通过下调PI3K/Akt/mTOR 通路可诱导人鼻咽癌细胞自噬和凋亡,Yang[20]等研究结果同样表明,抑制PI3K/Akt/mTOR 通路激活可体外诱导鼻咽癌细胞自噬性细胞死亡。本研究中,经Western blotting检测,可见DCL 可明显抑制CNE1 细胞中PI3K、Akt 和mTOR活性水平,这些结果表明,DCL 可能通过抑制PI3K/Akt/mTOR通路激活促进CNE1细胞自噬发生,进而介导细胞凋亡并抑制增殖的抗肿瘤活性。
综上所述,DCL 可促进鼻咽癌细胞自噬和凋亡,其作用机制可能与抑制PI3K/Akt/mTOR 通路激活有关,为鼻咽癌临床治疗分子机制及用药选择提供了一定的参考。

