茶用菊花‘金丝皇菊’的组培快繁技术研究
崔乐源,盛夏薇,郭佳琳,陈婧钿,孙宪芝
(1.山东农业大学 作物生物学国家重点试验室,山东 泰安, 271018;2.山东农业大学 园艺科学与工程学院,山东 泰安,271018)
随着人们生活水平的不断提高,茶用菊花得到越来越多的关注与使用,针对茶用的菊花品种也不断涌现,其中‘金丝皇菊’以朵大、花型美丽、富含黄酮、氨基酸和微量元素等优点而成为生产上的最重要品种之一[1]。有清热解火和消暑的功效,是一种兼具观赏和药用价值的作物[2],具有较高的市场价值。
菊花是异质六倍体,因其遗传背景复杂,自交不亲和且杂交性状分离严重,在自然状态下结实率极低,不太可能通过自交获得自交系[3-4]。因此,目前菊花的繁殖主要是扦插和分株等无性繁殖方式[5]。传统的方式需要较多的母株材料、繁殖周期长、易受季节和外界环境的影响,随着市场需求量的日益增加,传统方式已无法满足市场发展的需要[6]。组培快繁技术可以通过根、茎、叶等器官大量诱导组培苗,具有培养周期短、繁殖速度快、保持母本优良性状、不受季节及地区等因素的影响、可周年连续生产等优势[7-8]。一方面,组培可以对菊花进行脱毒复壮,保持有优良性状,短时间大量繁殖,满足市场需求;另一方面,组培可为新品种的选育和转基因操作奠定基础。
目前国内对菊花组培快繁的研究报道很多,如切花菊‘白扇’[9]和‘太行菊’[10]。但‘金丝皇菊’的组培快繁技术还未见报道。本研究开展了‘金丝皇菊’的外植体消毒、诱导培养、生根培养及炼苗移栽,获得了‘金丝皇菊’组培苗最适培养基配比,对加快‘金丝皇菊’的繁殖速度,满足市场需求,促进产业发展具有重要意义。
1 材料与方法
1.1 试验材料
‘金丝皇菊’当年生茎段。材料取自山东农业大学园艺学院研究基地。
1.2 试验方法
1.2.1 外植体的消毒 选取生长良好、无病虫害的‘金丝皇菊’带芽嫩枝作为外植体,流水冲洗2 h,剪去叶片,放于超净工作台上。用75%乙醇浸泡30 s,快速取出,无菌水冲洗3次,放入不同浓度(5%、15%、25%)的次氯酸钠溶液中分别消毒20 min,消毒过程中不断振荡烧杯。无菌水冲洗5次后用滤纸吸干水分,将外植体切成带有1~2个腋芽的茎段,接种在不加激素的空白培养基中,每组消毒处理3个重复。30 d后对褐化率、染菌率和外植体的生长情况进行统计分析,筛选出一个适宜的消毒方式。生长情况包括诱导芽的长势、叶片颜色与大小等。
1.2.2 诱导培养 以MS培养基为基本培养基,添加琼脂5.2 g·L-1、蔗糖30 g·L-1,其中附加一定浓度的6-BA(0.5、1.0、1.5、2.0 mg·L-1)、NAA(0.1、0.2、0.3、0.4 mg·L-1)。以不加激素的MS培养基作为对照组。将消毒灭菌后的外植体剪成小段,每段带有1~2个腋芽,接种到含不同浓度激素的诱导培养基上,每个组培瓶1~2段。诱导培养基分16个处理组,每组4次重复。光照培养室温度为(25±2)℃,相对湿度为35%~40%,光照时数为12 h·d-1。培养28 d后,记录不同激素配比下产生的芽诱导率、平均出芽个数、不定芽形态结构是否良好数据。观察并分析诱导培养期‘金丝皇菊’组培苗的长势。
1.2.3 生根壮苗培养 将健壮的无根小苗转移到生根培养基上,培养基采用1/2MS为基本培养基,其中附加一定浓度的6-BA(0.5、1 mg·L-1)、NAA(0.1、0.2 mg·L-1)和活性炭(0.1%、0.2%、0.3%、0.4%)。以不加激素和活性炭的1/2MS培养基作为对照组。光照培养室温度为(25±2)℃,相对湿度为35%~40%,光照时数为12 h·d-1。培养28 d后,记录生根条数、根的长度、生根率等数据,评估生根情况,观察并筛选出最适的生根培养基。
1.2.4 炼苗移栽及苗圃管理 组培苗高和根长均在7 cm左右即可开始炼苗,先打开组培瓶口套上自封袋,移到自然光下2~3 d,让试管苗接受正常光照射,使其长得更加壮实。2 d后将自封袋扎孔,适应3~4 d后撤掉自封袋,继续炼苗2~3 d。
炼苗后将小苗从组培瓶中小心取出,轻柔地洗净根部附着的琼脂,尽量保留须根,将根部浸入多菌灵稀释液中消毒15 min,移栽到经75%酒精消毒过的营养土与园土(1∶1)混合的基质中。最初阶段注意遮阴、保温,空气相对湿度与培养基保持相似。14 d后统计移栽成活率,对移栽状况进行评估。
1.2.5 数据统计分析 具体公式如下:
外植体消毒、诱导培养、生根培养等所获得的数据,采用Excel 2013和SPSS25.0进行统计分析。
2 结果与分析
2.1 消毒剂浓度对初代培养效果的影响
由表1可知,接种30 d后,5%次氯酸钠消毒的染菌率最高;25%次氯酸钠处理的褐化率较高;而15%次氯酸钠处理的染菌率最低,组培苗长势最好,叶片浓绿无枯萎,且差异显著。因此,‘金丝皇菊’初代培养的最佳表面消毒条件为15%次氯酸钠消毒20min。
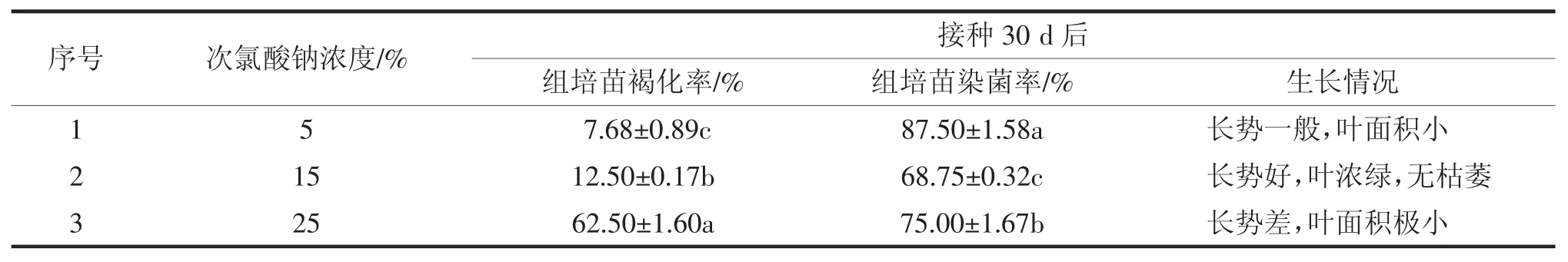
表1 不同消毒剂浓度对‘金丝皇菊’初代培养的影响
2.2 激素配比对组培苗诱导的影响
由表2可知,接种28 d后,所有试验组的外植体基部均出现了愈伤组织,但各组的愈伤组织分化情况有所不同。当NAA浓度为0.2、0.3 mg·L-1时,诱导的愈伤组织数量较多,说明NAA浓度较高不利于不定芽的诱导,容易产生畸形芽,长势不佳。当6-BA浓度在0.5~2.0 mg·L-1时,均诱导出不定芽。当6-BA浓度为2.0 mg·L-1、NAA浓度为0.3 mg·L-1时芽诱导率达到100%,平均出芽个数为6.75个·株-1,显著高于CK处理,组培苗更健壮、叶色浓绿,基部的愈伤组织呈黄绿色。因此,‘金丝皇菊’初代培养中培养基的最佳激素配比为MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA。
2.3 激素配比对组培苗生根的影响
由表3可知,对13组和15组进行比较,结果得出13组培养基中侧根更多、根部更粗。对9组和12组进行比较、13组和16组进行比较,生长素与细胞分裂素比值相同,浓度越高,根萌发条数越少,形态越细长。对1组、5组、9组、13组进行比较,得出随着活性炭含量的增加,分化出的根数也逐步增加(图1)。
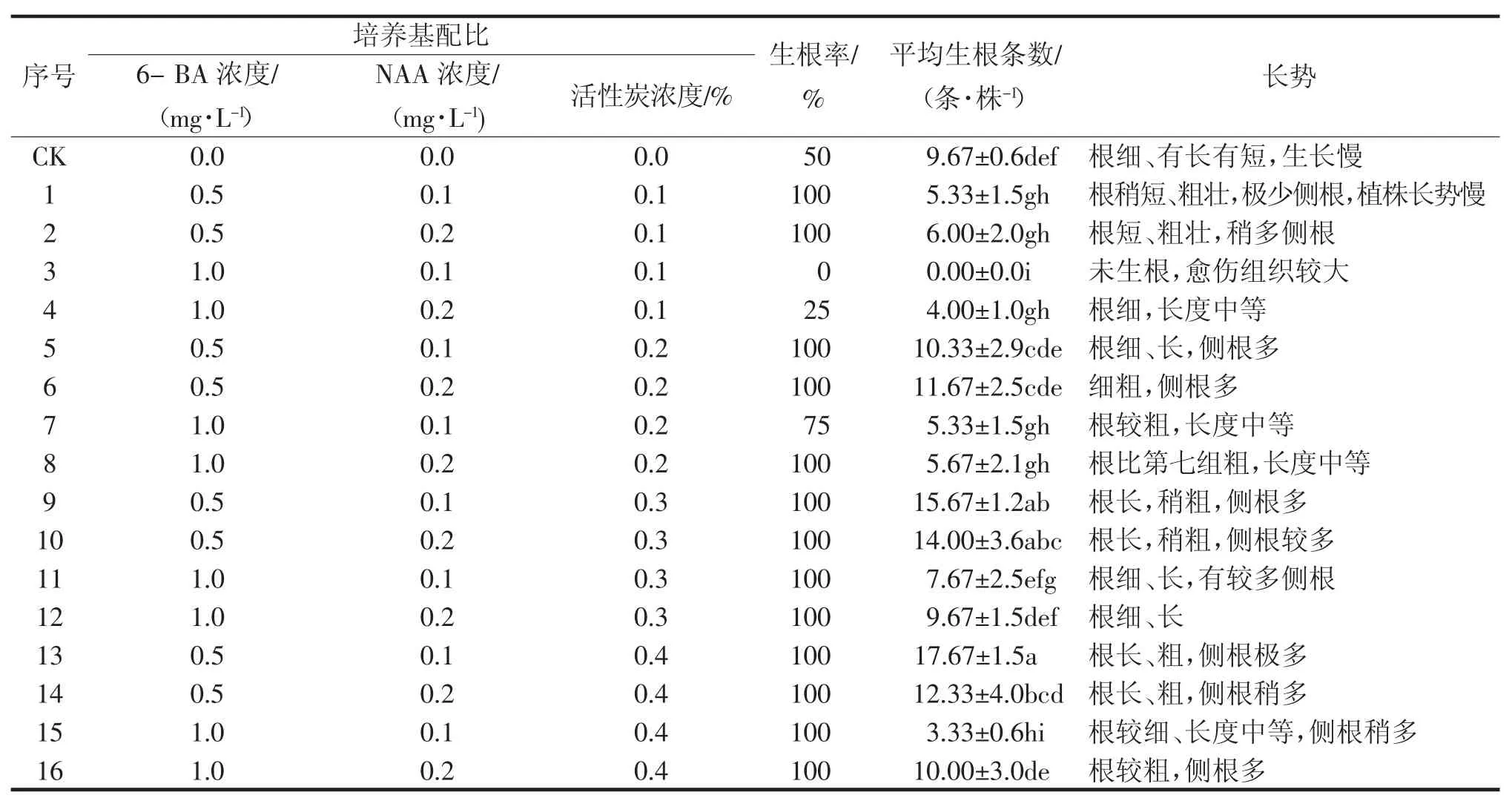
表3 不同培养基对‘金丝皇菊’组培苗生根的影响

图1 生根情况
当6-BA浓度为0.5 mg·L-1、NAA浓度为0.1 mg·L-1、活性炭含量为0.4%时生根率达到100%,平均生根条数达到17.67条·株-1,显著高于CK处理,产生的组培苗根部更长,更粗壮,侧根极多。因此,‘金丝皇菊’生根培养中培养基的最佳配比为1/2MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+0.4%活性炭。
2.4 炼苗与移栽及田间管理
笔者经观察发现,撤掉自封袋后继续炼苗时间的长短会影响组培苗的成活率。由图2可知,撤掉自封袋后,培养基水分迅速蒸发,若不能及时移栽,会导致培养基过度干燥。炼苗后的‘金丝皇菊’组培苗仅在1周左右即长出新根,植株高度也快速增加,茎呈嫩绿色、粗壮,此时可进行移栽。

图2 继续炼苗3 d(A)与继续炼苗1.5 d(B)
移栽前,在清洗苗根部的培养基时,11组和12组的根太细,容易断开,对根部损伤较大;10组和13组的根相对较粗,较易与培养基分离,不易断根。由表4、图3可知,根部损伤较小的试验组移栽后更易存活、植株长势更健壮。

图3 11组(A)与13组(B)移栽14d后长势

表4 炼苗移栽后植株长势
3 讨论与结论
3.1‘金丝皇菊’的外植体消毒
外植体消毒是建立快繁技术体系的关键环节。‘金丝皇菊’茎段对5%和25%的次氯酸钠处理比较敏感,消毒浓度为25%时,组培苗的褐化率最高,染菌率最低。要想减少褐化现象的发生,消毒剂的浓度要在适宜的范围内。若消毒剂浓度过高,会直接杀死切口处的组织,导致整个外植体褐化。由于‘金丝皇菊’的茎段比较幼嫩,切口处易受到灭菌剂的伤害,褐化现象比较严重。所以外植体材料的消毒处理方式必须符合要求。
外植体灭菌前,先用流动的自来水冲洗,一般冲洗1~2 h。‘金丝皇菊’茎段及叶片表面长有小绒毛并不光滑,可加稀释后的洗洁精洗涤。虽然试验中选用茎段作为外植体,但是不宜将叶片连带叶柄全部摘下,否则一段时间后不仅外植体会萎蔫,经次氯酸钠处理伤口处的组织也会变白,丧失细胞活性(图4),所以需要预留一部分叶柄来保护茎段组织被消毒剂杀死(图5)。

图4 伤口处的组织在消毒后变白

图5 叶柄全部摘下(A)与叶柄部分保留(B)
试验发现,15%次氯酸钠消毒染菌率较低,组培苗长势最好,‘金丝皇菊’初代培养的最佳表面消毒条件为15%次氯酸钠消毒20 min。
顾昌华等[11]研究表明,用2%次氯酸纳+0.1%升汞消毒各5 min,对墨菊的外植体顶芽有良好的消毒效果。刘丹等[12]报道,盆栽小菊‘子午线’外植体最佳消毒处理方式是乙醇处理30 s,次氯酸钠溶液处理7 min。本研究结果与上述试验结果均有所不同。由此可见,菊花不同品种对消毒条件要求有所差异。
3.2 ‘金丝皇菊’的诱导培养
外植体的萌动受到启动培养基成分的影响。李露华[13]报道称,贡菊丛生芽最适合的诱导培养基为MS+6-BA1.5~2.0 mg·L-1+NAA 0.1 mg·L-1时有利于腋芽形成,45 d的增殖倍数为5.3~5.8。滕如萍等[14]指出,切花菊‘神马’顶芽初代再生的最适培养基为MS+6-BA 1.5 mg·L-1+NAA 0.5 mg·L-1。笔者在试验过程中发现,对于‘金丝皇菊’的茎段而言,随着6-BA浓度的增加,分化出的不定芽数量也逐步增加,诱导培养基的最佳激素配比为MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA。本研究结果与以上结论有所不同,原因可能是品种和器官不同所致。
3.3 ‘金丝皇菊’的生根培养
试验发现,随着活性炭含量的增加,根的条数在增加,外观也更加粗长,这是因为在培养基中添加活性炭可以促进细胞分裂,吸附对生长有抑制作用的物质,并在生根培养阶段提供暗环境,更利于根的诱导和生长。随着植物生长调节剂浓度的升高,根萌发的条数在减少,由此证明了高浓度的植物生长调节剂会抑制根的分化,低浓度的植物生长调节剂促进根系的发生。本研究关于‘金丝皇菊’的生根培养试验结果表明,最佳生根培养基为1/2MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+0.4%活性炭。接种28 d后平均生根数可达17条,生根率100%,优于汤春梅[15]的研究结果。
3.4 炼苗与移栽
炼苗时培养基水分蒸发较快,应及时观察以保证组培苗炼苗期间的成活率。本研究发现,炼苗时间为1.5 d左右较为合适,组培苗长势较好。移栽后根部损伤较轻的组培苗成活率和长势较高。
综上,本研究建立了‘金丝皇菊’组培快繁技术体系,为‘金丝皇菊’的规模化繁殖提供理论基础与技术支持。研究结果表明,‘金丝皇菊’的最佳消毒方案为15%次氯酸钠消毒20 min;诱导培养基的最佳配比为MS+2.0 mg·L-16-BA+0.3 mg·L-1NAA;生根培养基的最佳配比为1/2MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+0.4%活性炭。

