LncRNA H19调控肾小球足细胞焦亡中作用
汪乐新 刘超 马天龙 杨安宁,3 熊建团,3 吴凯,3焦运 白志刚,3 姜怡邓,3 马胜超,3 张旭 卢冠军,
宁夏医科大学1临床医学院,2基础医学院(银川 750004);3国家卫生健康委员会代谢性心血管疾病研究重点实验室(银川 750004);4宁夏医科大学总医院泌尿外科(银川 750004);5中国人民解放军总医院泌尿外科(北京 100000)
糖尿病肾病是一种严重的微血管病变,早期症状不明显,隐匿性发展,中晚期发病率占糖尿病整体的20%~40%,具有较高致死率及致残率,也是全世界范围内导致终末期肾病、肾功能衰竭的主要病因之一[1]。目前治疗糖尿病肾病的手段较依赖血液透析、腹膜透析、肾脏代替治疗(肾移植)等,对于糖尿病肾病的治疗还没有特效的方法,且个体差异度大。因此需要深入对糖尿病肾病的发病机制进行深入探究,以便寻找更优化的治疗手段[2]。长非编码RNA(long non-coding RNA,LncRNA)是一类具有多种层面调控基因表达且不具备蛋白编码功能的RNA,在真核细胞中lncRNA 调控基因表达方式多种多样,如转录调控因子上调或下调基因表达、通过调控DNA 甲基化或组蛋白修饰、染色质重构致基因表达或沉默,进而调控细胞增殖、焦亡及细胞周期变化,其异常转录可引起下游通路和蛋白异常表[3-4];lncRNA H19是长非编码RNA 中的一种,据有关文献研究表明,lncRNA H19 参与多种疾病的进展,例如糖尿病和心肌心力衰竭等方面的相关疾病[3-4]。已有研究证明[5-6],lncRNA H19 可通过PI3K/AKT 通路抑制HIBD 新生大鼠心肌细胞凋亡;沉默lncRNA H19 通过靶向上调调控miR-214 的表达,抑制Caspase-1表达,达到抑制心肌细胞凋亡和炎症反应,减轻心力衰竭症状。乔家明等[7]研究发现,LncRNA H19通过Wnt/β-catenin/OSX 轴调节动脉钙化。徐静琳等[8]研究发现,过表达LncRNA H19 能够靶向调控细胞凋亡相关蛋白及细胞自噬相关蛋白表达,从而对糖尿病肾病足细胞起到保护作用。鉴于越来越多学者关注到lncRNA H19 异常表达是影响肾足细胞活性关键因素之一,而lncRNA H19 异常表达引起肾足细胞焦亡损伤罕见报道[9-10]。本研究以在高糖因素影响下的lncRNA H19 诱导肾足细胞焦亡为主轴,阐明lncRNA H19 具有调控肾足细胞焦亡表达,为深入研究糖尿病肾病的发生发展提供一定实验依据。
1 材料与方法
1.1 主要试剂及仪器 小鼠肾脏足细胞株(MPC-5)(中国深圳华拓生物有限公司);DMEM 培养基、胎牛血清(美国Gibco 公司);葡萄糖粉末(中国天津大茂化学试剂厂),蛋白提取试剂盒(中国上海凯基生物技术有限公司);NLRP3、Caspase-1、IL-1β 和β-actin 抗体(英国Abcam 公司);总RNA提取试剂盒、逆转录试剂盒、荧光PCR 试剂盒(中国北京天根公司),LncRNA 上下游引物(中国上海生物生工程公司)合成;蛋白上样缓冲液(上海碧云天有限公司);化学发光显色剂(中国新赛美公司);细胞计数仪(德国Eppendorf 公司);便携迷你离心机购买于Eppendorf 公司;纯水仪(美国Millipore 公司);共聚焦细胞培养皿(德国赛默飞公司);激光共聚焦显微镜(德国ZEISS 公司);电泳仪、电转仪、Model680 全自动酶标仪(美国BioRad 公司);超净工作台(中国苏州安泰有限公司);CO2培养箱和5415D 型微量台式离心机(美国Eppendorf 公司);制冰机(美国AF10 SCOTSMAN 公司)。
1.2 细胞模型建立与分组 用含有10%体积的胎牛血清的DMEM 培养液培养肾足细胞(MPC5),置于37 ℃、5%CO2浓度培养箱中,2 d 传代1 次,取对数增长期,第3 ~ 4 代用于实验,取生长状态良好,密度适中的MPC5 分别在30 mmol/L HG 干预足细胞48 h 因此当细胞密度达到70%干预细胞,以终浓度为0 mmol/L 为Control 组,以终浓度为30 mmol/L为HG 组,分别干预48 h 后收集细胞以便后续相关实验。
1.3 细胞转染与分组 根据LipofectamineTM2000说明书将Ad-lncRNA H19 及si-lncRNA H19 转染肾足细胞中。转染Ad-lncRNA H19 后Western blot 分组为对照组(不做处理)、高糖组、lncRNA H19 过表达对照+高糖组、lncRNA H19 过表达+高糖组,转染si-lncRNA H19 后Western blot 分组为对照组(不做处理)、高糖组、lncRNA H19 干扰对照+高糖组、lncRNA H19 干扰+高糖组;转染Ad lncRNA H19 及si lncRNA H19 后qRT-PCR 分组为对照组(不做处理)、lncRNA H19 过表达阴性对照组、lncRNA H19 过表达组;对照组(不做处理)、lncRNA H19 干扰对照组和lncRNA H19 干扰组(si-lncRNA H19-1、si-lncRNA H19-2、si-lncRNA H19-3),转染前1 d,在250 μL 的DMEM 培养基中接种2 × 105个细胞。A 液:250 μL DMEM 纯培养基与Ad-lncRNA H19、si-lncRNA H19 5 μL 混合,吹打2~3 次混匀。B 液:250 μL DMEM纯培养基与6 μL LipofectamineTM2000 混合,吹打2~3 次混匀,静置5 min。A 液加B液混匀吹打2~3次,于室温下静置20 min。加入3.5 mL 纯培养基混匀。将培养瓶置于37 ℃,5%CO2培养箱中培养,8 h 后更换培养液,HG 干预48 h 后收细胞,以便进行后续其他实验。
1.4 用qRT-PCR 方法检测lncRNA H19的mRNA的表达 根据总RNA 试剂盒说明书提取各组肾足细胞的总RNA,通过NCBI 查询lncRNA H19 的ID 序列号,经Gene Bank 查询上下游引物序列,委托上海生物生工公司合成lncRNA H19 上游引物:5'-GAACAGAAGCATTCTAGGCTGG-3'下游引物5'-TTCTAAGTGAATTACGGTGGGTG-3'逆转录反应体系:Prime SCript Buffer For Real Time 2 μL、Oligo Diprimer 1 μL、Random 1 μL、Prime Script RT En-Lyme MlxI 1 μL、H2O 与RNA 总体积13 μL、PCR反应体系:TB Green 10 μL、上下游引物各0.8 μL、H2O 6.4 μL、逆转录产物2 μL 荧光定量PCR 扩增:95 ℃30 s、95 ℃5 s、60 ℃34 s,共45 个循环,以小鼠GADPH 内参为对照,目的基因扩增后,通过目的基因相对量公式分析2-△△Ct,△△Ct =[Ct 目的基因(待测样本)-Ct GAPDH(待测样本)]-[Ct 目的基因(校正样本)-Ct GAPDH(校正样本)]。
1.5 用Western blot 检测NLRP3、Caspase-1、IL-1β、Nephrin、Podocin 蛋白表达 收刮足细胞,5 000 r/min 离心5 min,弃上清,根据凯基蛋白提取试剂盒说明书提取总蛋白,用BCA 法测定浓度定量,加50 mL 蛋白上样缓冲液,金属浴99 ℃煮沸5 min 变性,经SDS-PAGE 凝胶电泳90 V 20 min,120 V 30 min 湿转2 h 转移至PVDF 膜,5%脱脂牛奶封闭2 h,用稀释比1∶1 000 的兔抗NLRP3、兔抗Caspase-1、兔抗IL-1β、兔抗Nephrin 及兔抗Podocin抗体4 ℃孵育过夜,PBST 液洗膜3 次,每次10 min,用稀释比1∶1 000 的兔二抗孵育2 h,PBST 液洗膜3 次,每次10 min,通过Image Lab 图像分析进行扫描采取图像,以β-action 为内参,计算NLRP3、Caspase-1、IL-1β、Nephrin、Podocin 与β-action 内参灰度值的比值做定量分析。
1.6 免疫荧光检测NLRP3、Caspase-1、IL-1β 蛋白表达 细胞传代时把生长状态良好的细胞,铺到共聚焦小皿中,密度适中,干预48 h 后收取共聚焦小皿,PBS 液清洗小皿,3 次5 min,4%的多聚甲醛固定细胞30 min,PBS 清洗3 次5 min,0.2%TritonX-100 溶液通透20 min,PBS 3 次5 min,山羊血清封闭30 min,1∶100 配置NLRP3、Caspase-1 及IL-1β 抗体,4 ℃过夜孵育,隔天取出小皿,PBS 3 次5 min,加荧光488 标记绿光二抗,37 ℃1 h 避光孵育二抗,PBS 3 次5 min 后,加入DAPI 液避光孵育5 min ,PBS 清洗3 次5 min 清,封片淬灭剂封片后用激光共聚焦采取图像。
1.7 过表达及干扰lncRNA H19 对高糖诱导足细胞焦亡的影响 为进一步探讨lncRNA H19 对高糖诱导足细胞焦亡是否有调控作用,转染Ad lncRNA H19 及si lncRNA H19 后qRT-PCR 分 组:(1)对照组(不做处理)、lncRNA H19 过表达阴性对照组、lncRNA H19 过表达组;(2)对照组(不做处理)、lncRNA H19 干扰阴性对照组和lncRNA H19 干扰组(si-lncRNA H19-1、si-lncRNA H19-2、si-lncRNA H19-3)采用qRT-PCR 检测lncRNA H19的mRNA表达水平;转染Ad-lncRNA H19后Western blot 分组;(3)对照组(不做处理)、高糖组、lncRNA H19 过表达对照+高糖组、lncRNA H19 过表达+高糖组;转染si-lncRNA H19 后Western blot 分组;(4)对照组(不做处理)、高糖组、lncRNA H19 干扰对照+高糖组及lncRNA H19 干扰+高糖组,采用Western blot 方法检测NLRP3、Caspase-1、及IL-1β蛋白表达水平。
1.8 统计学方法 使用Graphpad Prism 8.0 软件进行统计,实验数据均为计量资料,用均数±标准差表示,两组间比较采用独立样本t检验,多样本比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 HG 诱导足细胞损伤与LncRNA H19 表达情况 为了探讨lncRNA H19 在高糖中表达情况,采用qRT-PCR 方法检测lncRNA 的mRNA 表达水平,结果发现,与对照组相比lncRNA H19 表达降低,两组间比较差异均有统计学意义(P< 0.05),结合相关实验分析,在高糖诱导足细胞损伤时lncRNA H19 表达水平降低,见图1。

图1 lncRNA H19 在高糖干预足细胞中低表达Fig.1 LncRNA H19 is low-expressed in high-glycemic intervention podium
2.2 HG诱导肾足细胞中NLRP3、Caspase-1及IL-1β 蛋白表达情况 为了探讨高糖致足细胞焦亡影响,采用Western blot 方法检测焦亡相关蛋白NLRP3、Caspase-1 及IL-1β 表达水平。结果显示,与对照组相比高糖组中NLRP3、Caspase-1 及IL-1β蛋白水平明显增加,两组间比较差异均有统计学意义(P< 0.05),提示高糖可诱导足细胞发生细胞焦亡,见图2。

图2 HG 引起焦亡相关蛋白Caspase-1、NLRP3、IL-1β 表达水平增加(40×)Fig.2 HG causes increased expression levels of Caspase-1,NLRP3 and IL-1β related proteins(40×)
2.3 HG 诱导肾足细胞中Nephrin、Podocin 蛋白情况 为了探讨高糖干预刺激下损伤肾足细胞,采用Western blot 方法检测肾足细胞中结构性相关蛋白Nephrin、Podocin 表达水平,结果发现,与对照组相比,高糖组中Nephrin、Podocin 蛋白表达水平降低,两组间比较差异均有统计学意义(P<0.05),提示高糖可诱导足细胞发生损伤。见图3。
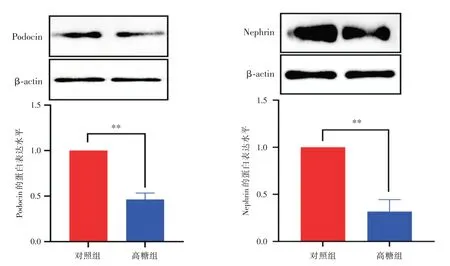
图3 HG 引起肾足细胞结构性相关蛋白Nephrin 及Podocin 表达降低Fig.3 HG causes decreased expression of Nephrin and Podocin proteins related to nephrocytes
2.4 过表达及干扰lncRNA H19 对高糖诱导足细胞焦亡的影响 结果提示,转染Ad-lncRNA H19后,与lncRNA H19 过表达阴性对照组相比lncRNA H19 mRNA 表达上调(P< 0.05),与lncRNA H19 过表达对照+高糖组相比,焦亡相关蛋白NLRP3、Caspase-1、IL-1β 表达水平降低(P<0.05);转染silncRNA H19 后,与lncRNA H19 干扰阴性对照组相比,lncRNA H19 mRNA 表达下调(P< 0.05),且silncRNA H19-2 干扰效果最佳,与lncRNA H19 干扰对照+高糖组,焦亡相关蛋白NLRP3、Caspase-1、IL-1β 表达水平增高(P< 0.05),提示lncRNA H19具有调控焦亡相关蛋白表达作用,过表达lncRNA H19 后降低焦亡相关蛋白水平表达保护肾足细胞,而干扰lncRNA H19 后细胞焦亡相关蛋白水平表达增高,损伤肾足细胞,见图4。
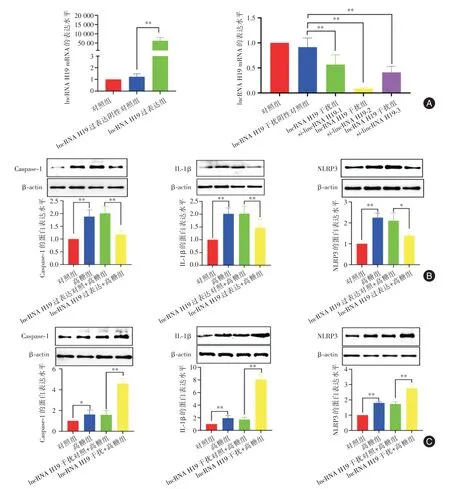
图4 LncRNA H19 调控焦亡相关蛋白NLRP3、Caspase-1、IL-1β 表达水平Fig.4 LncRNA H19 regulates the expression levels of coke-dead-related proteins NLRP3,Caspase-1,and IL-1β
3 讨论
随着糖尿病的发病率、致死率逐年增加,而糖尿病肾病是以长期高血糖,慢性肾功能损伤为特征的严重微血管病变,作为糖尿病患者致残、致死中重要因素之一,其探究糖尿病肾病的致病机制成为目前研究的热点[11]。而糖尿病肾病的发病机制尚不清楚,且其无特效的治疗手段,为了寻找更好的治疗手段,需更加深入探究糖尿病肾病的发病机制[12]。
近年来有关学者认为,细胞焦亡作为一种新型的程序性死亡方式,常伴随慢性炎症的发生,细胞焦亡的炎性因子过度激活可能是糖尿病肾病重要的发病机制[13]。据有关文献报道提示[11]:糖尿病肾病发展过程中伴随大量炎性因子的释放,当抑制RHoA/ROCK1/NF-κB 信号通路,有效降低下游炎性因子表达,而益肾化湿颗粒能够有效的抑制RHoA/ROCK1/NF-κB 信号通路的过度激活,拮抗糖尿病肾病炎症损伤,从而改善肾功能,减缓糖尿病肾病进程。丁宝珠等[12]研究发现,NLRP3-Caspase-1-GSDMD 是细胞焦亡经典通路,在高糖诱导损伤过程中导致胞内细胞活性氧(reactive oxygen species,ROS)异常增加,增加传递信号的模式识别受体,如NOD 样受体蛋白3(NOD-like erceptor protein 3,NLRP3)炎症小体激活,引起下游凋亡相关斑点样蛋白(ASC)表达增加并活化半胱氨酸蛋白酶-1(caspase-1),切割焦亡效应物Gasdermin D(GSDMD)穿透细胞膜形成孔道,内容物释放导致IL-1β 炎症因子损伤肾足细胞[12-13],而SJTR(肾消解毒通络方)可有效阻断NLRP3-Caspase-1-GSDMD经典途径激活,抑制细胞焦亡发生。毛彦稳等[13]发现,NEDD4L(泛素连接酶)与Caspase-11 蛋白结合,在泛素化降解Caspase-11 蛋白表达活性减轻细胞焦亡损伤的同时,又能够抑制EMT(上皮间质转化)以及ECM(细胞外基质)沉积,缓解由细胞焦亡损伤引起的糖尿病肾病进展。左熠等[14]报道指出,高糖作为一种危险因素,其可诱导肾足细胞焦亡、自噬、凋亡、氧化应激发在,且可能与MALAT1/NRF2/miR-200c 信号通路有关,而恰巧的是,阿托伐他汀作为一种能有效抑制细胞焦亡,拮抗炎性的药物通过MALAT1/NRF2/miR-200c 信号通路抑制下游焦亡炎性因子释放,而本文研究发现,在高糖模型中肾结构蛋白Nephrin、Podocin 低表达,而焦亡相关指标NLRP3、Caspase-1 及IL-1β 表达水平增加,表明焦亡炎症因子的过度激活是损伤肾足细胞正常生理功能导致糖尿病肾病的原因之一[15-23]。近年来,越来越多的学者认为,在糖尿病肾病中细胞焦亡是一个诱导疾病加重的因素,是研究缓解细胞焦亡是缓解肾功能损伤的重要环节,而药物可明显缓解糖尿病肾病的进展,如阿托伐他汀、肾消解毒通络方、益肾化湿颗粒等,为进一步研究糖尿病肾病的相关发病机制及临床诊断、治疗提供方向及基础[23-26]。张静等[15]在基因层次研究发现,高糖可诱导足细胞焦亡、足细胞自噬及足细胞凋亡发生,而miR-29a 可以直接靶向下调调控足细胞凋亡、焦亡并且上调足细胞自噬,足细胞自噬表达过度激活拮抗足细胞焦亡、凋亡的炎性损伤,从而保护肾脏。但是鲜有报道lncRNA H19 在糖尿病肾病中是否具有调控细胞焦亡炎性表达作用,缓解糖尿病肾病的进展。故推测lncRNA H19 在基因层面上可能具有一定调控细胞焦亡的功能,这值得进一步深入探讨。
据有关文献报道,lncRNA 是一类长度大于200 个核苷酸的非编码RNA,广泛参与人体生理调节,参与细胞增殖、分化、焦亡、凋亡等生物学过程,在调控疾病发生发展均发挥着重要作用[26]。有关文献报道,lncRNA H19 在许多疾病均有调控功能,且在疾病中扮演的重要角色及其发病机制,例如GUO 等[27]发现,在脊髓缺血在灌注损伤中,lncRNA H19 通过海绵吸附作用铆钉miR-181a-5p并增加下游靶基因HMGB1(高迁移率族蛋白1)表达,促进细胞核转录翻译,加速分泌炎症因子,促进神经元细胞焦亡发生发展,过表达lncRNA H19后有效抑制HMGB1 蛋白分泌,缓解神经元细胞焦亡。QU 等[28]发现,视网膜缺血在灌注时lncRNA H19 是I/R 诱导小胶质细胞焦亡炎的关键,且lncRNA H19 在视网膜缺血在灌注中呈低表达,炎性因子NLRP3 呈高表达,提示在视网膜缺血在灌注损伤中lncRNA H19 与炎症因子NLRP3 存在负相关性,共同加速疾病进展发生[29]。张学丽等[29]报道,心肌梗死是威胁中老年人健康主要疾病之一,而lncRNA H19 在MI(急性心肌梗死)中异常表达,而lncRNA H19 与NGF(分泌神经生长因子)表达具有一定关联性,lncRNA H19 在MI 中呈高表达,沉默H19 降低NGF 可明显抑制MI 后的心律失常。不仅如此,在大部分肿瘤进展过程中lncRNA H19促进癌症增殖、迁移,例如MA 等[30]发现,lncRNA H19 在卵巢癌表达增加,增加卵巢癌的增殖。张学丽等[31]研究发现,LncRNA H19 可促进肺癌增殖、迁移和上皮-间质转化。截至目前报道当中,在其他疾病报道较多,如心血管疾病等,但在糖尿病肾病进展过程中lncRNA H19 调控细胞焦亡研究报道较少[31-32]。目前研究发现,lncRNA H19 充当明星标记,在众多疾病具有表达调控作用,故猜测lncRNA H19 在肾脏中也有一定调控作用[32-35]。实验研究结果显示,lncRNA H19 的表达水平可作为诱导或缓解肾足细胞细胞焦亡的一种调控标志,在高糖细胞模型中,lncRNA H19 在高血糖损伤肾足细胞时表达降低,与肾足细胞结构蛋白Nephrin、Podocin 表达呈正相关性,且又对细胞焦亡相关蛋白NLRP3、Caspase-1 及IL-1β 蛋白水平表达呈负相关性,提示:lncRNA H19 在糖尿病肾病疾病中存在差异表达,而lncRNA H19 的低表达可能通过促进细胞焦亡方式损伤肾足细胞,进而加重糖尿病肾病发生发展[36-39]。利用AdRNA 上调lncRNA H19 表达后,抑制炎性释放,NOD 样受体蛋白3 炎症小体(NLRP3)激活减少,下游凋亡相关斑点样蛋白激活减少,导致活化半胱氨酸蛋白酶-1(caspase-1)活性降低,引起IL-1β炎症因子释放减少,焦亡相关蛋白NLRP3、Caspase-1、IL-1β 蛋白水平表达下降保护肾足细胞,利用siRNA 下调足细胞系中lncRNA H19 后,促进炎性释放,NOD 样受体蛋白3 炎症小体大量激活,激活活化半胱氨酸蛋白酶-1(caspase-1)活性大量增多,炎症因子大量释放导致细胞焦亡相关蛋白NLRP3、Caspase-1及IL-1β 表达水平增高,正常细胞生理功能受到损害,加速糖尿病肾病发生发展[40-42]。实验结论也证实了肾足细胞损伤是发生糖尿病肾病的基础,而lncRNA H19 作为一种具有调控肾足细胞焦亡的长非编码RNA,以NLRP3-Caspase-1-IL-1β 焦亡通路为主轴参与调控,增加lncRNA H19 表达有效降低细胞焦亡炎性因子释放,降低lncRNA H19 则促进细胞焦亡炎性因子的释放,lncRNA H19 可调控细胞焦亡表达,同时作为一种新型预测糖尿病肾病手段,又为临床治疗糖尿病肾病提供一种潜在的新方法。
综上所述,lncRNA H19 与糖尿病肾病中生物学行为调节存在密切相关性[42-43]。且本文首次通过探究lncRNA H19 可调控细胞焦亡相关蛋白NLRP3、Caspase-1 及IL-1β 表达水平,缓解糖尿病肾病进展,为本研究中最大创新点,首次揭示lncRNA H19 可作为糖尿病肾病新型标志物,但是考虑本研究条件有限,有一定局限性,无动物模型验证lncRNA H19 调控肾足细胞焦亡,且lncRNA H19是否还存在海绵吸附调控下游miRNA 介导加重糖尿病肾病病情发展,lncRNA H19 的异常表达是否还会引起肾足细胞铁死亡、胞葬等加重疾病进展,这仍需进一步通过动物实验进行补充论证深入探讨,同时这也为深入研究lncRNA H19 引起肾足细胞焦亡提供新的实验依据[44-46]。

