苹果果实褐腐病病原菌分离鉴定
吕昭龙,蒋晶晶,李继平,3,翟艳青,惠娜娜,王 立,马生彪,郑 果,3,漆永红,王森山
(1.甘肃省农业科学院 植物保护研究所,兰州 730070;2.甘肃农业大学 植物保护学院,兰州 730070;3.农业部天水作物有害生物科学观测试验站,甘肃天水 741299)
苹果属于蔷薇科(Rosaceae)苹果属(Malusspp.),是中国主要的栽培水果之一。根据联合国粮食及农业组织的数据,2018年中国苹果种植面积达到207万hm2[1]。但近年来,由于苹果褐腐病的发生危害,严重影响了果实品质和出口效益,造成了严重的经济损失[2]。据文献报道,褐腐病在核果类和仁果类果实上常有发生,由链核盘属真菌(Moniliniaspp.)感染引起,主要危害植物的花、芽、枝和果实,尤其是接近成熟期、收获期和贮藏期的果实[3]。褐腐病在世界范围内广泛分布,其中澳大利亚、亚洲、美洲和欧洲危害最大[4-6]。中国已有16个省有褐腐病的发生。据报道,引起苹果褐腐病的病原菌是Moniliniaspp真菌中亲缘关系最密切的6个种,即:果生链核盘菌(Moniliniafructicola)[7],核果链核盘菌(M.laxa),产核链核盘菌(M.fructigena),梅生链核盘菌(M.mumecola)[8],云南链核盘菌(Moniliayunnanensis)和聚子座链核盘菌(M.polystroma)。静宁县地处北纬35°的黄土高原暖温带半湿润气候区,土层深厚,光热资源丰富,年均温度、降雨量、日照时数等气候条件非常适宜苹果生长,是世界公认的苹果“黄金生产带”,苹果种植面积超过6.66万hm2,是甘肃苹果主产区之一,“静宁苹果”是甘味食品的重要品牌,凭借优质品质与品牌效应,静宁苹果畅销全国,甚至远渡重洋出口国外。
苹果褐腐病的发生为害,不仅造成果实腐烂,果农受损,甚至还会影响到市场销售及其品牌[9]。然而,目前还没有关于苹果褐腐病病原菌种类的报道。
本研究通过对甘肃省静宁县苹果果实褐腐病病原菌的鉴定,明确病原菌种类,为苹果褐腐病防治和当地苹果产业的发展提供科学依据。
1 材料与方法
1.1 试验材料
2020年10月于甘肃省静宁县采集发病的‘秦冠’苹果果实褐腐病样品,装入自封袋中于4 ℃冰箱内保存。选用马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)用于病菌的分离纯化和 培养。
1.2 苹果褐腐病发病部位菌株的分离
采用组织分离法分离苹果褐腐病发病部位的菌株。先将样品用无菌蒸馏水冲洗并晾干。使用灭菌的解剖刀在苹果果皮病健交界处切下 4 mm×4 mm的组织块。将组织块浸入5% NaClO中 90 s,然后用无菌蒸馏水冲洗3次。再将其放入75%乙醇中40 s进行消毒,然后用灭菌蒸馏水冲洗3次。用灭菌镊子将消毒后的组织块放置在无菌滤纸上,晾干后放在PDA上,25 ℃避光培养3 d后,挑取单个菌落的菌丝,转移到新的PDA上,25 ℃暗培养7 d,备用。
1.3 苹果褐腐病发病部位分离菌株形态学观察
菌落形态:在PDA培养基上生长7 d后观察待测纯化菌株的菌落特征,包括菌落正面和反面的颜色,气生菌丝的情况,菌落边缘的形状,菌落的质地等,采用十字交叉法测定菌落直径,并 记录。
显微形态:将待测纯化菌株在PDA平板上培养产孢,对于不产孢的菌株,采用菌落划伤法、液体摇培等方法进行诱导产孢。将产生的分生孢子、分生孢子盘等结构置于载玻片上,以无菌水做浮载剂,在显微镜下观察其结构特征,对于菌丝、产孢结构、分生孢子等形态特征进行拍照和记录描述,随机选取30个分生孢子,测量分生孢子的大小。
1.4 苹果褐腐病分离菌株分子生物学测定
采用真菌基因组DNA提取试剂盒(Omega)提取病原菌DNA,用于PCR反应的引物信息见表1。PCR 反应体系总体积为25 μL,包含2×TaqMasterMix 12.5 μL ,正反向引物各0.5 μL(10 μmol/L),DNA模板1 μL,以ddH2O补足至25 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,共35个循环;最后72 ℃延伸10 min。

表1 用于苹果褐腐病鉴定的引物信息Table 1 Primers used in this study
取5 μL上述 PCR 扩增产物于1.2%琼脂糖凝胶电泳(U:110 V)进行检测后将 PCR 产物送至上海生工生物工程有限公司进行测序。将测得的基因序列与 GenBank 中的序列进行比对,下载相似性高的序列及其对应复合种的常见模式菌株序列,使用 MEGA7.0 软件剪切后按照ITS-TUB2-Lcc2的顺序首尾拼接,分析系统发育关系,采用邻接法(Neighbor-joining,NJ)构建系统进化树,以自展法(Bootstrap)进行检测,共循环 1 000次,得到系统发育树。
1.5 苹果褐腐病分离菌株致病性测定
用刺伤—菌丝接种法进行致病性测定。在PDA上培养待测菌株5 d后,在菌落边缘打孔 (5 mm),待用。选择生长健康的‘富士’‘秦冠’‘新红星’和‘嘎啦’苹果果实作为接种材料。首先将苹果清洗干净,晾干,再用75%酒精消毒,然后用无菌水冲洗3次。用无菌铁钉(5 mm)刺破苹果表面后,将菌丝块接入伤口处,接种无菌PDA培养基作为阴性对照(CK)。将接种后的苹果果实密封并保存在25 ℃的培养箱中。每个处理重复9次,接种后每天观察发病情况并记录病斑扩展直径(D)。结果分别确定为弱致病性(D<27.5 mm)、中度致病性(27.5 mm
2 结果与分析
2.1 苹果褐腐病分离菌株形态学鉴定
苹果褐腐病症状表现为果实的表面会发生腐烂(图1-A和1-B)。发病部位呈黄褐色。严重时呈黑色,有发酵气味,使果实无法食用,影响果实品质和经济效益。从21份样品中分离出的32份菌株均为同一类型,命名为PGHF。菌株PGHF在PDA培养基上生长7 d后(图1-C和1-D),菌落直径为85 mm,边缘整齐、圆形,表面蓬松,气生菌丝的正面和背面是白色的。分离株在培养基上生长30 d后(图1-E和1-F),气生菌丝贴在在培养基表面生长,菌落产生大小和形状不同的深褐色基质。在显微镜下观察,菌丝无色透明,有隔膜,分生孢子梗直接由菌丝发育而来。分生孢子呈珠状,有分枝或单枝(图1-G和1-H)。分生孢子呈黄棕色、柠檬形或纺锤形,大小为7.73 μm~10.83 μm×12.52 μm~19.97 μm(图1-I)。根据形态特征观察,判断分离菌株与云南链核盘菌(Moniliayunnanensis)相似。

A和B.果实褐腐病症状;C和D.在PDA上生长7 d的菌落;E和F.在PDA上生长30 d的菌落;G和H.分生孢子梗和分生孢子; I.分生孢子。标尺表示20 μm
2.2 苹果褐腐病分离菌分子生物学鉴定
使用真菌通用引物ITS1/ITS4、特异性引物Bt2a/Bt2b和Lcc2对分离得到的PGHF进行PCR扩增,ITS基因长度为514 bp,TUB基因长度为451 bp,Lcc2基因长度为 887 bp。BALST比较结果表明,PGHF菌株的3个基因与云南链核盘菌(Moniliayunnanensis)的序列匹配率最高。从NCBI下载同属已知菌株和外群已知菌株,构建系统发育树(图2,本研究使用的菌株加粗)。菌株PGHF和云南链核盘菌(Moniliayunnanensis)(菌株号:BCB-1、AK9-1、YS1-1)以70%的支持率聚集在同一分支,亲缘关系接近。序列比对结果表明,菌株PGHF和云南链核盘菌Moniliayunnanensis(菌株号:BCB-1、AK9-1、YS1-1)的ITS、TUB和Lcc2基因序列同一性分别为85.48%、88.57%和84.82%(P<0.05)(图3)。分离菌株ITS基因与其他菌株的序列无差异,而TUB和Lcc2基因的序列同一性明显高于其他菌株。随后,利用特异性引物ClaF/ClaR、LlaF/LlaR、GplaF/PlaR、GClaF/GClaR和GplaF/GlaR对PGHF进行PCR扩增,进一步确认分离物是否为云南链核盘菌(Moniliayunnanensis)。结果表明,云南链核盘菌(Moniliayunnanensis)的特异性引物GClaF/GClaR在电泳中显示出一条大小为600 bp的亮带(图4)。结合形态特征,确定分离出的褐腐病病原菌PGHF为云南链核盘菌(Moniliayunnanensis)。

图2 基于 ITS、 TUB和 Lcc2基因的最大简约分析系统发育图(隐秘刺盘孢C.aenigma为外群)Fig.2 Phylograms of Monilinia spp. and Monilia complex based on maximum-parsimony analysis with ITS, TUB and Lcc2 gene(C.aenigma are outgroups)

云南链核盘菌ITS基因序列同一性与核果链核盘菌、梅生链核盘菌差异显著,与其他3种链核盘菌无显著差异;云南链核盘菌TUB基因序列同一性与其余5种链核盘菌差异显著;云南链核盘菌 Lcc2基因序列同一性与其余5种链核盘菌差异显著。图中不同小写字母表示不同链核盘菌间差异显著(P<0.05)

云南链核盘菌Monilia yunnanensis 的特异性引物为GClaF/GClaR。PCR产物约600 bp
2.3 苹果褐腐病病原菌致病性测定
分离菌株PGHF对不同品种苹果的致病性试验结果表明,菌株接种24 h后对苹果无明显致病性;菌株接种48 h后对‘秦冠’‘富士’和‘新红星’有不同程度的致病作用(表2)。菌株接种‘富士’48 h后病斑直径为26.28 mm,病斑扩展率为21.28 mm/d(P<0.05);菌株接种‘秦冠’48 h后病斑直径为19.72 mm,病斑扩展率为14.72 mm/d (P<0.05);菌株接种‘新红星’48 h后病斑直径为15.67 mm,病斑扩展率为10.67 mm/d(P< 0.05)。‘嘎啦’接种分离株48 h后发病不明显。菌株接种‘富士’72 h后表现有较强的致病性,病斑直径为44.78 mm(图5-B),病斑扩展率为18.50 mm/d(P<0.05),明显快于其他品种。菌株接种‘秦冠’和‘新红星’72 h后表现为中度致病性,病斑直径分别为36.39 mm(图5-A)和30.00 mm(图5-D),病斑扩展率为16.67 mm/d和14.33 mm/d(P<0.05)。菌株接种‘嘎啦’72 h后发病不明显(图5-C)。

表2 苹果果实接种褐腐病病原菌的扩展率和病斑直径Table 2 Expansion rate and diameter of brown rot inoculated on apple fruit
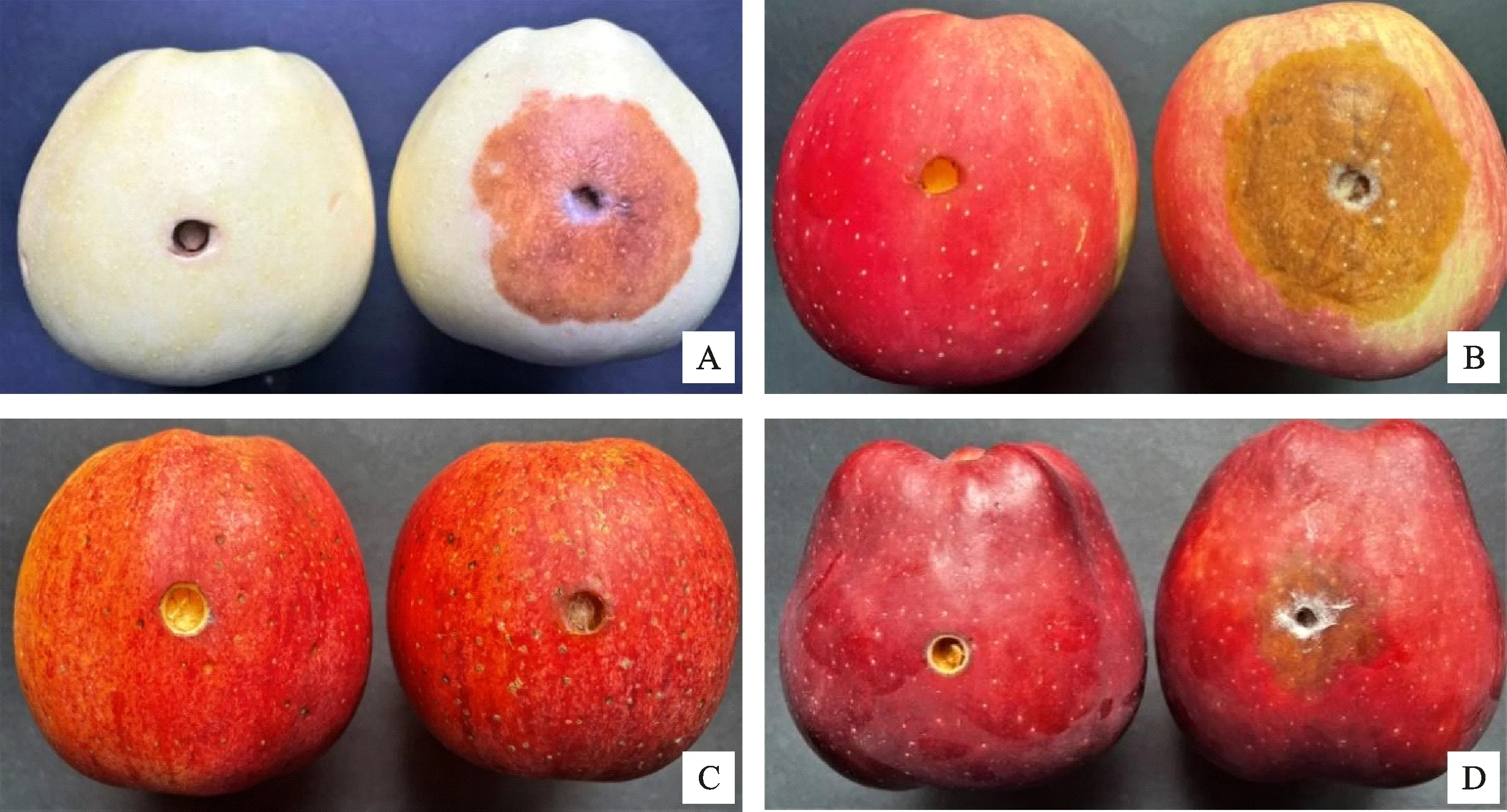
左边果实为对照,右边果实为处理;A.秦冠;B.富士;C.嘎啦;D.红星
3 讨 论
本研究从甘肃省平凉市静宁县苹果产区采集的苹果褐腐病样品中分离出同一种类型的真菌。结合形态特征、多基因序列分析和常规PCR方法,确定该地区苹果褐腐病分离株为云南链核盘菌(Moniliayunnanensis),经柯赫氏法则确定为当地苹果褐腐病病原菌。云南链核盘菌是中国普遍存在的褐腐病病原菌,为2011年在云南省发现的新种,分布于云南大部分地区。在北京、河北、陕西、新疆、辽宁等省也有报道,对桃、杏、山楂、苹果、梨等核果类果实和仁果类果实有很强的危害[9,12-13]。
近年来,Zhang等[14]首次在西藏油桃上分离到云南链核盘菌,进一步表明云南链核盘菌在中国褐腐病发生地区分布广泛。Zhu等[11]通过多基因系统发育分析表明,Moniliayunnanensis、M.polystroma和Moniliniafructigena3 种亲缘关系较近,而云南链核盘菌与其他褐腐病病原的亲缘关系较远,病原菌在地理分布上也表现出差异[15-17]。本试验仅对甘肃省平凉市静宁县的褐腐病病原进行了初步鉴定,采样面积小,样本较少。今后将针对不同地区,甚至是不同国家褐腐病分离种群的遗传多样性进一步探讨,同时对于不同地区的遗传分化也有待进一步研究。
通过对不同品种苹果的致病性试验发现,云南链核盘菌对不同苹果品种具有不同的致病表现,对‘富士’呈强致病性,对‘嘎啦’致病性较弱。这可能与品种的抗病性有关,其抗病机制有待进一步探索。但本研究中用于致病性试验的苹果品种较少,品种的抗病性无法进一步阐述。后期应选择更多品种进行试验,为抗病育种提供理论依据。
4 结 论
综上所述,甘肃省静宁县苹果褐腐病病原菌为云南链核盘菌(Moniliayunnanensis),该病原菌对不同品种苹果的致病性具有一定差异。

