软肝汤联合恩替卡韦治疗乙型病毒性肝炎肝硬化腹水临床观察*
陈 杰,高凌燕
(河北省滦南县医院,河北 唐山 063500)
乙型病毒性肝炎(简称乙肝)是由乙型肝炎病毒引起的以肝脏病变为主的传染病,在肝炎疾病中较常见,临床表现为以转氨酶升高为典型特征的肝炎症状,并出现乏力、畏食、恶心、腹胀、肝区疼痛等症状[1]。随着病情的发展,还会出现肝细胞坏死、残存肝细胞结节性再生、结缔组织增生与纤维隔形成,导致肝小叶结构破坏和假小叶形成,肝脏逐渐变形、变硬,发展为肝硬化[2],甚至出现肝腹水、消化道出血、肝性脑病、继发感染等严重症状[3]。目前,尚无治疗乙肝肝硬化腹水的特效药物,仍以抗病毒和抗炎治疗为主。恩替卡韦是一种新型抗乙型肝炎病毒药物,为鸟嘌呤核苷类似物,通过抑制乙型肝炎病毒聚合酶的活性而发挥治疗乙肝肝硬化腹水的作用,但仅是对症治疗,无法根治[4-5]。中医认为,乙肝肝硬化腹水属“积聚”“臌胀”“黄疸”“胁痛”的病变范畴,病机在于邪毒入侵、症瘕积块,治疗应以清热解毒、软肝散结、活血祛瘀为主要原则[6]。软肝汤由党参、郁金、鳖甲等中药组方,具有软坚散结、化瘀解毒、益气养血之功效,既往用于治疗各型肝病效果较好[7]。本研究中探讨了软肝汤联合恩替卡韦治疗乙肝肝硬化腹水的临床疗效。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:实验室肝功能与腹部超声、电子计算机断层扫描等检查结果均符合《肝硬化腹水及相关并发症的诊疗指南(2017,北京)》中诊断标准[8],确诊为乙肝肝硬化腹水;年龄40~75岁。本研究方案经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:合并肝硬化及酒精性或药物性肝衰竭;合并戊型、丙型肝炎病毒感染;合并艾滋病病毒、Epstein - Barr 病毒感染导致的肝功能损伤;合并自身免疫性肝病;合并肺结核等相关肺部疾病;合并血液系统疾病、显著出血倾向、恶性肿瘤;妊娠期或哺乳期;伴药物成瘾性、药物过敏既往史;对本研中所用药物耐受性差,出现严重不良反应。
病例选择与分组:选取医院内科和感染科2019 年5 月至2020 年5 月收治的乙肝肝硬化腹水患者108 例,分为对照组和研究组,各54 例。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性。详见表1。

表1 两组患者一般资料比较(n=54)Tab.1 Comparison of the patients” general data between the two groups(n=54)
1.2 方法
对照组患者口服恩替卡韦分散片(正大天晴药业集团股份有限公司,国药准字H20100019,规格为每片0.5 mg),每次1片,每日1次。研究组患者在对照组治疗基础上加用软肝汤,组方:党参20 g,郁金12 g,鳖甲25 g,绞股蓝10 g,白花蛇舌草10 g,丹参15 g,龙葵15 g,三七10 g,片姜黄15 g,甘草10 g,赤芍 10 g。加水2 400 mL,煎至1 200 mL,去药渣,再煎;取汁600 mL,温服200 mL,每日2 剂,早晚分次服用,以3 个月为1 个疗程。两组均治疗3个月。
1.3 观察指标与疗效判定标准
肝功能指标:采集患者治疗前后的空腹静脉血各5 mL,抗凝,采用SIGMA3-18K型台式高速冷冻离心机(德国赛多利斯集团)离心(转速为5 000 r/min,半径为5 cm)15 min,分离得血清上清液标本。采用GRT210 型全自动生化分析仪(济南岱罡生物科技有限公司)检测天门冬氨酸氨基转移酶(AST)、总胆红素(TBiL)、丙氨酸氢基转移酶(ALT)、碱性磷酸酶(ALP)水平,试剂盒由翌圣生物科技(上海)股份有限公司提供。
免疫功能指标:采用DxP Athena 型流式细胞仪(青岛佳鼎分析仪器有限公司)检测血清T 淋巴细胞亚群CD3+,CD4+,CD8+细胞水平,并计算CD4+/CD8+,试剂盒由深圳子科生物科技有限公司提供。
炎性因子:采用放射免疫分析法检测血清热休克蛋白47(HSP47)、内皮型一氧化氮合酶(eNOS)、髓鞘碱性蛋白(MBP)水平,检测仪器为E8364C 型放射免疫分析仪(深圳市迈凯瑞仪器仪表有限公司),检测试剂盒由济南新美康生物技术有限公司提供。
肝功能指标:采用Multiskan SkyHigh 型全波长酶标仪(赛默飞世尔科技<中国>有限公司)检测血清上清液标本的乙肝表面抗原定量,采用DW-T6型彩色多普勒超声诊断仪(大为医疗<江苏>有限公司)检测肝脏硬度值及脾脏直径。
疗效判定[9]:腹水、肝肿大、腹痛、腹胀等症状完全消退,肝功能指标恢复至正常水平,免疫功能指标显著改善,炎性因子水平显著降低,为显效;以上各项症状均显著改善,肝功能指标均显著降低,免疫功能、炎性因子水平有一定改善,为有效;以上各项症状、肝功能指标、炎性因子、免疫功能均无改善,为无效。总有效=显效+有效。
治疗安全性:统计患者治疗期间的不良反应发生情况,包括头晕恶心、腹泻腹痛、口苦咽干、皮疹。
1.4 统计学处理
2 结果
结果见表2至表7。

表2 两组患者临床疗效比较[例(%),n=54]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=54]
表3 两组患者血清炎性因子水平比较(,ng/L,n=54)Tab.3 Comparison of serum inflammatory factor levels between the two groups(,ng/L,n=54)

表3 两组患者血清炎性因子水平比较(,ng/L,n=54)Tab.3 Comparison of serum inflammatory factor levels between the two groups(,ng/L,n=54)
注:与本组治疗前比较,*P < 0.05。表4至表6同。Note:Compared with those before treatment,*P < 0.05(for Tab.3-6).
组别HSP47治疗前82.16±9.38 80.36±9.32 1.000 0.319治疗后9.17±2.01*13.26±2.97*8.381 0.000治疗后30.32±5.17*37.11±6.10*6.240 0.000治疗后62.84±7.82*70.10±8.83*4.504 0.000 eNOS治疗前112.43±15.12 110.74±15.21 0.579 0.564研究组对照组t值P值MBP治疗前29.11±5.10 28.06±5.24 1.055 0.294
表4 两组患者肝功能指标水平比较(,n=54)Tab.4 Comparison of liver function index levels between the two groups(,n=54)
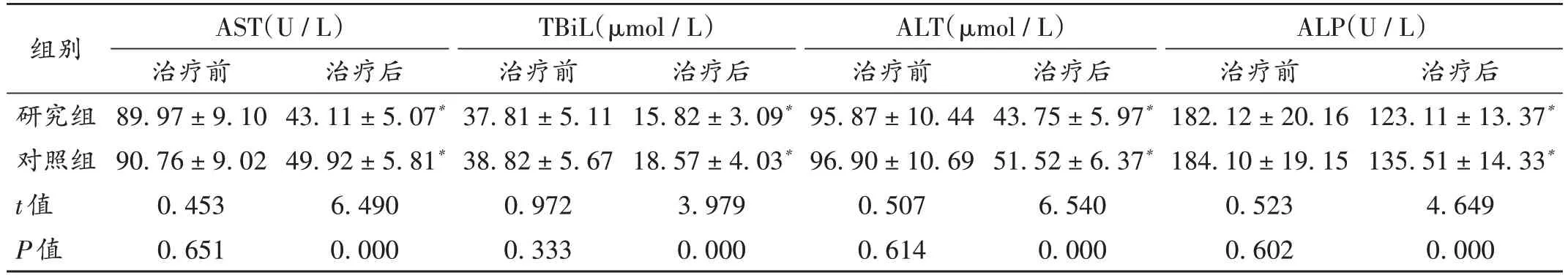
表4 两组患者肝功能指标水平比较(,n=54)Tab.4 Comparison of liver function index levels between the two groups(,n=54)
组别研究组对照组t值P值AST(U/L)治疗前89.97±9.10 90.76±9.02 0.453 0.651治疗后123.11±13.37*135.51±14.33*4.649 0.000治疗后43.11±5.07*49.92±5.81*6.490 0.000 TBiL(µmol/L)治疗前37.81±5.11 38.82±5.67 0.972 0.333治疗后15.82±3.09*18.57±4.03*3.979 0.000 ALT(µmol/L)治疗前95.87±10.44 96.90±10.69 0.507 0.614治疗后43.75±5.97*51.52±6.37*6.540 0.000 ALP(U/L)治疗前182.12±20.16 184.10±19.15 0.523 0.602
表5 两组患者免疫功能指标水平比较(,%,n=54)Tab.5 Comparison of immune function index levels between the two groups(,%,n=54)

表5 两组患者免疫功能指标水平比较(,%,n=54)Tab.5 Comparison of immune function index levels between the two groups(,%,n=54)
+CD3+CD4CD8++组别研究组对照组t值P值CD4+ /CD8治疗前44.78±5.13 43.33±5.08 1.374 0.172治疗后54.97±5.26*50.01±5.03*5.008 0.000治疗前38.05±4.15 39.13±4.43 1.307 0.194治疗后49.75±5.21*45.01±4.83*4.903 0.000治疗前32.12±3.10 33.04±3.08 1.547 0.125治疗后27.12±2.62*30.11±2.80*5.729 0.000治疗前1.18±0.23 1.22±0.19 0.985 0.327治疗后1.83±0.32*1.49±0.29*5.615 0.000
表6 两组患者肝功能指标比较(,n=54)Tab.6 Comparison of liver function indexes between the two groups(,n=54)

表6 两组患者肝功能指标比较(,n=54)Tab.6 Comparison of liver function indexes between the two groups(,n=54)
组别治疗后乙肝表面抗原定量(ng/mL)治疗前肝脏硬度值(kPa)治疗前治疗后脾脏直径(cm)治疗前治疗后3.82±1.01*5.46±1.20*5.374 0.000 12.16±2.98 11.62±2.79 0.678 0.549研究组对照组t值P值42.41±6.78 44.01±7.09 0.579 0.564 10.84±2.92*14.42±3.81*4.376 0.000 22.11±4.98 21.18±5.24 0.897 0.372 14.17±3.21*16.96±2.97*3.762 0.000
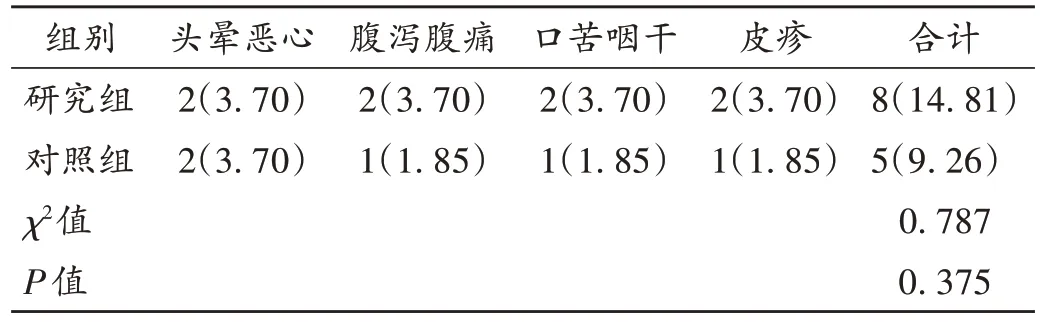
表7 两组患者不良反应发生情况比较[例(%),n=54]Tab.7 Comparison of the incidence of adverse reactions between the two groups[case(%),n=54]
3 讨论
乙肝肝硬化腹水是由肝细胞变性、坏死、再生,促使纤维组织增生和瘢痕收缩导致而成。肝脏病变过程中肝细胞被破坏,细胞外间质生成与降解失调,结缔组织形成,正常肝脏结构最终被破坏[10]。恩替卡韦是治疗乙肝肝硬化腹水的常用核苷类药物,能有效抑制病毒复制、炎症反复刺激,减轻肝脏损伤,发挥抗肝硬化、缓解恶性肝腹水的治疗作用[11]。
中医认为,外感风邪、湿毒内侵导致机体瘀血阻络、气血亏虚等,湿热邪毒逆行积聚于肝,进而导致胁肋隐痛或胁下痞块,面色晦暗,且症瘕积块、痞块,即是胀病之根,日积月累,腹大如箕,即为肝硬化代偿期[12]。故乙肝肝硬化腹水治疗以软坚散结、化瘀解毒、益气养血等为主要原则[13]。软肝汤是中医临床治疗慢性乙肝肝硬化并发恶性腹水的常用汤药。本研究结果显示,观察组患者的临床疗效显著提升,表明软肝汤治疗乙肝肝硬化腹水的效果良好。这是由于软肝汤是由党参、郁金、鳖甲、绞股蓝、白花蛇舌草、丹参、龙葵、三七、片姜黄、甘草、赤芍等中药材组方,方中党参补中益气、健脾益肺;郁金疏肝利胆;鳖甲养阴清热、平肝熄风;绞股蓝调节血脂、血糖,促进尿酸排泄;白花蛇舌草清热解毒、消肿散结、利尿除湿;丹参活血祛瘀,改善心肌功能;龙葵凉血解毒、消炎抗菌;三七祛瘀止痛;片姜黄破血行气;赤芍行瘀凉血、止痛;甘草调和诸药,协同不同药物作用,有助于延缓肝纤维化的发展进程[14-15]。全方配伍合理,共奏软坚散结、化瘀解毒、益气养血之功效。本研究中,观察组患者治疗后的AST,TBiL,ALT,ALP 水平均显著低于对照组,乙肝表面抗原定量、肝脏硬度值及脾脏直径均显著低于对照组,表明软肝汤能改善乙肝肝硬化腹水患者的肝功能。
乙肝肝硬化腹水的病情进展与机体的免疫功能异常密切相关,T 淋巴细胞亚群是反映机体免疫功能的重要指标。本研究中,研究组患者治疗后的CD3+,CD4+,CD4+/CD8+水平均显著高于对照组,CD8+显著低于对照组,表明软肝汤能改善乙肝肝硬化腹水患者的机体免疫功能,这得益于软肝汤中党参补中益气、健脾益肺的功效,能增加患者的自身抵抗力,提高免疫功能[16]。乙肝肝硬化腹水的发生、发展伴随着多种炎性因子的异常表达。HSP47 是一种具有胶原特性的分子伴侣,存在于多种器官脏器的内质网中,其在肝脏疾病进展中的高表达能导致肝脏细胞损伤,并加重出血倾向;eNOS是存在于血管内皮细胞上的一种小分子蛋白,在肝脏组织血管系统受到损伤刺激后,能刺激血管内皮释放氧化自由基,从而加重对肝血管的损伤;MBP 是一种维持神经系统结构功能的重要蛋白,当神经功能受损后,髓鞘中会释放大量MBP 进入血液,在肝脏损伤神经疾病中也呈高表达[17]。本研究中,研究组患者的HSP47,eNOS,MBP水平均显著低于对照组,表明软肝汤能抑制机体中炎性因子的表达,这得益于软肝汤中白花蛇舌草、三七、龙葵等中药材的清热解毒、抗菌消炎功效[18]。研究组患者的不良反应发生率未显著增加,提示安全性良好。
综上所述,软肝汤联合恩替卡韦治疗乙肝肝硬化腹水的临床疗效良好,能改善患者的肝功能和免疫功能,抑制炎性表达,且安全性良好。

