LncRNA PVT1 调控 miR-1207-5p/FMNL2 对 HL-60细胞凋亡及化疗敏感性的影响*
郭毅刚,宋 斌,胡 平,张荣耀,陈 旭,易 琼,万楚成
(湖北省十堰市太和医院·湖北医药学院附属医院,湖北 十堰 442000)
急性髓性白血病是一种恶性克隆性疾病,占白血病患病人数的60%[1]。肿瘤发展过程中,基因改变导致细胞转化为癌前细胞群,最终形成具有侵袭和转移能力的肿瘤[2]。临床主要采用化学治疗,但耐药影响疗效[3]。有效、灵敏的治疗靶点在急性髓性白血病的治疗过程中显得尤为重要[4]。微小RNA(miR)是一种小型非编码RNA,参与细胞分化、迁移、凋亡等一系列过程,并可能与肿瘤患者的临床病理特征或预后有关[5-6]。其表达受多种因素影响,包括长链非编码RNA(LncRNAs)。LncRNAs 是一类长度超过200 个核苷酸的非蛋白质编码转录物,通过与miRNAs、mRNAs、蛋白质的相互作用发挥病理功能,长链非编码RNA 浆细胞瘤转化迁移基因1(LncRNA PVT1)异常表达与肿瘤的发生、发展密切相关[7]。同源形成素样蛋白2(FMNL2)与多种癌症转移密切相关,可与miRNA或LncRNAs相互作用,参与肿瘤细胞的增殖和转移[8]。目前,关于LncRNA PVT1对miR - 1207 - 5p/ FMNL2 的调控作用尚未见报道。为此,本研究中探讨了LncRNA PVT1和miR-1207-5p对HL - 60 细胞增殖、侵袭、迁移及凋亡的影响。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:BSC - 1100ⅡB2 - X 型生物安全柜,BKQ -B75 型高压蒸汽灭菌锅,博科300L 型CO2细胞培养箱,均购自中国博科公司;5320R 型4 ℃离心机(德国徕卡公司);伯乐Mini - PRO TEAN 型电泳仪(美国伯乐公司);EVOS M7000 型倒置显微镜(意大利赛默飞公司);LAS 4000型成像系统,Bio-Rad 微孔板阅读器,均购自美国GE Healthcare 公司;BD FACSCanto Ⅱ型流式细胞仪(美国赛默飞世尔科技公司)。
试药:RPMI 1640 培养基(批号为315484),胎牛血清(FBS,批号为310549),胰蛋白酶(批号为315497),柔红霉素(批号为948712),均购自美国Sigma 公司;Amplite 萤光素酶报告基因检测试剂盒(美国AATBioquest 公司,货号 AAT - 12519);Lipofectamine 3000 转染试剂盒(南京建成生物有限公司,批号为915482);V-荧光素异硫氰酸酯(FITC)凋亡试剂盒(美国Sun-Shine公司,批号为396765);细胞计数试剂盒8(CCK - 8,批号123594),RNA 提取试剂盒(批号为9451894),RNA反转录试剂盒(批号3201549),实时逆转录定量聚合酶链反应(RT - qPCR)试剂盒(批号为3021948),购自上海优宁维生物有限公司;FMNL2 蛋白抗体(批号为661259),β-actin 蛋白抗体(批号549258),均购自美国Abcam公司;山羊抗兔二抗(武汉三鹰生物有限公司,批号为614948)。
细胞:HL - 60 细胞株(武汉普诺赛生命科技有限公司)。
1.2 方法
1.2.1 细胞培养
于液氮罐中取HL-60细胞株1支,进行细胞复苏,将复苏后的细胞置RPMI1640 培养基中,采用细胞培养皿进行分装,于培养箱(5%CO2,37 ℃)中培养24 h 后更换培养基,细胞覆盖率达70%时在培养皿中加入胰蛋白酶,进行细胞传代。
1.2.2 细胞分组、转染及萤光素酶的报告基因检测
将 HL - 60 细胞分为对照组、miR - NC 组、PVT1 -siRNA 组、miR - 1207 - 5p inhibitor 组和 miR - 1207 -5p mimic 组。对照组细胞不处理;miR - NC 组、PVT1 -siRNA、miR - 1207 - 5p inhibitor 组和 miR - 1207 -5p mimic 组按Lipofectamine 3000 转染试剂盒说明书方法分别将miR - NC,PVT1 - siRNA,miR - 1207 -5p inhibitor,miR - 1207 - 5p mimic 转染到 HL - 60 细胞,48 h 后用双萤光素酶检测试剂分析miR - 1207 -5p和FMNL2野生型/突变型(wt/mut)萤光素酶活性。
1.2.3 CCK-8 法检测细胞存活率
取对数生长期的HL - 60 细胞,在培养皿中加入1 mL 胰蛋白酶轻微吹打2 min,使细胞完全悬浮。将悬浮的细胞转移到1.5 mL离心管中离心(转速为2 000 r/min)10 min,弃去上清液,加入1 mL RPMI 1640培养基,轻微吹打,使细胞充分悬浮,将细胞悬液转移至96 孔板中,每孔100µL,培养箱中培养24 h,弃去96孔板中的培养基,每孔依次加入新的RPMI 1640 培养基,各组6 个复孔,培养24 h,弃去培养液,每孔加入100 µL 培养液和10 µL CCK-8 溶液,持续培养3 h,于450 nm 波长处使用Bio-Rad 型微孔板阅读器读取吸光度,重复3 次,计算细胞存活率。
1.2.4 改良Matrigel Boyden 室测定法测定细胞侵袭性
将对数生长期的HL-60细胞,按5×105个/mL接种于有基质胶的滤膜上,滤膜的下室仓中放入10% FBS,作为趋化剂,培养箱中培养24 h,取出滤膜并染色,使用EVOS M7000 型倒置显微镜对滤膜上的细胞计数。计数时,每个滤膜随机选择5 个视野,重复6 次,取平均值。
1.2.5 划痕实验检测细胞迁移力
将对数生长期的HL-60细胞按5×105个/mL接种于6 孔板内,置培养箱中培养48 h。划痕实验时吸头垂直孔壁划痕,并加入无血清培养基,划痕完成后培养48 h,使用EVOS M7000 型倒置显微镜观察,并分析相对迁移率。
1.2.6 流式细胞术检测细胞凋亡率
使用FITC凋亡试剂盒,将HL-60细胞用磷酸盐缓冲液(PBS)洗涤2次,用1×结合缓冲液在1×106个/mL浓度下悬浮于400 µL V - FITC 溶液中,暗室温孵育15 min,然后加入PI 10 µL,4 ℃避光孵育5 min,立即用流式细胞仪分析细胞,重复6次。
1.2.7 MTT 法检测细胞对柔红霉素敏感性
将对数生长期的HL-60细胞,按5×105个/mL接种于96 孔板,置培养箱中常规培养24 h。以不同质量浓度(0,0.5,1,2,4,8 µg/ mL)的柔红霉素处理细胞48 h,每个剂量设置6 个复孔,处理结束后,每孔加质量浓度为 5 g/ L 的 MTT 试剂 20 µL,4 h 后加入 150 µL 二甲基亚砜,采用酶标仪于490 nm 波长处测量光密度(OD),并计算细胞增殖活力。
1.2.8 总RNA 提取及RT-qPCR
取出培养皿放入无菌操作台,弃去培养皿中的培养液。根据RNA提取试剂盒说明书提取细胞总RNA,并利用反转录试剂盒得到cDNA,- 80 ℃保存备用。RT -qPCR 体系:SYBR Green qPCR SuperMix 16.25 µL,特异性引物2.0µL,模板cDNA3.25µL,DEPC水补足至30µL。反应条件:95 ℃,10 min;95 ℃,10 s;60 ℃,30 s;70 ℃,30 s;共 40 个循环。设置 6 个复孔,根据公式(2-ΔΔCt)计算、分析Cdc42和PAK1 mRNA表达,引物序列见表1。

表1 引物序列Tab.1 Sequences of primers
1.2.9 免疫印迹(Western blot)法检测细胞相关蛋白表达
取培养皿,放入无菌操作台,弃去培养皿中的培养液,加入 1 mL PBS 和 100 µL 蛋白酶 K 溶液,使细胞悬浮,超声细胞破碎仪作用2 min 破碎细胞,离心(转速3 000 r/min,4 ℃)20 min,取上清液,置新的1.5 mL EP管中。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离、转模和封闭后用特异性抗体FMNL2 和β-actin(稀释浓度1∶5 000)在4 ℃条件下孵育12 h,孵育后的条带1%吐温清洗3次,山羊抗兔二抗(稀释浓度1∶500)孵育 2 h,LAS 4000 型成像系统成像并观察结果。
1.3 统计学处理
2 结果
2.1 LncRNA PVT1 对 miR - 1207 - 5p 和 miR -1207-5p 对 FMNL2 的靶向作用
检索生物信息学网站www. Targetscan. org,发现LncRNA PVT1 与 miR - 1207 - 5p、miR - 1207 - 5p 与FMNL2 均有潜在的结合位点。萤光素酶分析结果显示,LncRNA PVT1 可明显增加miR - 1207 - 5p 的萤光素酶活性,miR - 1207 - 5p 可明显增加FMNL2 - wt 的萤光素酶活性,表明LncRNA PVT1 与miR-1207-5p、miR-1207-5p与FMNL2存在靶向调节作用。详见表2和图1。
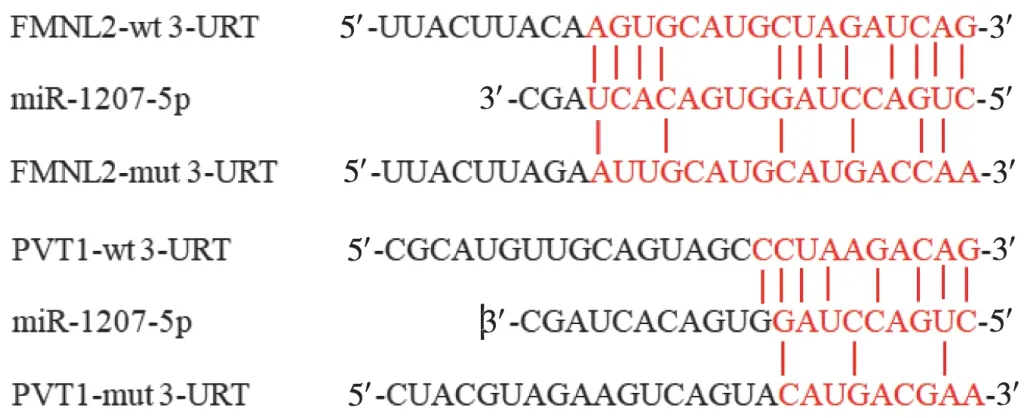
图1 Targetscan预测miR-1207-5p与LncRNA PVT1和FMNL mRNA的互补配对序列Fig.1 Prediction of the complementary pairing sequences of miR -1207 - 5p with LncRNA PVT1 and FMNL mRNA by the Targetscan
表2 萤光素酶报告基因实验结果()Tab.2 Results of luciferase reporter gene assay()

表2 萤光素酶报告基因实验结果()Tab.2 Results of luciferase reporter gene assay()
注:与对照组比较,aP < 0.05;与 miR - NC 组比较,bP <0.05;与 miR - 1207 - 5p inhibitor 组比较,cP < 0.05。表 3 至表7同。Note:Compared with those in the control group,aP < 0.05;Compared with those in the miR -NC group,bP < 0.05;Compared with those in the miR-1207-5p inhibitor group,cP < 0.05(for Tab.2-7).
FMNL2-mut 1.00±0.00 1.01±0.05 0.58±0.06ab 1.02±0.08 8.021<0.001组别对照组miR-NC组miR-1207-5p inhibitor组miR-1207-5p mimic组F值P值LncRNA PVT1-wt 1.00±0.00 1.05±0.02 1.02±0.08 1.49±0.13abc 15.068<0.001 LncRNA PVT1-mut 1.00±0.00 1.04±0.07 0.55±0.06ab 1.03±0.11 9.041<0.001 FMNL2-wt 1.00±0.00 1.02±0.03 1.07±0.05 1.46±0.14abc 16.275<0.001
2.2 LncRNA PVT1 对 miR-1207-5p 表达的影响
与对照组比较,转染PVT1 - siRNA 后,LncRNA PVT1 表达水平显著降低(P< 0.05),miR - 1207 - 5p表达水平显著升高(P<0.05)。详见表3。
表3 转染LncRNA PVT1对miR-1207-5p表达水平的影响(,n=6)Tab.3 Effects of transfection of LncRNA PVT1 on the expression level of miR-1207-5p(,n=6)

表3 转染LncRNA PVT1对miR-1207-5p表达水平的影响(,n=6)Tab.3 Effects of transfection of LncRNA PVT1 on the expression level of miR-1207-5p(,n=6)
miR-1207-5p(2- ΔΔCt)1.00±0.00 1.03±0.04 1.43±0.11ab 17.063<0.001组别对照组miR-NC组PVT1-siRNA组F值P值LncRNA PVT1(2- ΔΔCt)1.00±0.00 1.05±0.07 0.52±0.05ab 12.053<0.001
2.3 转染miR - 1207 - 5p 对细胞存活率、迁移率及侵袭力的影响
与对照组比较,miR-1207-5p inhibitor 组细胞存活率、迁移率和侵袭均数显著降低(P< 0.05),miR -1207-5p mimic组细胞存活率、迁移率和侵袭数均显著升高(P< 0.05);对照组和miR - NC 组无显著差异(P>0.05)。详见表4和图2。

图2 转染miR-1207-5p对细胞的影响(×400)Fig.2 Effects of transfection of miR-1207-5p on the cells(× 400)
表4 转染miR-1207-5p对细胞存活率、迁移率和侵袭力的影响(,n=6)Tab.4 Effects of transfection of miR-1207-5p on the survival rate,migration rate and invasiveness of cells(,n=6)

表4 转染miR-1207-5p对细胞存活率、迁移率和侵袭力的影响(,n=6)Tab.4 Effects of transfection of miR-1207-5p on the survival rate,migration rate and invasiveness of cells(,n=6)
组别对照组miR-NC组miR-1207-5p inhibitor组miR-1207-5p mimic组F值P值细胞存活率(%)100.00±0.00 99.14±8.26 59.83±5.10ab 147.19±10.22abc 32.064<0.001细胞迁移率(%)100.00±0.00 98.79±6.33 73.86±6.19ab 136.54±10.88abc 26.481<0.001细胞侵袭数(个)151.78±11.27 152.33±10.82 97.92±7.09ab 207.58±12.94abc 38.552<0.001
2.4 转染miR-1207-5 p 对细胞凋亡率的影响
与对照组比较,miR-1207-5p inhibitor 组细胞凋亡率显著升高(P< 0.05),miR - 1207 - 5p mimic 组细胞凋亡率显著降低(P<0.05);对照组和miR-NC组无显著差异(P>0.05)。详见图3和表5。
表5 转染miR-1207-5p对细胞凋亡率的影响(,n=6)Tab.5 Effects of transfection of miR-1207-5p on the apoptosis rate(,n=6)

表5 转染miR-1207-5p对细胞凋亡率的影响(,n=6)Tab.5 Effects of transfection of miR-1207-5p on the apoptosis rate(,n=6)
组别对照组miR-NC组miR-1207-5p inhibitor组miR-1207-5p mimic组F值P值细胞凋亡率(%)11.07±1.12 12.22±1.08 24.13±2.05ab 5.26±0.51abc 43.228<0.001

图3 转染miR-1207-5 p对细胞凋亡的影响Fig.3 Effects of transfection of miR-1207-5p on the apoptosis
2.5 干扰LncRNA PVT1 对HL - 60 细胞柔红霉素敏感性的影响
与对照组比较,同质量浓度柔红霉素作用下,PVT1-siRNA组HL-60细胞的活力显著升高(P<0.05)。详见表6。
表6 干扰LncRNA PVT1对HL-60细胞柔红霉素敏感性的影响(,n=6)Tab.6 Effects of interfering the expression of LncRNA PVT1 on the sensitivity of HL-60 cells to daunorubicin(,n=6)

表6 干扰LncRNA PVT1对HL-60细胞柔红霉素敏感性的影响(,n=6)Tab.6 Effects of interfering the expression of LncRNA PVT1 on the sensitivity of HL-60 cells to daunorubicin(,n=6)
组别对照组PVT1-siRNA组t值P值0µg/mL 97.12±4.53 94.59±4.87 0.653 0.582 0.5µg/mL 82.37±3.13 88.29±3.26a 3.208 0.001 1µg/mL 72.78±3.11 81.09±3.35a 3.872<0.001 2µg/mL 61.22±3.08 70.37±3.15a 3.583<0.001 4µg/mL 50.16±3.87 59.23±3.92a 4.031<0.001 8µg/mL 39.29±3.19 50.16±3.88a 5.275<0.001
2.6 FMNL2 mRNA 和蛋白表达水平
与对照组比较,miR - 1207 - 5p inhibitor 组细胞FMNL2 mRNA 和蛋白表达水平均显著升高(P<0.05),miR - 1207 - 5p mimic 组细胞 FMNL2 mRNA 和蛋白表达水平均显著降低(P<0.05);对照组和miR-NC组无显著差异(P>0.05)。详见表7和图4。
表7 各组细胞FMNL2 mRNA和蛋白表达水平比较(,n=6)Tab.7 Comparison of FMNL2 mRNA and protein expression levels in each group(,n=6)
表7 各组细胞FMNL2 mRNA和蛋白表达水平比较(,n=6)Tab.7 Comparison of FMNL2 mRNA and protein expression levels in each group(,n=6)
组别对照组miR-NC组miR-1207-5p inhibitor组miR-1207-5p mimic组F值P值FMNL2 mRNA(2- ΔΔCt)1.00±0.00 0.98±0.07 1.42±0.09ab 0.62±0.05abc 14.273<0.001 FMNL2/β-actin 0.53±0.06 0.56±0.04 0.89±0.07ab 0.27±0.02abc 19.035<0.001

图4 各组细胞FMNL2免疫印迹图Fig.4 Western blot of FMNL2 in each group
3 讨论
急性髓性白血病具有无限增殖、分化等特点,因造血干细胞堆积而抑制造血功能[9]。病程进展缓慢,早期无明显临床症状,易错过最佳治疗时间。当细胞迅速增殖和扩散,患者出现系列异常临床症状时,多已进展至晚期[10]。目前,临床主要通过手术和化疗等进行治疗,但会出现耐药,难以达到预期效果[11]。迫切需要寻找有效、新颖的检测方法,提高疾病早期的发现率,帮助预后的预测及个性化治疗。
白血病是涉及多基因、多因素、多途径的复杂疾病,分子机制在很大程度上仍未知[12]。非编码RNA 参与癌症的发展,其中的miR通过调控靶基因的表达来发挥作用[13]。几乎每种癌症中都存在异常的miR 谱,miR位于肿瘤基因组和肿瘤相关基因组的不稳定区域[14]。对miR在肿瘤发病机制、侵袭和转移中的作用认识取得了很大进展,但临床用于疾病诊断和治疗的miR 很少。在结肠癌组织中可发现miR - 1207 - 5p 的异常表达,提示 miR - 1207 - 5p 参与了恶性肿瘤的进展[15]。通过检测白血病患者和健康人群血清中的miR水平,两者在某些miR的表达水平上存在显著差异,提示miR可能作为致/抑癌基因参与了白血病的发生[16]。多种LncRNAs在白血病细胞中表达异常,异常表达的LncRNAs可引起下游靶分子上调或下调,导致肿瘤细胞生物学改变,同时发现LncRNAs与淋巴结转移和肿瘤分期显著相关[17]。本研究中分别采用LncRNA PVT1和miR-1207-5p转染 HL-60 细胞,探讨 LncRNA PVT1 和 miR-1207-5p对HL-60 细胞增殖、侵袭、迁移及凋亡的影响。结果显示,转染PVT1 - siRNA 可升高miR - 1207 - 5p 的表达水平,萤光素酶报告提示低表达PVT1可靶向升高miR-1207-5p的表达,高表达miR-1207-5p可升高HL-60细胞增殖、侵袭及迁移水平,凋亡降低,提示miR-1207-5p可能是一种促白血病基因。MTT 试验结果发现,同质量浓度柔红霉素作用下,PVT1-siRNA 组HL-60 细胞的活力显著升高,提示LncRNA PVT1的低表达可引起柔红霉素敏感性降低,可能会降低患者的化疗效果。
生物信息学分析和双萤光素酶报告基因分析证实,FMNL2 是 miR-1207-5p 的下游结合基因,过表达miR-1207-5p可下调FMNL2。有研究显示,FMNL2在多种肿瘤中均为抑癌基因,高表达FMNL2 可抑制肿瘤的发生与发展[18]。FMNL2 在大多数癌症中的作用和作用机制仍有待发现。本研究中,转染miR - 1207 -5p inhibitor 和 miR - 1207 - 5p mimic 后检测细胞内FMNL2转录及翻译水平,发现HL-60细胞转染miR-1207-5p mimic后可导致细胞内FMNL2表达水平降低,升高细胞增殖、迁移及侵袭水平,同时抑制细胞凋亡,提示FMNL2在白血病中起疾病抑制作用,miR-1207-5p表达抑制FMNL2的水平,减弱疾病抑制作用。
综上所述,HL-60细胞中低表达LncRNA PVT1可靶向上调miR - 1207 - 5p 水平,上调的miR - 1207 - 5p可通过抑制FMNL2 的表达以促进细胞的增殖、侵袭和迁移,同时降低细胞凋亡水平和对柔红霉素的敏感性,不利于疾病的治疗。

