FEN1、GTF2IP23、KDM4A在乳腺癌组织中的表达研究*
谭秋芬,胡惠军
广东省惠州市第三人民医院,广东惠州 516002
乳腺癌在临床中较为常见,是一种乳腺组织恶性肿瘤,主要是致癌因子作用于乳腺上皮导致细胞异常增殖[1-2]。乳腺癌发病的性别差异性显著,绝大多数乳腺癌患者为女性,患者发病早期多表现为乳头溢液、乳房肿块等,病情发展至晚期会出现癌细胞转移情况,对患者生命造成威胁[3]。研究显示,瓣状核酸内切酶-1(FEN1)是一种抑癌基因,若FEN1突变,会导致其修复和复制功能改变,诱发乳腺癌[4];转录因子Ⅱⅰ假基因23(GTF2IP23)是一个多功能转录因子,参与生物发育、细胞生长、分化、转录和信号转导等,介导恶性肿瘤发生和发展[5];赖氨酸特异性去甲基化酶4A(KDM4A)被发现高表达于许多种类的癌症中,可作为潜在的肿瘤治疗的靶标[6]。本研究中对乳腺癌患者癌组织中FEN1、GTF2IP23、KDM4A表达进行检测,旨在探究三者在乳腺癌中的表达相关性及联合检测对患者预后的预测价值。
1 资料与方法
1.1一般资料 选取本院于2020年7月至2021年8月进行手术的女性乳腺癌患者72例,年龄35~60岁,平均(47.5±9.8)岁,其中包括更年期患者51例,非更年期期患者21例;肿瘤直径≤3 cm患者38例,肿瘤直径>3 cm患者34例;无淋巴结转移患者35例,有淋巴结转移患者37例;无脉管侵犯患者40例,有脉管侵犯患者32例;病理分期:Ⅰ期32例,Ⅱ期患者31例,Ⅲ期患者7例,Ⅳ期患者2例;癌组织分化程度:高分化32例,中分化29例,低分化11例。另选取本院同期进行手术的女性乳腺良性肿瘤患者70例,年龄36~58岁,平均(46.9±8.8)岁。本研究所有患者均知情同意并签署知情同意书,获本院伦理委员会批准。纳入标准:(1)所有乳腺癌患者均符合中国抗癌学会对乳腺癌的诊断标准[7];(2)均为首次确诊;(3)未接受过相关治疗;(4)良性乳腺肿瘤患者经本院病理检查确诊为良性肿瘤;(5)所有患者均接受手术治疗;(6)病历资料齐全。排除标准:(1)凝血障碍者;(2)处于妊娠期或哺乳期的女性;(3)近1个月内进行过重大手术者;(4)心脑血管疾病患者;(5)精神系统疾病患者。
1.2方法
1.2.1标本采集 收集乳腺癌患者手术切除癌组织、距癌组织5 cm癌旁组织标本及乳腺良性肿瘤患者肿瘤病理组织,将所取病理组织分成4 mm×4 mm大小标本并清洗3次,在甲醛溶液中浸泡、固定,进行脱水,处理后石蜡包埋,之后连续切片(厚度3 μm)做免疫组化标记。
1.2.2免疫组化染色 取制备好的乳腺癌组织、癌旁组织及乳腺良性肿瘤病理组织标本,脱蜡后清洗3次,使用柠檬酸修复液(100 ℃)浸泡15 min后取出静置冷却,以PBS液清洗3次,添加POD阻断剂后常温环境下孵育30 min后再次以PBS液清洗3次,滴加山羊血清封闭,30 min后吸出封闭液、添加一抗,稀释至1∶2 000过夜保存。次日取出后使用PBS液清洗3次,添加二抗,稀释至1∶5 000并完全覆盖30 min,使用PBS液清洗3次之后添加DAB液,显微镜观察,苏木精染核,反蓝、脱水处理后封片。一抗:兔抗人FN1单克隆抗体、兔抗人GTF2IP23单克隆抗体购自Millipore公司,兔抗人KDM4A单克隆抗体购自Signalway Antibody(SAB)抗体公司。二抗:驴抗兔FITC(波长492~520 nm)购自Millipore公司。
1.2.3反转录-实时荧光定量聚合酶链反应(RT-qPCR)检测FEN1表达 Trizol法提取总RNA并测试完整性,以18S RNA为内参,其上游引物序列为:5′-CCCGGGGAGGTAGTGACGAAAAAT-3′,下游引物序列为:5′-CGCCCGCCCGCTCCCAAGAT-3′;FEN1上游引物序列为:5′-AAGGTCACTAAGCAGCACAAT-3′,下游引物序列为:5′-GTAGCCGCAGCATAGACTTTG-3′,反转录处理后进行PCR扩增。反应条件:预变性处理10 min;变性处理95 ℃ 10 s,退火63 ℃ 25 s,延伸72 ℃ 10 s,进行42个循环。2-ΔΔCt方法计算FEN1相对表达水平。仪器使用ABI7500荧光定量PCR扩增仪[购自美国应用生物系统(ABI)公司],FEN1抗体购于美国Abcam公司;所有操作均按照试剂盒说明进行。
1.2.4Western blot法检测GTF2IP23、KDM4A表达 取待测标本,添加裂解液进行处理后取50 μg蛋白,煮至蛋白变性后进行SDS-PAGE凝胶电泳,转膜处理后添加Western封闭液封闭3 h,添加一抗(1∶2 000)后4~6 ℃过夜孵育。次日使用Western液清洗后添加二抗(1∶5 000)孵育2 h,之后使用Western液进行清洗后进行显色、曝光、成像,检测条带灰度值,检测GTF2IP23、KDM4A相对表达水平。仪器使用电化学发光仪(购自上海启步生物科技有限公司)。

2 结 果
2.1各组织中FEN1、GTF2IP23、KDM4A表达差异性分析 良性肿瘤组织、乳腺癌组织中FEN1、GTF2IP23、KDM4A表达水平均高于癌旁组织,差异有统计学意义(P<0.05);乳腺癌组织中FEN1、GTF2IP23、KDM4A表达水平高于癌旁组织,差异有统计学意义(P<0.05)。见表1、图1~3。

表1 各组织中FEN1、GTF2IP23、KDM4A表达水平比较
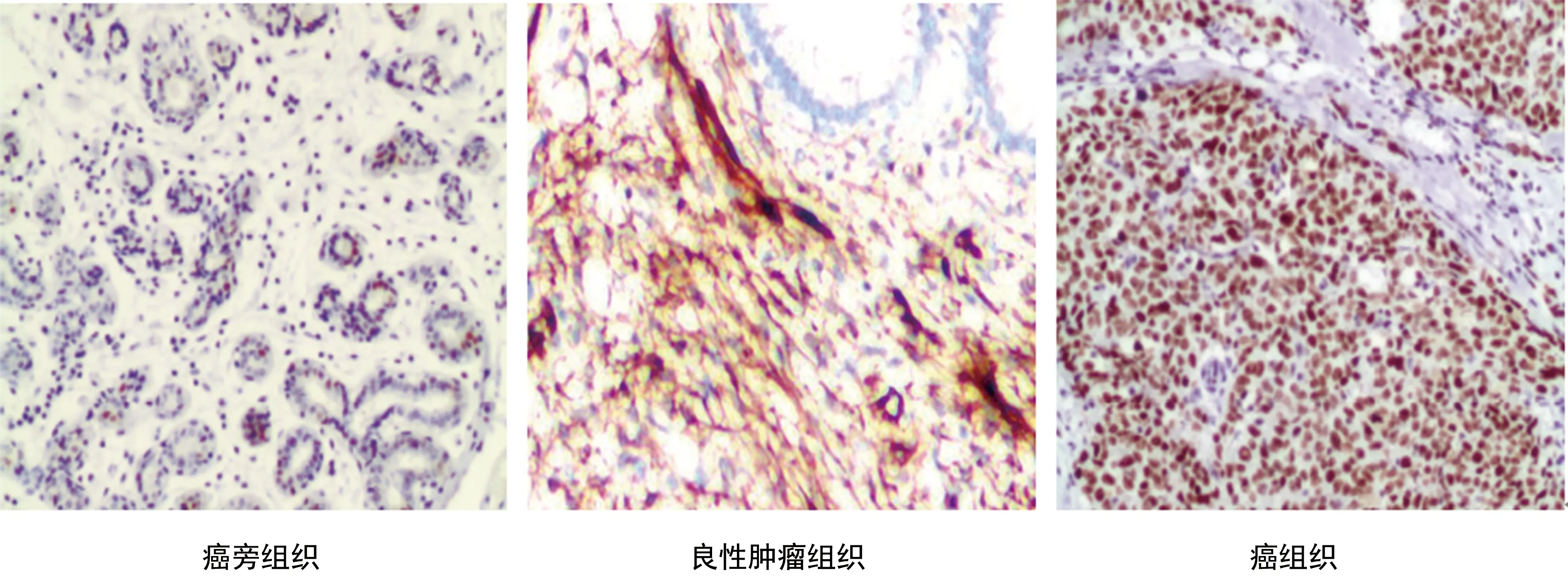
图2 GTF2IP23表达免疫组化染色图(×400)
图3 KDM4A表达免疫组化染色图(×400)
2.2乳腺癌组织中FEN1、GTF2IP23、KDM4A表达与临床病理特征的关系 与非更年期、肿瘤直径≤3 cm、Ⅰ+Ⅱ期、无淋巴结转移、无脉管侵犯及高、中分化患者相比,更年期、肿瘤直径>3 cm、Ⅲ+Ⅳ期、有淋巴结转移、脉管侵犯及低分化患者FEN1、GTF2IP23、KDM4A表达明显升高(P<0.05),见表2。

表2 乳腺癌组织中FEN1、GTF2IP23、KDM4A表达与临床病理特征的关系
2.3乳腺癌组织中FEN1、GTF2IP23、KDM4A表达相关性 乳腺癌组织中FEN1与GTF2IP23、KDM4A表达呈正相关(r=0.404、0.553,均P=0.001);乳腺癌组织中GTF2IP23与KDM4A表达也呈正相关(r=0.582,P=0.001)。见图4。
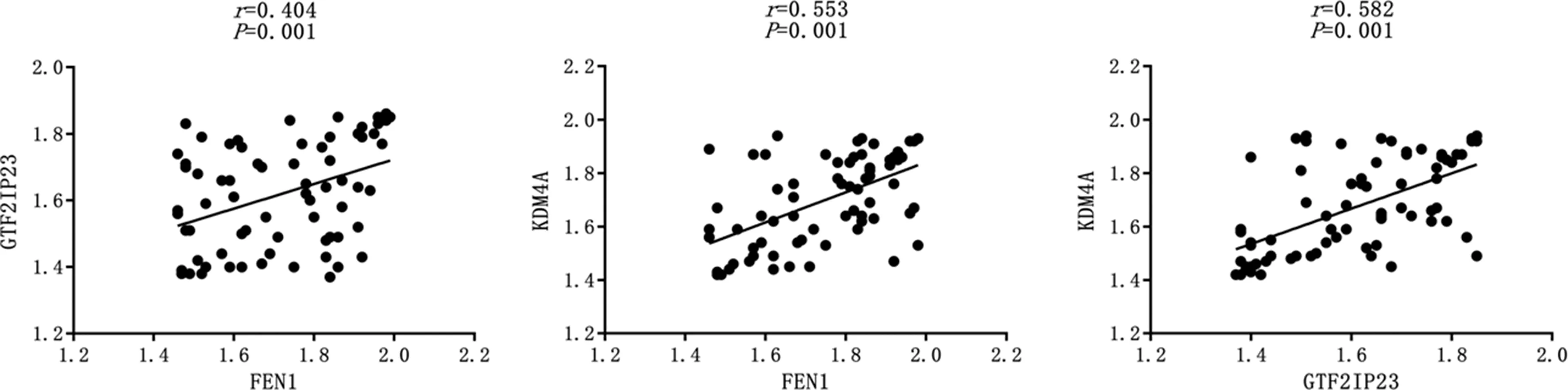
图4 乳腺癌组织中FEN1、GTF2IP23、KDM4A表达相关性
2.4FEN1、GTF2IP23、KDM4A对乳腺癌患者预后的预测价值 与单项检测相比,3项联合检测的灵敏度提高,特异度轻微降低,但曲线下面积(AUC)为0.899,大于FEN1、GTF2IP23、KDM4A单项诊断(0.691、0.659、0.708),差异有统计学意义(P<0.05),见表3、图5。

表3 FEN1、GTF2IP23、KDM4A对乳腺癌患者预后的预测价值

图5 FEN1、GTF2IP23、KDM4A对乳腺癌患者预后的预测价值ROC曲线图
3 讨 论
乳腺癌多发生在机体乳腺上皮组织中,而在人体生命活动中,乳腺组织的作用并不十分重要,因此乳腺组织切除对乳腺癌的治疗效果比较理想[8-10]。乳腺癌患者若不及时治疗,病情发展至晚期,癌细胞向全身扩散,会对患者生命造成威胁。乳腺癌的发病机制有多种,包括遗传因素、基因突变、机体免疫功能下降、神经功能异常等,其中基因突变是乳腺癌发病的最主要因素,且肿瘤形成是一个涉及多基因、多步骤、长期的复杂过程,多种因素相互影响。因此许多专家学者通过分子生物学、病理研究等研究途径对乳腺癌发病机制、诊疗靶点进行研究,对乳腺癌的诊治进行不断探索[11-13]。
FEN1是一种金属核酸酶,具有结构特异性的特点,并且具有核酸外切酶、缺口核酸内切酶活性,能维持基因组完整、稳定。有研究指出,FEN1功能丧失将会导致慢性炎症疾病及自身免疫疾病的诱发,并且在癌组织发展进程中起重要作用[14]。有研究表示,FEN1在口腔癌、肝癌、卵巢癌等恶性肿瘤中有着异常的表达,其变化与癌细胞增殖能力变化相关,但其在乳腺癌组织中的研究还相对较少[15-16]。本研究显示,相比癌旁组织、良性肿瘤组织,乳腺癌组织中FEN1表达相对较高,且随着乳腺癌组织癌变程度的加深,FEN1表达也逐渐升高,因此本研究认为FEN1在乳腺癌中高表达,可能参与乳腺癌的进展。本研究发现,处于恰当水平上的FEN1可通过DNA修复及抑制乳腺癌的基因突变,以保持基因组的稳定性。另外过表达的FEN1与ER结合影响了雌激素应答基因的表达,从而加速了乳腺癌进程。说明FEN1表达变化与乳腺癌患者病理特征、病情严重程度密切相关,由此可以推测出FEN1可能作为乳腺癌诊断、治疗的靶点应用于临床。
GTF2IP23为GTF2I家族的重要组成成员,GTF2IP23在细胞分化、生长等生物学行为上有重要作用。有研究表示,GTF2IP23能够激活PI3K/AKT/MAPK通路,促进癌细胞的不断增殖分化与侵袭,在恶性肿瘤的发生发展过程中具有重要作用[17-18]。GTF2IP23在肺癌、结肠癌、胃癌等多种恶性肿瘤中均异常表达。本研究显示,相比癌旁组织、良性肿瘤组织,乳腺癌组织中GTF2IP23表达相对较高,且随着乳腺癌组织癌变程度的加深,癌组织中GTF2IP23表达也逐渐升高。GTF2IP23属于GTF2I的假基因,在乳腺癌中的表达最为显著,而假基因通过抑制其母基因的表达,调控靶基因,促使乳腺组织癌变;并通过RNA结合蛋白或其他翻译相关机制调控RNA表达或蛋白翻译,致使蛋白变性、癌细胞增殖,加重乳腺癌病变程度。因此本研究推测GTF2IP23可能为乳腺癌发展演进的重要靶点,检测GTF2IP23表达对乳腺癌诊断、治疗具有重要意义。
KDM4A是KDM4家族的一种重要的去甲基酶,具有一定的调控基因转录的作用[19]。有研究表示,KDM4A在结直肠癌、宫颈癌等多种恶性肿瘤中呈异常表达,其异常高表达具有促进癌细胞增殖、分化、迁移的作用,在恶性肿瘤发生发展过程中具有重要作用[20-21]。本研究说明,KDM4A在乳腺癌组织中呈高表达,且随着乳腺癌组织癌变程度的加深,癌组织中KDM4A表达也逐渐升高。KDM4A具有蛋白结合和去甲基酶活性两种功能,可以与抑癌基因启动子结合,负性调控癌症因子转录,发挥抑癌功能,此时KDM4A升高,导致特异性蛋白1基因沉默,促使肿瘤转移。KDM4A表达变化与乳腺癌病理特征具有密切联系,因此本研究推测KDM4A可能为调控乳腺癌进展的重要分子。
本研究还发现,FEN1、GTF2IP23、KDM4A在乳腺癌组织中表达呈正相关,三者联合检测对乳腺癌患者预后预测的灵敏度提高,特异度降低,说明三者可能共同参与乳腺癌的发展演进过程,与乳腺癌疾病相关,且认为三者线性相关,推测三者可能由于共同作用而诱导疾病的发生,对乳腺癌患者预后具有较高的预测价值。
综上所述,FEN1、GTF2IP23、KDM4A在乳腺癌组织中均呈异常高表达,与乳腺癌患者病理特征密切相关,且三者表达具有一定相关性,FEN1、GTF2IP23、KDM4A水平三者联合检测对乳腺癌患者预后具有较高的预测价值,但本文样本例数较少,且并未分析三者之间相互作用的机制,研究存在一定的局限性,因此还需后续研究进一步分析。

