基于NF-κB/NLRP3通路的芍药苷对缺氧诱导视网膜Müller细胞的影响
孔令春,邹红,李景景,杨宇琴,唐慧新,缪晚虹
上海中医药大学附属曙光医院,上海 201203
视网膜缺氧性损伤可发生在多种视网膜血管性疾病中,如糖尿病视网膜病变、视网膜动静脉阻塞及年龄相关性黄斑病变等。缺氧可造成视网膜结构和功能损伤,特别是视网膜神经节细胞减少或死亡,导致视力不可逆性丧失。因此,保护视网膜缺氧损伤尤为重要。目前,有关视网膜缺氧造成组织破坏的机制研究较多,包括氧化应激损伤、谷氨酸兴奋毒性损伤、凋亡基因表达、神经免疫调节、炎症损伤、病理性血管新生等[1-2]。缺氧可导致血管内皮生长因子(VEGF)表达增加,从而增加视网膜血管渗透性,引起视网膜水肿[3]。研究发现,视网膜缺氧损伤过程伴有炎症因子释放[4],NLRP3炎症小体作为固有免疫系统的重要组成部分,通过感知组织损伤、介导炎症反应等参与多种眼部疾病的发生发展[5]。研究显示,激活NLRP3炎症小体既可促进VEGF生成[6],也可促进多种炎症因子释放[7]。
芍药苷是赤芍和白芍的共有成分,具有抗自由基损伤、抑制炎症、抗纤维化、神经保护等作用[8-9]。研究发现,芍药苷可通过抑制NLRP3炎症小体延缓视网膜缺血性损伤大鼠视网膜神经节细胞凋亡[10]。Müller细胞作为视网膜细胞的主要大型特化的星形胶质细胞,参与血-视网膜屏障的形成,在视网膜损伤过程中起重要作用。有研究表明,芍药苷可通过降低大鼠血糖及抑制胶质细胞活化,降低视网膜谷氨酸含量,保护视网膜Müller细胞[11]。但芍药苷是否能通过抑制VEGF产生和炎症发挥对视网膜Müller细胞的保护作用尚不清楚。基于此,本研究通过诱导大鼠视网膜Müller细胞rMC-1缺氧模型,观察芍药苷的保护作用及对NF-κB/NLRP3通路相关基因和蛋白表达的影响,为芍药苷治疗视网膜血管性疾病提供依据。
1 实验材料
1.1 细胞及药物
大鼠视网膜Müller细胞rMC-1,美国Kerafast公司。芍药苷,美国Selleck公司,批号S241006。将芍药苷粉末溶于二甲基亚砜,制成0.5 mol/L贮备液,-20 ℃避光保存,临用前用培养基稀释成所需浓度。
1.2 主要试剂与仪器
DMEM培养基,美国Gibco公司,批号2366072;胎牛血清(FBS),美国Gibco公司,批号2021472;CCK8试剂盒,日本DOJINDO公司,批号CK04;白细胞介素(IL)-1β、VEGF ELISA试剂盒,上海司鼎生物科技有限公司,批号分别为SDR0004、SDR0041;Trizol RNA提取试剂,美国Invitrogen公司,批号15596018;qPCR试剂盒,日本TAKARA,批号RR420A;BCA蛋白定量试剂盒,上海司鼎生物科技有限公司,批号SD0012;兔核因子(NF)-κB p65单克隆抗体,美国CST公司,批号#8242;NLRP3抗体、半胱氨酸蛋白酶-1前体(pro-Caspase-1)+p10+p12单克隆抗体、凋亡相关斑点样蛋白(ASC)抗体,英国Abcam公司,批号分别为ab263899、ab179515、ab180799;β-actin抗体,上海司鼎生物科技有限公司,批号SD0034。
CO2培养箱(日本SANYO公司,型号MCO-15AC),三气培养箱(中国华仪宁创公司,型号Smartor 118),倒置显微镜(日本OLYMPUS公司,型号CX41),qPCR仪(瑞士Roche公司,型号LightCycler®480II),SDS-PAGE微型凝胶电泳及转膜设备(美国Bio-Rad公司,型号1645050),低温高速离心机(德国Eppendorf公司,型号5810R),酶标仪(美国Thermo公司,型号Multiskan FC)。
2 实验方法
2.1 细胞培养
rMC-1细胞用含10% FBS、1%青链霉素的DMEM培养基,置37 ℃、5%CO2培养箱培养,1~2 d换液1次,细胞生长融合至85%时,使用0.25%胰蛋白酶消化细胞,用完全培养基终止消化后,以1∶3比例传代,取对数生长期的3~6代细胞用于实验。
2.2 造模及给药条件筛选
将细胞以1×105个/孔接种至96孔板,每孔100 μL,置于37 ℃、5%CO2培养箱常规培养24 h后,转移至缺氧培养箱(1%O2)缺氧处理6、24、48 h,另设对照组正常培养相同时间,每组6个复孔,CCK8法检测细胞活力,确定造模条件。
确定造模条件后,将细胞分为对照组、模型组和不同浓度芍药苷组,对照组正常培养,模型组缺氧培养48 h,芍药苷组造模同时加入终浓度分别为0、10、100、200、600、1 200 μmol/L的芍药苷处理细胞,CCK8法检测细胞活力,确定芍药苷给药浓度。
2.3 分组干预
将细胞分为对照组、模型组和芍药苷高、低浓度组,根据确定的造模和给药条件对照组正常培养,模型组缺氧培养48 h,芍药苷高、低浓度组缺氧培养同时加入1 200、600 μmol/L芍药苷处理,干预结束后收集细胞和上清液进行后续检测。
2.4 CCK8法检测
细胞按分组处理后,每孔加入CCK8溶液10 μL,置于培养箱孵育3 h,酶标仪波长450 nm处检测各孔OD值,计算细胞活力(实验组OD值÷对照组OD值×100%)。
2.5 ELISA检测
收集细胞上清液,按试剂盒说明书操作,检测VEGF、IL-1β含量。
2.6 Western blot检测
收集细胞,按蛋白抽提试剂盒说明书提取总蛋白,BCA试剂盒测定蛋白浓度,取20 μg蛋白进行凝胶电泳,转膜后分别加入NF-κB p65一抗(1∶1 000)、NLRP3一抗(1∶1 000)、ASC一抗(1∶2 000)、pro-Caspase-1一抗(1∶1 000),4 ℃孵育过夜;TBST洗膜3次,加入HRP标记二抗(1∶20 000),37 ℃孵育1 h,显影后用Image J 1.8.0软件分析目的蛋白灰度值,以目的蛋白与内参蛋白(β-actin)灰度值比值作为蛋白相对表达量。
2.7 RT-PCR检测
收集细胞,Trizol提取总RNA,测定RNA浓度和纯度,反转录试剂盒将RNA反转录为cDNA,按照qPCR 试剂盒说明书进行 IL-1β、VEGF、NF-κB、NLRP3、ASC、Caspase-1 mRNA扩增。反应体系:cDNA 1 μL,上、下游引物各 1 μL,2×Green Mix 10 μL,去离子水 7 μL;反应条件:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,共40个循环。以GAPDH为内参,2-ΔΔCt法计算mRNA相对表达量。引物由上海司鼎生物科技有限公司合成,引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
4 结果
4.1 实验条件建立
CCK8实验结果显示,与对照组比较,缺氧培养6、24 h,rMC-1细胞活力差异无统计学意义(P>0.05),缺氧培养48 h,rMC-1细胞活力显著降低(P<0.001),见图1。故后续实验选择缺氧培养48 h为造模条件。

图1 缺氧不同时间对rMC-1细胞活力的影响(,n=6)
不同浓度芍药苷处理细胞后,与模型组比较,0~200 μmol/L芍药苷对细胞活力无显著影响(P>0.05),600、1 200 μmol/L芍药苷可显著提高rMC-1细胞活力(P<0.05,P<0.01),见表2。故选择芍药苷浓度600和1 200 μmol/L用于后续实验。
表2 不同浓度芍药苷对rMC-1细胞活力的影响(,%)

表2 不同浓度芍药苷对rMC-1细胞活力的影响(,%)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01
浓度/(μmol/L) 细胞活力100 77.48±13.86*77.14± 9.93 81.13±10.10 84.55± 8.93 83.66±13.06 89.84±11.45#98.59±10.34##组别对照组模型组芍药苷组0 10 100 200 600 1 200 n 6 6 6 6 6 6 6 6
4.2 芍药苷对模型细胞上清液血管内皮生长因子和白细胞介素-1β含量的影响
与对照组比较,模型组细胞上清液VEGF、IL-1β含量显著增加(P<0.01,P<0.001);与模型组比较,芍药苷低、高浓度组细胞上清液VEGF、IL-1β含量显著减少(P<0.01,P<0.001)。见图2。

图2 各组rMC-1细胞VEGF、IL-1β含量比较(,n=3)
4.3 芍药苷对模型细胞NF-κB/NLRP3通路相关蛋白表达的影响
与对照组比较,模型组细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1蛋白表达显著升高(P<0.05,P<0.01,P<0.001);与模型组比较,芍药苷高浓度组细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1蛋白表达显著降低(P<0.01,P<0.001)。见图3、表3。
表3 各组rMC-1细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1蛋白表达比较()
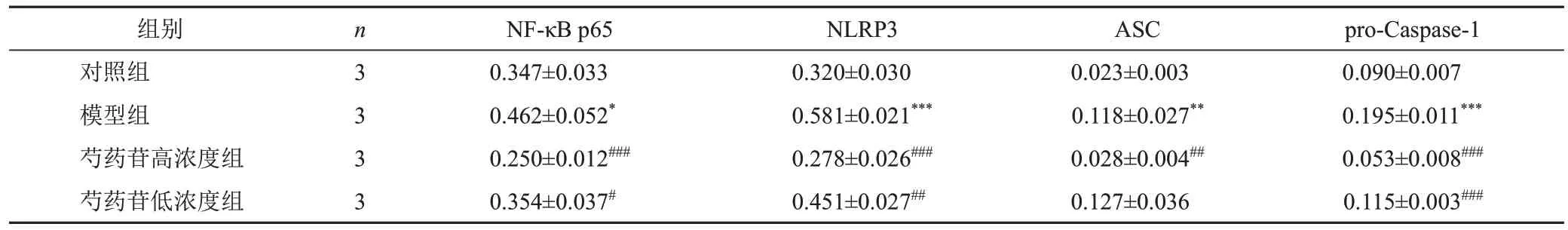
表3 各组rMC-1细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1蛋白表达比较()
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001
pro-Caspase-1 0.090±0.007 0.195±0.011***0.053±0.008###0.115±0.003###组别对照组模型组芍药苷高浓度组芍药苷低浓度组n 3 3 3 3 NF-κB p65 0.347±0.033 0.462±0.052*0.250±0.012###0.354±0.037#NLRP3 0.320±0.030 0.581±0.021***0.278±0.026###0.451±0.027##ASC 0.023±0.003 0.118±0.027**0.028±0.004##0.127±0.036

图3 各组rMC-1细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1蛋白免疫印迹
4.4 芍药苷对模型细胞白细胞介素-1β、血管内皮生长因子和NF-κB/NLRP3通路相关基因表达的影响
与对照组比较,模型组细胞IL-1β、VEGF、NF-κB、NLRP3、ASC、Caspase-1基因表达显著升高,差异有统计学意义(P<0.001);与模型组比较,芍药苷高浓度 组 细胞 IL-1β、VEGF、NF-κB、 NLRP3、 ASC、Caspase-1基因表达显著降低,差异有统计学意义(P<0.01,P<0.001)。见表4。
表4 各组rMC-1细胞IL-1β、VEGF、NF-κB、NLRP3、ASC、Caspase-1 基因表达比较()

表4 各组rMC-1细胞IL-1β、VEGF、NF-κB、NLRP3、ASC、Caspase-1 基因表达比较()
注:与对照组比较,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001
Caspase-1 1.013±0.202 2.752±0.250***1.454±0.125###2.096±0.188#组别对照组模型组芍药苷高浓度组芍药苷低浓度组n 3 3 3 3 IL-1β 1.004±0.114 9.938±2.693***1.070±0.323###2.347±0.602###VEGF 1.001±0.073 5.352±0.097***0.545±0.073###1.275±0.066###NF-κB 1.000±0.024 2.235±0.261***1.609±0.227##1.787±0.076#NLRP3 1.034±0.338 7.005±0.708***3.331±0.605###5.903±0.315 ASC 1.003±0.103 1.641±0.080***1.004±0.071###1.265±0.091##
5 讨论
Müller细胞自内界膜贯穿整个视网膜到达外界膜,是视网膜内最主要的神经胶质细胞,占视网膜胶质细胞的90%。它能维持视网膜组织及结构的完整,并参与神经元营养运输,在维持渗透压稳定、调节突触发育、维持电解质平衡及调节血-视网膜屏障等方面有至关重要的作用[12]。Müller细胞参与多种视网膜疾病[13],是许多生长因子和炎症因子产生的重要来源[14-15]。视网膜缺氧引起一系列应激反应,使Müller细胞激活,异常分泌VEGF,导致视网膜血管内皮细胞损伤,增加血管通透性,使毛细血管闭塞,进而加重视网膜缺血缺氧和促进新生血管生成[16]。此外,炎症在缺血缺氧性视网膜疾病中的作用近年来受到广泛关注。缺氧和视网膜炎症密切相关[16-17],当视网膜受到缺氧刺激时,Müller细胞活化,表现为反应性胶质激活,分泌大量炎症细胞因子和趋化因子,如IL-1β、IL-6、肿瘤坏死因子(TNF)-α等参与视网膜局部炎症发展[18]。本研究选用Müller细胞rMC-1为研究对象,用缺氧培养方式模拟人体视网膜缺氧,发现缺氧培养48 h后,细胞活力明显受到抑制,ELISA和PCR结果显示,缺氧培养后,模型组rMC-1细胞分泌VEGF、IL-1β较对照组显著增加,而芍药苷高、低浓度组细胞IL-1β、VEGF较模型组减少,且相应基因表达显著降低,表明芍药苷对缺氧诱导的rMC-1细胞VEGF、IL-1β分泌有抑制作用。
NLRP3炎症小体作为固有免疫系统的重要组成部分,是由核苷酸结合寡聚域样受体蛋白3(NLRP3)、ASC和pro-Caspase-1组成的多蛋白复合物[19]。NLRP3炎症小体活化包括启动和激活2个步骤,启动阶段由Toll样受体或细胞因子受体诱导,它们识别病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),使NF-κB活化,促进NLRP3、pro-IL-1β和pro-IL-18转录和翻译,PAMPs和DAMPs则促进NLRP3、ASC及pro-Caspase-1相结合,形成炎症小体,活化Caspase-1,活化的Caspase-1将pro-IL-1β和pro-IL-18剪切为成熟形式,从而诱导下游炎症反应,加重视网膜局部炎症[20]。
研究发现,抑制NLRP3炎症信号通路可改善VEGF诱导的视网膜血管新生和渗漏[21];激活的NLRP3炎症小体通过上调HIF-1α/VEGF轴促进人视网膜毛细血管内皮细胞VEGF分泌[6];缺氧可诱导人视网膜色素上皮细胞NLRP3炎症小体启动和激活,促进VEGF基因表达和分泌[22]。也有研究指出,高糖诱导能显著提高人视网膜色素上皮细胞TNF-α、IL-1β、IL-6水平,且与高糖活化NF-κB和激活NLRP3炎症小体有关[23]。Zhang等[7]发现,慢性高眼压大鼠NLRP3炎症小体激活同时,TNF-α、IL-6、IL-1β及IL-18等促炎因子含量增加。可见,在视网膜病变中,NLRP3炎症小体与VEGF表达关系密切。
芍药苷为水溶性单萜糖苷,具有镇静、护肝、抗炎和调节免疫等多种作用[24]。芍药苷的抗炎作用研究尤为广泛,包括类风湿关节炎[25]、神经炎症[26]、糖尿病足溃疡[27]等。本研究结果显示,芍药苷能降低缺氧rMC-1细胞NF-κB p65、NLRP3、ASC、pro-Caspase-1基因及蛋白表达,提示其可能通过抑制NF-κB/NLRP3通路,抑制NLRP3炎症小体激活,进而抑制视网膜炎症反应。
综上所述,芍药苷可能通过抑制NF-κB/NLRP3通路下调细胞因子VEGF、IL-1β表达,减轻缺氧诱导的视网膜Müller细胞损伤。但其与该通路的具体结合方式及其他作用途径尚不清楚,有待后期进一步深入探究。本研究结果可为缺氧性视网膜血管疾病的防治提供一定参考。

