不同浓度PMSG和HCG组合对家兔超数排卵的影响
周 娜,铁雅楠,杨雅楠,王欣荣
(甘肃农业大学动物科学技术学院,兰州 730070)
0 引言
哺乳动物在发育前期,卵巢上的卵母细胞被单层扁平前体颗粒细胞包围后形成了原始卵泡,出生后其原始卵泡总和高达上百万个[1];但随着动物生长发育,只有不到1%的原始卵泡发育为成熟卵泡并释放卵子,其余99%的原始卵泡将退化、凋亡,这种现象被称为卵泡闭锁[2]。卵泡闭锁是一种为了维持卵泡内环境稳态、控制排卵周期内排卵数目以及选择优质卵子等功能的正常生理现象[3-4]。随着胚胎生物工程技术的发展,研究者可以通过超数排卵获得更多的可用卵子或胚胎[5]。超数排卵是指选择哺乳动物适当的生理阶段,使用各种外源性促性腺激素刺激卵巢,使之比正常情况下有更多的卵泡同时发育,并能够排出具有受精能力卵子的技术,简称“超排”[6]。除激素的种类、浓度影响超排效果外,试验动物的体况、年龄、品种、气候、季节及饲养条件也影响着超排效果[7-8]。本试验旨在研究不同浓度孕马血清促性腺激素(Pregnant Mare Serum Gonadotropin,PMSG)和人绒毛膜促性腺激素(Human Chorionic Gonadotrophin,HCG)的组合对家兔超排效果的影响,以筛选出试验范围内的最佳激素组合浓度,为家兔及其他哺乳动物通过超排获得更多优质可用胚胎、提高繁殖力、养殖生产效率等提供参考依据。
1 材料与方法
1.1 试验动物
2020年6—8月在甘肃靖远某肉兔养殖场挑选若干品种纯正、体格健壮的5月龄性成熟母兔,将其饲养在甘肃农业大学动物场,以消毒清洁的饲养舍单笼饲养,自然光照、自由饮水,使用优质苜蓿颗粒饲料每天定时定量饲喂,约7天后进行药物处理和试验。
1.2 试验药械
PMSG和HCG(宁波第二激素厂,兽药GMP证字11004号,1000 IU)、生理盐水、冲胚液、M199培养基、M23冲洗液、1 mL注射器、5 mL注射器、头皮针、5 mL离心管、培养皿、显微镜、超净台、10~100µL移液枪、细胞培养箱等。
1.3 试验方法
1.3.1 试验分组 从试验动物中随机挑选24只,每组6只,分别设计为Ⅰ、Ⅱ、Ⅲ和Ⅳ共4组。其中Ⅰ组为对照组,不做任何激素处理,试验开始后72 h合笼交配,交配后14~16 h处死动物并采集卵巢、输卵管和子宫,从子宫角和输卵管中冲洗出胚胎并对其进行鉴定和培养。其余3组为试验组Ⅱ、Ⅲ和Ⅳ,在试验开始第1天分别颈部皮下注射50、70 IU和90 IU的PMSG,继续饲喂72 h后再分别耳缘静脉注射100 IU的HCG,注射后与公兔合笼使其完成交配,并在合笼14~16 h后处死动物进行冲胚、鉴定及培养。
1.3.2 合笼要求 合笼前通过外阴观察法对母兔进行发情鉴定,确定母兔发情后与公兔1:1合笼,发现交配成功后分离公母兔单笼饲养,若出现互相撕咬或母兔尾巴湿润的情况复配一次,确保交配成功。
1.3.3 样本采集 用耳缘静脉注射空气法处死试验动物并解剖,完整分离出输卵管、子宫。将卵巢与输卵管分离后观察并测量卵巢的排卵点、充血卵泡等物理数据。冲胚操作时,手持连有子宫角的输卵管,将培养皿悬空接在输卵管伞部,再用已吸取5 mL冲卵液的注射器刺入子宫角与输卵管连接处,并将止血钳固定在针头后方,缓慢推动注射器,使冲卵液从输卵管伞部滴入培养皿,从而冲出胚胎。具体操作时要注意动作轻柔缓慢,避免冲卵液滴在培养皿边缘及外面,可能会导致胚胎的遗失。
1.3.4 胚胎鉴定 将胚胎放在倒置显微镜下进行观察和鉴定,根据胚胎整体形态、卵裂情况和碎片化程度进行鉴定。将所得胚胎分成4个等级:A级胚胎卵裂球大小均匀整齐,结构紧凑,整体形态完整轮廓清晰,呈球形;B级胚胎与A级相比卵裂球大小、形状、密度存在一定的不规则性,整体轮廓清晰,色调透明度适中,可见少量液泡;C级胚胎卵裂球大小、密度不均,结构松散凌乱,整体轮廓不清晰,色调发暗,游离液泡或细胞较多;D级碎片化严重、模糊不清、胚胎发暗、破碎甚至死亡[9-10]。A、B和C级胚胎统称为可用胚胎,其中A、B级胚胎可用于鲜胚移植或冷冻,C级胚胎只可用于鲜胚移植,而D级为不可用胚胎[11]。
1.4 数据统计与分析
使用SPSS 23.0软件处理所得数据,各组数据进行单因素方差分析及多重比较。其中P<0.01表明组间差异极显著,P<0.05表明组间差异显著,P>0.05表明组间差异不显著。
2 结果与分析
2.1 不同浓度PMSG超排处理对家兔输卵管物理形态的影响
由表1可见,使用不同浓度的PMSG,家兔输卵管形态表现出一定的变化。当PMSG注射剂量为90 IU时,输卵管长度是123.24 mm,输卵管峡部的宽度是2.11 mm,宫管结合部的宽度是2.53 mm;而当注射剂量为50 IU时,输卵管伞部的宽度是2.88 mm。但无论是与对照组相比,还是不同处理间比较,各组数值均未表现出显著差异(P>0.05)。
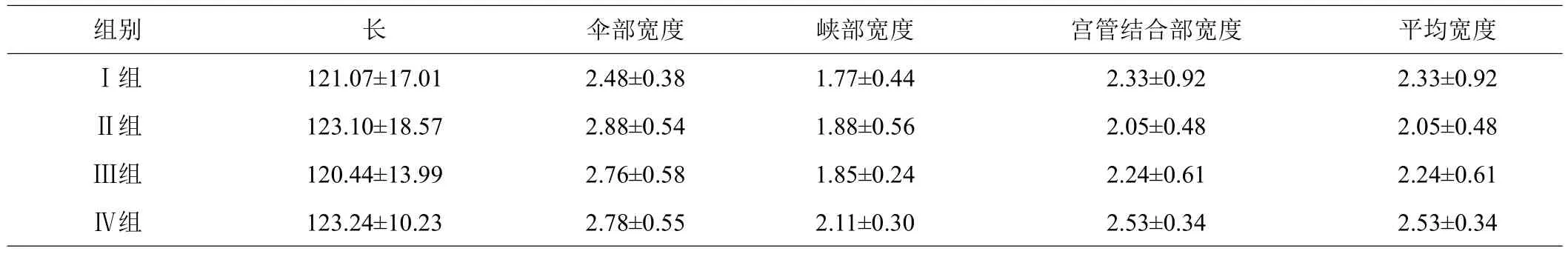
表1 不同浓度PMSG/HCG对输卵管物理形态的影响 mm
2.2 不同浓度PMSG对家兔超数排卵效果的影响
由表2可知,随着PMSG处理浓度的增加,家兔卵巢上的只均充血卵泡数呈现出增多的趋势,且差异极显著(P<0.01)。与对照组相比,注射50、70 IU和90 IU PMSG后的卵巢充血卵泡数分别增加了27.03%、91.46%、181.10%。随着PMSG浓度的增加,家兔只均排卵点和冲出胚胎数呈现出先增多后又降低的趋势,且组间差异极显著(P<0.01)。特别当注射70 IU的PMSG时,只均排卵点和冲出胚胎数最多,分别达到29.00个和21.83枚,且极显著高于对照组(P<0.01)。与对照组相比,Ⅱ、Ⅲ和Ⅳ组的只均排卵点增多率分别为66.67%、329.63%、234.52%,只均胚胎数增多率分别为62.86%、322.24%、230.37%。
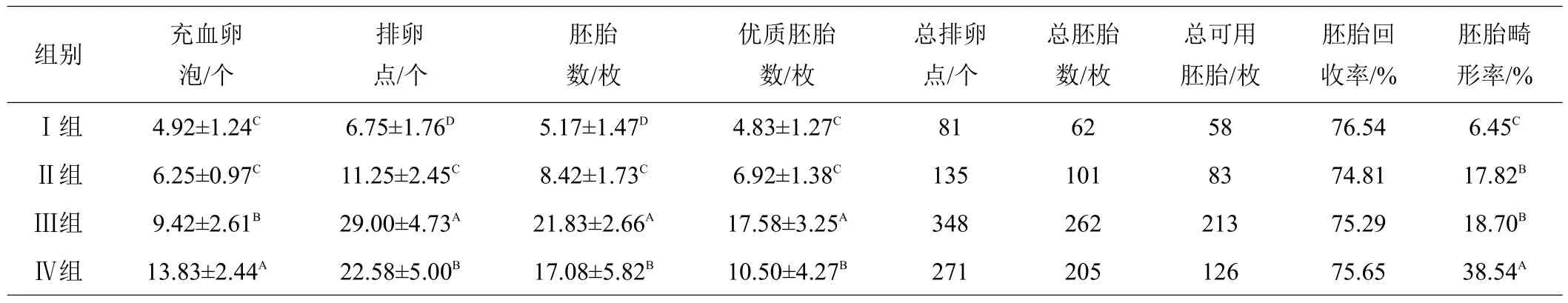
表2 不同浓度PMSG/HCG处理后对家兔超数排卵效果的影响
2.3 不同浓度PMSG处理对胚胎质量的影响
由图1A可知,与对照组相比,试验组的胚胎回收率有所降低,且随激素浓度的增大回收率上升,但差异不显著(P>0.05)。由图1B可知,各组获得的总可用胚分别为58、83、213、126枚,随激素浓度的增大,总可用胚呈先增大后降低的趋势,且差异极显著(P<0.01),特别是III组获得了最多的总可用胚,总计213枚。由图1C可知,各组胚胎畸形率分别为6.45%、17.82%、18.70%和38.54%,随PMSG注射浓度的增大,呈上升趋势且差异极显著(P<0.01),与对照组相比,畸形率分别增加了11.37%、12.25%、32.09%。
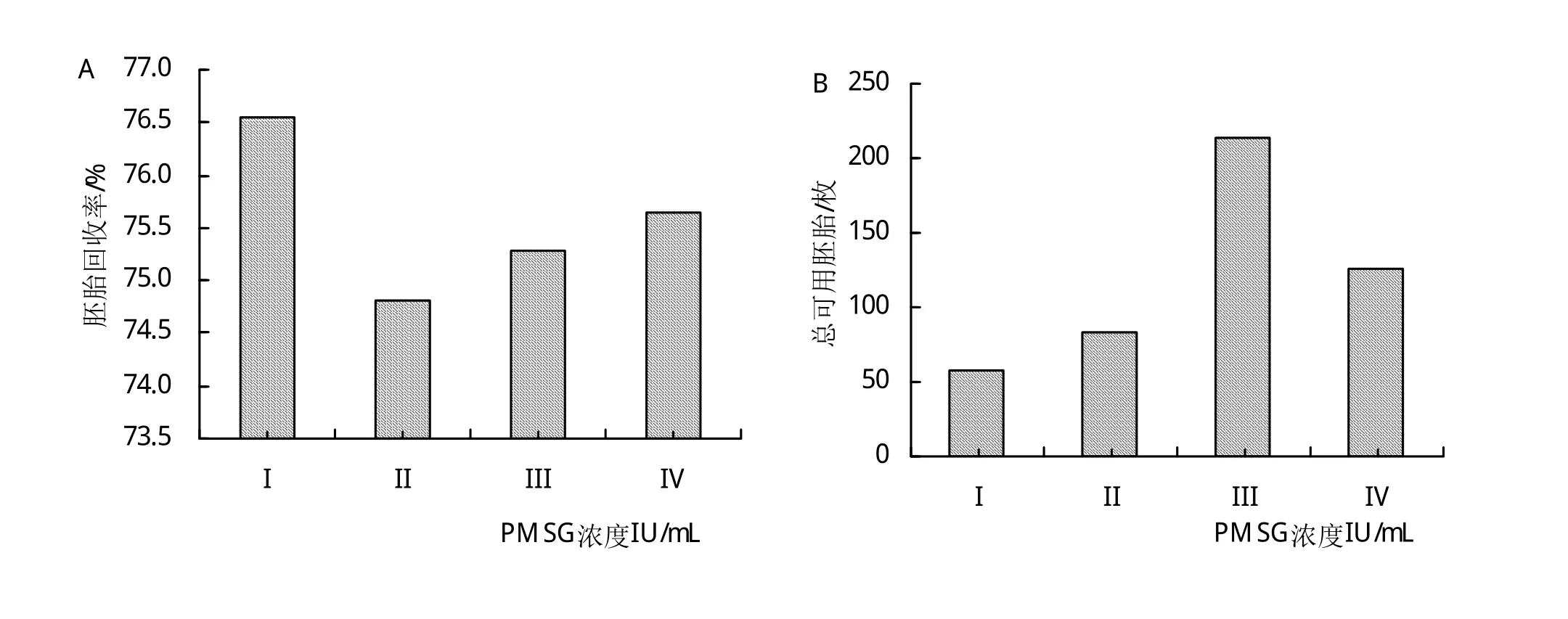
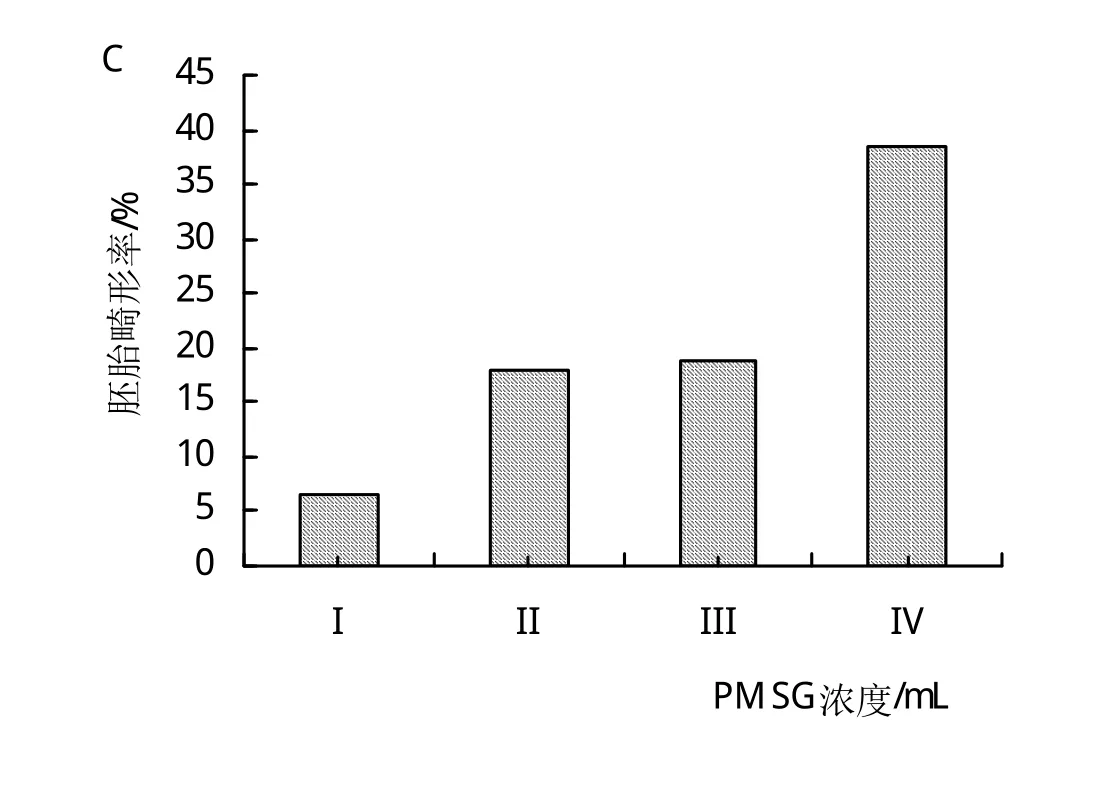
图1 不同浓度PMSG对家兔胚胎的影响
3 讨论
研究认为,多种生殖激素如PMSG、HCG、促卵泡素 (Follicle-stimulating Hormone,FSH)、 孕 酮(Progesterone,P4、雌二醇(Estradiol,E2)、促黄体激素(Luteinizing Hormone,LH)、前 列腺素(prostaglandin,PG)等均可以用于动物超排,但各激素之间通过相互协同和制约共同发挥生理学效应[12],因此用于家畜超排时,多以激素组合的形式进行,常见的组合有PMSG+HCG的组合及FSH+HCG的组合[13]。HCG是胎盘膜组织中合体滋养层细胞分泌的糖蛋白,生物学活性主要为LH,FSH的活性很小[14]。FSH主要是促进卵泡的生长和发育,而PMSG是由孕马的子宫内膜杯分泌的一种糖蛋白激素,同时具有FSH和LH的生物学功能[15]。PMSG价格便宜容易获取,但半衰期较长,代谢困难,过量使用会增加母畜患卵巢疾病的风险,不足则起不到相应的作用,所以在使用时要控制最佳剂量[16]。本试验使用相同剂量的HCG和不同浓度的PMSG作为超排激素组合,以研究家兔输卵管的变化状况,并从整体超排效果和胚胎质量方面来筛选各组合中的效果最佳者。
3.1 不同浓度PMSG对家兔输卵管物理形态的影响
谭景和等[17]的研究发现,超排处理对输卵管伞部大小无明显影响。而关于生殖激素对母畜输卵管长度和宽度影响的研究却鲜有报道,本研究中试验动物均为体重、体况相当的同月龄健康伊拉肉兔。试验结果表明,与对照组的输卵管长度、宽度相比较,各试验组并没有显著差异性变化,该结果也与樊宝仁等[18]的研究结果吻合。说明在本试验设计的激素浓度范围内,PMSG浓度的变化对输卵管长度和宽度没有显著影响。
3.2 不同浓度PMSG对家兔超排效果和胚胎质量的影响
超数排卵作为提高母畜繁殖力和获得胚胎的重要途径之一,受多重因素的影响,如超排方法、超排激素、光照、饲养条件、供体母畜所处发情阶段等[19-20]。虽然超排可以获得更多的胚胎,但通过外源激素的刺激获得的胚胎质量需要进行科学的评估。在本试验中发现,随着激素浓度的增大,胚胎的畸形率也逐步上升。特别在90 IU的PMSG处理时不仅排卵点降低,而且胚胎的畸形率增大,导致总可用胚数少。因此从胚胎质量的角度分析,当使用PMSG+HCG组合对家兔进行超数排卵,HCG的剂量为100 IU时,PMSG也不宜超过70 IU。超排所得的卵子是母畜卵巢上的卵母细胞受外源性激素和母畜原有激素共同协同调节下形成的,因此卵子质量也与超排所用的外源性激素有关,所以超排后胚胎质量下降很有可能是受超排激素的影响。有研究表明,超数排卵可以刺激大量的卵泡发育,使之在发育过程中对营养、空间的竞争致使黄体质量下降,从而影响所得胚胎回收率及质量[21]。王改兰[22]在用FSH对羊进行超排试验时发现,随FSH浓度的增大,胚胎畸形率逐步上升。但在林峰等[23]用PMSG对家兔进行超排的试验中,发现激素浓度对胚胎发育无影响,但其使用的PMSG和HCG分别为50 IUPMSG和PMSG+HCG为50+50的组合,因此分析可能是激素浓度还未达到导致其胚胎出现畸形的阈值所致。
4 结论
研究表明,用HCG定量为100 IU、PMSG为50~90 IU浓度范围的超排方案处理家兔时,对其输卵管的长和宽无显著作用;PMSG+HCG组合可以有效促进家兔超排,特别是70 IU PMSG+100 IU HCG的组合可取得较好的超排效果;当PMSG浓度为90 IU时,会诱导胚胎畸形率增高,影响胚胎质量,故建议在生产中谨慎使用。

