食物过敏与炎症性肠道疾病关联性的研究进展
陈碧华,吴雨泓,吴 欢,孟轩夷,陈红兵
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学 江西省食物过敏重点实验室,江西 南昌 330047;4.南昌大学中德联合研究院,江西 南昌 330047)
食物过敏是暴露于某种食物后反复发生的、由特定免疫反应引起的不良反应,已成为全球性食品安全问题之一[1]。随着科研工作者对食物过敏认识的深入,发现胃肠道疾病可通过改变肠道通透性以及黏膜屏障免疫系统促进食物过敏的发生[2-3]。目前,发病率日益增长的炎症性肠道疾病(inflammatory bowel disease,IBD)已逐渐进入人们的视野。IBD是一种发病机制仍不清楚的慢性肠道炎症性疾病,包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),而食物过敏是对摄入食物的免疫和临床耐受被打破导致免疫球蛋白(immunoglobulin,Ig)E和/或非IgE介导的过敏性疾病[4-5]。尽管食物过敏与IBD是两种不同的疾病,但两者却具有许多方面的相似之处,包括临床症状、流行病学、病理机制甚至一些临床治疗方法。因此,本文在阐述食物过敏与IBD发病率和临床症状相似性的基础上,重点讨论两者在发病机制上的关联性,最后概述针对IBD患者未来缓解或避免食物过敏的方法以及应对策略。
1 食物过敏与IBD发病率及临床症状的相似性
1.1 食物过敏与IBD发病率的相似性
近年来,全球食物过敏的发病率一直稳步上升,近30 年工业化/西方地区食物过敏发病率增加的速度尤为显著[5]。研究表明,世界范围内约有5%的成年人及8%的婴幼儿对食物过敏,但是食物过敏的发病率具有很大的国家和地区差异性[6]。例如,Prescott等[7]评估了横跨欧洲、亚洲/大洋洲、美洲、非洲和中东89 个国家的儿童食物过敏发病率,发现德国、意大利、瑞士、丹麦、中国和澳大利亚等国家儿童的发病率不足5%,而哥伦比亚和芬兰儿童的发病率则高达10%~15%,英国儿童的发病率甚至高达15%以上。同样,食物过敏的发病率在成年人中也出现地区差异性。Lyons等[8]对欧洲8 个城市人群进行问卷调查,发现成年人中食物过敏发病率最低为0.3%(雅典),最高可达5.6%(苏黎世)。
随着人们生活水平和卫生条件的提高,无论在发展中国家还是发达国家,IBD与食物过敏类似,其发病率出现升高的趋势,同样表现出国家和地区的差异性。近50 年来IBD在西方国家的发病率稳步上升,但在新兴工业化国家和发展中国家的发病率却增长迅速[4]。1990-2017年流行病学研究数据表明,全球IBD患者已从370万 人增加到680万 人(增加了85.1%),已然成为全球关注的另一健康问题[9]。
目前,多项研究均表明食物过敏与IBD的发病率不仅同步上升,而且互相促进增长。其中,IBD患者中食物过敏的发病率显著高于健康人群[2,10-13]。例如,Grzybowska-Chlebowczyk等[10]调查了95 名2~18 岁的IBD患者,发现32.5%的UC患者和21%的CD患者存在IgE依赖型食物过敏。Imanzadeh等[12]发现28 名IBD儿童中有60.7%的患者存在食物过敏,其中35.7%的患者对多种食物过敏。Johnson等[13]检测了29 例UC患者、37 例CD患者和100 例健康人员,对照血浆中食物过敏原(22 种)和吸入性过敏原(28 种)的特异性IgE,发现UC患者对食物过敏原和吸入过敏原的敏感率均较高,而CD患者则仅对吸入性过敏原的敏感率较高。同样,亦有食物过敏促进IBD发病率增加的相关报道,Virta等[14]对595 名IBD芬兰儿童进行回顾性调查,发现在婴儿期患有牛奶过敏的CD患者和UC患者数量分别是未曾患过牛奶过敏的1.92 倍和1.71 倍,其中以腹部症状为主要临床表现的牛奶过敏患儿感染CD的风险最高,此项调查说明婴幼儿早期食物过敏增加了日后患IBD的风险性。几年后,Virta等[15]继续对芬兰儿童(1999-2002年出生,n=225041)进行了食物过敏和IBD的调查,发现患有牛奶过敏的儿童更容易发生儿童IBD(牛奶过敏儿童和非牛奶过敏儿童发病比为2.6∶1),且患UC的风险比患CD更高,此外,与非牛奶过敏的儿童患IBD的年龄(12 岁)相比,牛奶过敏的儿童出现IBD的年龄(9 岁)更小。上述流行病学研究数据表明,食物过敏与IBD的发病率呈正相关,并互为促进影响。
1.2 食物过敏与IBD临床症状的相似性
食物过敏的临床症状表现多样,主要涉及胃肠道系统、皮肤系统和呼吸道系统(表1)[1],其中胃肠道系统症状尤为显著。虽然食物过敏的主要发生部位是小肠,而IBD的主要发生部位是结肠(CD发病部位最常见于末端回肠,而UC从盲肠近端延伸至不同部位),但是IBD与食物过敏具有许多相似的临床症状,如腹痛、腹泻(偶尔伴有黏液和排血)、全身虚弱、身体不适和吸收不良(呼吸困难、体质量减轻、贫血等)(表1)。有证据表明,食物过敏能引发IBD并出现肠道出血症状,尤其在婴儿中最为常见;此外,IBD患者也会出现皮肤损伤和呼吸道等典型的食物过敏症状[16]。可见,食物过敏与IBD临床症状不仅相似,还互相促进并同时出现。

表1 食物过敏和IBD的临床症状[17-20]Table 1 Clinical symptoms of food allergy and IBD[17-20]
2 食物过敏与IBD发病机制的关联性
食物过敏和IBD的发病机制都是环境因素、免疫和遗传相互作用的结果(图1),目前两者在环境因素、肠道微生物和免疫系统方面存在许多的关联性。
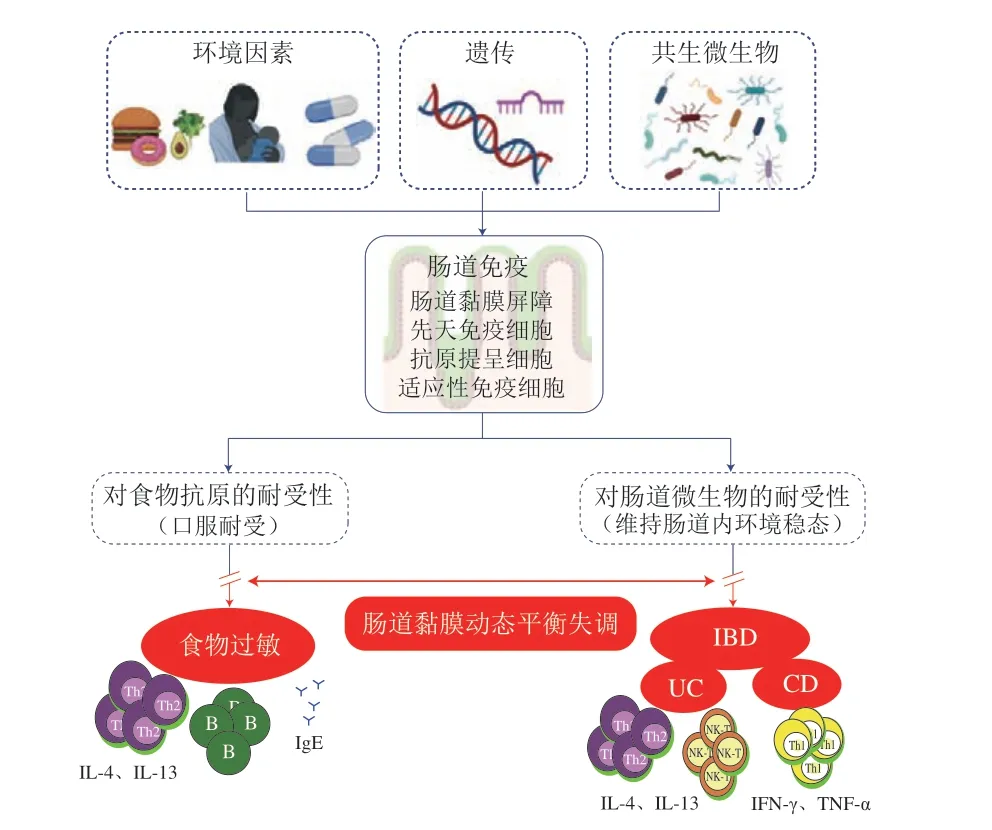
图1 食物过敏和IBD之间的联系[21]Fig.1 Relationship between food allergy and IBD[21]
2.1 环境因素
“卫生假说”是目前解释工业化国家自身免疫性疾病和过敏性疾病发病率上升的一种主要观点[22]。该观点认为,儿童早期感染的机会越少(如缺乏共生微生物和寄生虫的接触),机体免疫系统的自然发育则会受到抑制,导致免疫耐受性丧失,日后发展为自身免疫病和过敏性疾病的几率越高[23]。目前,自然分娩、母乳喂养、社交接触、户外活动、饮食调节和减少抗生素使用等多种策略的组合有助于调节婴幼儿的微生物菌群和免疫系统的发育,可预防日后自身免疫性疾病(如多发性硬化症)、过敏性疾病(如食物过敏)或/及慢性肠道炎症(如IBD)的发展[24-25]。
2.1.1 分娩方式
分娩方式是影响婴幼儿肠道微生物定植和多样性的一个重要因素。阴道分娩婴儿的肠道微生物群落与母亲的阴道微生物结构相似,以乳杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)或斯尼斯菌属(Sneathia)为主,而剖腹产婴儿的肠道微生物群落以葡萄球菌属(Staphylococcus)、棒状杆菌属(Corynebacterium)和丙酸杆菌属(Propionibacterium)为主[26]。越来越多的证据表明,分娩方式导致的肠道微生物区系组成差异会影响婴幼儿后期的免疫反应[27]。例如,在一项对7 岁儿童粪便样本进行的研究中,发现阴道分娩儿童粪便所含梭状芽孢杆菌(Clostridium)数量明显高于剖腹产儿童,而这种差异会延续到婴儿期以后[28]。Papathoma等[29]对459 名婴儿进行了为期3 年的调查,发现剖腹产婴幼儿患食物过敏的几率是阴道分娩婴幼儿的3 倍,且父母中至少一人过敏的剖腹产婴幼儿患食物过敏的几率比非过敏父母的阴道分娩婴幼儿高出10 倍。Pyrhönen等[30]的一项调查同样发现母亲无特应性疾病的剖腹产婴幼儿患食物过敏的概率是阴道分娩婴幼儿的3 倍,但不同的是母亲患有特应性疾病的阴道分娩婴幼儿的食物过敏发生率仅比母亲患有特应性疾病的剖腹产婴幼儿高出1.2 倍。不仅如此,已有证据表明分娩方式同样影响患IBD的风险,Bager等[31]对210万丹麦人进行了全国队列研究,发现无论其父母是否患有IBD,剖腹产增加了0~14 岁儿童患有IBD的风险;Andersen等[32]对2672708 名丹麦儿童分析发现,剖腹产儿童患IBD的概率是阴道分娩儿童的1.07 倍;但随后Bernstein等[33]对1671 名IBD患者和10488 名健康人群进行调查,发现剖腹产与IBD患病率的增加并没有关联;并且Bruce等[34]同样发现剖腹产与阴道分娩在患IBD的风险上并没有显著性差异。可见,剖腹产通过改变婴幼儿肠道微生物的定植和多样性进而增加生命后期患食物过敏的风险,但这种改变是否影响IBD的风险性,仍需要进一步探索。
2.1.2 抗生素的使用
抗生素的使用可以改变肠道微生物区系组成和降低肠道微生物多样性。目前,抗生素在发展中国家和发达国家都得到了广泛应用,尤其在发展中国家的使用率越来越高,这可能是导致食物过敏和IBD患病率上升的主要环境因素之一。Bashir等[35]研究表明,抗生素的使用改变了小鼠的肠道菌群结构,破坏了Toll样受体(tolllike receptor,TLR)4的信号传递,促进了花生特异性IgE和辅助性T细胞(helper T cell,Th)2细胞因子的高效表达,从而导致花生过敏反应的发生。人群队列研究表明,婴儿出生12 个月内使用抗生素与食物过敏的患病率显著相关(比值比(odds ratio,OR)1.21),抗生素使用5 次或以上的儿童食物过敏患病率是未使用过抗生素儿童的1.64 倍[36]。随后,Hirsch等[37]评估了30060 名儿童抗生素的使用与食物过敏之间的关联,发现摄入3 次或以上抗生素的儿童比没有摄入抗生素的儿童患有食物过敏的几率更高(牛奶过敏1.78 倍、非牛奶食物过敏1.65 倍),且年龄越小关联性越强。Metsälä等[38]也证实了这一结论,发现母体在怀孕前/中以及孩子出生1 个月内服用抗生素可增加婴幼儿牛奶过敏的发生率。同样,抗生素的使用在IBD中也有广泛研究。例如,Aniwan等[39]比较了736 名IBD患者和1472 名健康人群使用抗生素的情况,发现抗生素的使用增加了IBD的发生率(CD患病率增加了3.01 倍、UC患病率增加了2.94 倍),此外,累计使用抗生素时间不短于30 d的IBD发生率增加了6.01 倍,在小于18 岁、18~60 岁期间和大于60 岁时使用过抗生素的IBD发生率分别增加了4.27、2.97 倍和2.72 倍。Kronman等[40]在英国进行了一项回顾性队列研究,发现使用过抗生素的个体患有IBD的风险比没有使用过抗生素的个体增加了84%,而且这种风险会随着年龄的增加而降低,1 岁前使用过抗生素的个体患有IBD的风险是对照组的5.51 倍,而5~15 岁使用过抗生素的个体患有IBD的风险则是对照组的2.62 倍;此外,研究还发现抗生素使用的次数每增加一次会增加6%的IBD患病风险。另一项来自加拿大曼尼托巴省的研究发现,成年IBD患者在确诊前2~5 年内使用过抗生素的比例更高,且接受3 次或以上抗生素治疗的患者被确诊为IBD的几率是对照组的1.5 倍[41]。因此,以上研究均表明了抗生素的使用是食物过敏和IBD发生的易感因素。
2.1.3 母乳喂养
母乳是新生儿生命初期最理想的营养来源,母乳富含的营养物质以及免疫调节因子(细胞因子、生长因子、可溶性受体、维生素和寡糖等)在新生儿肠道屏障的成熟以及免疫系统的发育中起着重要作用[42-43]。目前,母乳喂养被建议作为预防食物过敏的首要措施[44]。van Odijk等[45]在一项系统回顾中发现,纯母乳喂养对儿童早期的牛奶过敏有预防作用。然而,最近的研究却发现母乳喂养并不能对食物过敏起到保护作用,例如,Goldsmith等[46]在一项对5276 名儿童的调查研究中发现,纯母乳喂养与儿童1 岁时食物过敏的发生并无关联性,一些观察性研究甚至发现母乳喂养的婴儿患食物过敏的风险增加[46-47]。因此,母乳喂养与食物过敏之间的关系仍有争议,未来仍需进行更多的探讨。对于IBD,多项研究已发现母乳喂养可以通过母乳中的营养物质以及免疫调节因子来降低患IBD的风险[48-51]。Madsen等[52]将白细胞介素(interleukin,IL)-10基因缺陷小鼠在出生时进行交叉喂养,发现当喂食正常母乳时,IL-10−/−小鼠体内的肿瘤坏死因子(tumor necrosis factor,TNF)-α和干扰素(interferon,IFN)-γ水平降低,且IBD症状明显减轻。在一项对亚太地区人群的研究中发现母乳喂养时间越长,其IBD的保护性越强,当婴儿母乳喂养长于12 个月时,患IBD的风险降低84%[53]。因此,母乳喂养可作为IBD的预防措施。
2.1.4 VD的缺乏
目前已证实食物过敏发病率的地区差异性与地区日照长短所导致的人体合成VD水平差异有关,因此,VD缺乏是食物过敏高发的另一危险因素[47]。Wawro等[54]测定了2815 名10 岁德国儿童血清中25-羟基VD(25(OH)D)的浓度,发现血清25(OH)D浓度低的儿童,其食物过敏原特异性IgE阳性率以及发病率较高。同样,VD也已证实在IBD的发病机制中起重要作用,其中VD的缺乏能够明显导致CD的发病。Schaffler等[55]分析对比了7 例CD患者和10 例健康人员体内VD水平对肠道菌群的影响,发现服用VD的CD患者可通过调节肠道菌群的组成和增加潜在有益菌群(Alistipes、Barnesiella、Porphyromonadaceae、Roseburia、Anaerotruncus、Subdoligranulum、Ruminococaceae)的丰度来改善CD患者的症状。Ananthakrishnan等[56]对72719 名女性进行了队列研究,发现血浆VD水平较高的女性患有CD的可能性较低。而随后在Ananthakrishnan等[57]对3217 名确诊的IBD患者的研究中发现,VD水平会进一步影响IBD患者的住院和手术风险,如血浆25(OH)D质量浓度低于20 ng/mL的IBD患者比血浆25(OH)D质量浓度高于30 ng/mL患者的住院和手术风险分别增加了2.07 倍和1.76 倍,同时,血浆初始25(OH)D质量浓度低于30 ng/mL但随后恢复正常的CD患者与一直缺乏25(OH)D的CD患者相比,其手术风险降低了44%。
2.1.5 饮食
西式饮食(高糖、高脂、低膳食纤维)与肠道微生物的变化、肠道黏液层的减少、肠道通透性的增加以及肠道免疫系统的激活有关[58]。研究表明,富含膳食纤维的饮食能促进肠道微生物菌群产生更多的短链脂肪酸,它们可通过激活G蛋白偶联受体(G protein-coupled receptors,GPCRs)、增加调节性T细胞(regulatory T cell,Tregs)数目来提高黏膜免疫耐受性[59]。因此,近年来科学家们认为西式饮食是食物过敏高发的另一主要原因。Tan Jian等[60]在动物实验中发现高纤维饮食可重塑肠道微生态,增加短链脂肪酸的产生,并通过提高CD103+树突状细胞(dendritic cells,DCs)的视黄醛脱氢酶活力来增强小鼠的口服耐受性,预防食物过敏。Grimshaw等[61]调查了婴儿1 岁前的饮食模式与2 岁时食物过敏发病率之间的关系,发现高含量的水果、蔬菜和家庭自制食物组成的1 岁前饮食模式可降低婴儿2 岁时食物过敏的发病率。同样,高脂低纤维饮食同样与IBD的风险成正相关。Amre等[62]在一项病例对照研究中揭示了ω-3多不饱和脂肪酸、水果和蔬菜的摄入量与CD的风险呈负相关,其中膳食纤维的效果最为显著,膳食纤维摄入量高的儿童的CD患病率降低了88%。Ananthakrishnan等[63]对170805 名女性进行了长达26 年的前瞻性跟踪调查,发现摄入较多的ω-3多不饱和脂肪酸可降低UC的发病风险,而长期摄入大量反式不饱和脂肪酸则增加了UC的发病趋势。随后,在一项对170776 名女性进行的前瞻性跟踪调查中同样发现,膳食纤维摄入量高的女性CD的发生率显著降低;此外,除了纤维的总摄入量外,不同的纤维来源也会产生不同的影响,从水果和蔬菜中摄取的膳食纤维与降低CD的风险有关,而来自全谷物、谷类或麸皮的纤维与降低CD的风险无关,这种差异主要是因为水果中的纤维是可溶性或可发酵的纤维,可被肠道菌群代谢生成短链脂肪酸,抑制细菌移位,可维持肠道屏障的完整与稳态[64]。
2.2 肠道微生物
综上所述,分娩方式和婴儿喂养类型等因素均可改变婴儿期肠道微生物群落的组成以及日后肠道微生物的稳定性与多样性。越来越多的证据表明,肠道微生物区系与食物过敏和IBD的发病机制有关,大多数的食物过敏和IBD患者都会出现肠道菌群失调现象(表2),并且肠道微生物组成越复杂,其患食物过敏和IBD的风险就越低[65-66]。对于食物过敏,肠道微生物失调破坏了肠道上皮屏障功能,使肠道黏液层受损,增加了食物抗原的渗透性。受损或应激的上皮细胞释放IL-25、IL-33和胸腺基质淋巴细胞生成素(thymicstromallymphopoieti,TSLP),激活2型固有淋巴样细胞(group 2 innate lymphoid cells,ILC2s)产生IL-4和IL-13,打破Th1/Th2平衡偏向Th2反应,促进食物过敏的发生[67-68]。对于IBD,肠道菌群结构的变化或失衡导致了免疫系统的紊乱,使机体处于促炎状态,与此同时,DCs、巨噬细胞和上皮细胞上的TLR和Nod样受体(Nod-like receptor,NLR)与失衡的微生物区系相互作用,促进Th17细胞、3型固有淋巴样细胞(group 3 innate lymphoid cells,ILC3s)和Th1细胞的分化,分泌促炎细胞因子,引发IBD[69]。另有研究表明,IBD患者常伴随患有食物过敏,是因为IBD导致的胃肠道炎症以及随后的抗生素治疗诱发患者肠道微生物失调,打破了对外来食物抗原的免疫耐受,从而促进了食物过敏的发生[70]。

表2 食物过敏和IBD肠道微生物变化[65-66,69,71-72]Table 2 Microbiota changes associated with food allergy and IBD[65-66,69,71-72]
2.3 肠道黏膜免疫
2.3.1 T淋巴细胞
Th0细胞激活后可分化为Th1、Th2、Th17和Treg细胞。Th1细胞在CD、乳糜泻和非IgE介导的过敏反应起主导作用,CD患者肠道黏膜固有层中Th1细胞相关的IL12Rβ受体、信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)4和T-bet转录因子以及Th1型细胞因子IFN-γ和TNF-α的表达量增加[10,73]。Th2细胞在UC和IgE介导的过敏中起主导作用,Th2释放大量IL-4、IL-5、IL-10和IL-13等,促使M细胞和嗜酸性粒细胞增多和活化,释放大量炎症因子,促进过敏反应的发生,其中,Th2细胞释放的IL-13已被证实可以增加肠道通透性、诱导肠细胞分化和凋亡[74-75]。Th17可防止黏膜表面细菌和真菌的入侵,Th17细胞分泌的IL-17和IL-22也可通过产生屏障保护性细胞因子和抗菌肽来维持肠道稳态,但Th17细胞极化会导致免疫功能的破坏,与IBD和过敏性疾病有关[75-76]。肠道Tregs通过产生IL-10和转化生长因子(transforming growth factor,TGF)-β等抗炎细胞因子维持肠道黏膜的动态平衡,可抑制IBD的发生,而且Tregs分泌的IL-35和TGF-β也可改善食物过敏的发生,不仅如此,Tregs也可分泌IL-10,与上述Th2分泌的IL-10不同的是,由Tregs分泌的IL-10在对过敏原的免疫耐受中发挥了关键作用并可抑制Th2型免疫反应和过敏性炎症[75,77-78]。但Th17和Tregs之间存在拮抗现象,即Th17细胞可抑制Tregs的生成,在IBD和食物过敏中,Th17表达增加而Tregs表达下降,其中TGF-β是调节Th17和Tregs两者平衡的主要因子[76,79-80]。
2.3.2 嗜酸性粒细胞
嗜酸性粒细胞浸润是食物过敏和IBD常见的肠道症状。食物过敏患者结肠中多处出现嗜酸性粒细胞浸润,从盲肠到乙状结肠的活检组织中嗜酸性粒细胞大量脱颗粒,且当暴露于过敏原时,嗜酸性粒细胞的免疫反应性增强,脱颗粒释放的生物活性介质(如嗜酸性粒细胞阳离子蛋白、主要碱性蛋白、血小板活化因子和白三烯等)可引起局部或全身性的过敏反应[81]。同样,IBD患者结肠中嗜酸性粒细胞数量显著增加,其中嗜酸性粒细胞浸润数量与血清嗜酸性粒细胞趋化因子1水平与IBD严重程度呈正相关;并且IBD患者结肠活检显示出嗜酸性粒细胞脱颗粒,且血清中释放的嗜酸性粒细胞过氧化物酶(eosinophil peroxidase,EPX)通过影响肠道屏障导致IBD的发生[82]。
2.3.3 肥大细胞
肥大细胞是食物过敏反应的效应细胞,当过敏患者再次接触过敏原后,过敏原与致敏的肥大细胞表面IgE结合,刺激肥大细胞脱颗粒,释放组胺、白三烯等,引发过敏反应。肥大细胞释放的IL-9在食物过敏发病机制中起着至关重要的作用,是肥大细胞增殖、成熟和激活的关键细胞因子,此外,分泌IL-9的黏膜肥大细胞(IL-9-producing mucosal mast cells,MMC9s)是放大肠道过敏性炎症和维持过敏反应的关键因素,而且,动物实验中MMC9s和CD4+Th2细胞之间的相互作用是控制食物过敏易感性和严重程度的关键机制[83]。同样,肥大细胞的异常激活会导致IBD的发生。已有证据显示,IBD患者肠道黏膜组织内肥大细胞的数量以及肥大细胞释放的类胰蛋白酶明显多于健康人群,且与非炎症组织相比,炎症组织处存在更多的肥大细胞[84-85]。此外,肥大细胞释放的其他多种促炎症性因子(如IL-1β、IL-6、TNF-α)以及生物活性介质(如组胺、类胰蛋白酶、类糜蛋白酶、羧肽酶、白三烯、血小板活化因子、肝素)同样在IBD中发挥着重要作用[86]。
2.3.4 树突状细胞
DCs是一种骨髓来源的抗原提呈细胞,由两个主要亚群组成:经典DCs(conventional dendritic cells,cDCs)和浆细胞样DCs(plasmacytoid dendritic cells,pDCs),其中,cDCs在肠道免疫调节中起重要作用[87]。研究表明,DCs可通过多种途径启动食物过敏:1)DCs表面的OX40配体(OX40 ligand,OX40L)在Th2过敏反应中起着重要作用,Blazquez等[88]在小鼠的卵清蛋白过敏模型中发现,DCs激活后可上调细胞表面OX40L的表达;而后在进行体外DC-T细胞共培养实验中发现,抗OX40L抗体的加入可阻断OX40L的表达,从而减少Th2细胞因子的产生;2)DCs表面共刺激分子T细胞免疫球蛋白和黏蛋白域分子(T cell immunoglobulin and mucin-domaincontaining molecules,TIM)-4是启动过敏反应的另一重要途径,当暴露于过敏原时,DCs可通过增加TIM-4的表达量及其与T细胞上TIM-1的相互作用,激活特异性Th2细胞,从而导致肠道过敏反应的发生[89-90]。在体外细胞培养中,葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)可刺激人DC细胞进一步驱动Th2分化,其中TIM-4表达增加是关键因素;同时,在花生过敏小鼠模型中,小鼠体内TIM-4表达量增加,促进了花生特异性IgE的升高[91-92];3)DCs在食物过敏的Notch通路中起作用,DCs表面表达的Notch配体Jagged1和Jagged2可调控T细胞,促进Th2分化[93]。
类似地,IBD发病机制的关键途径也与DCs有关:1)DCs中的一种细菌感受器核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization-2,NOD2)可影响微生物的摄入、细胞因子的产生和抗原的提呈,CD患者中的NOD2发生变异,导致DCs在自噬诱导、细菌转运和抗原提呈方面存在缺陷,进而导致了胃肠道炎症[94];2)IBD患者肠道DC受体TLR2和TLR4的高效表达,增强了微生物识别能力,促进促炎细胞因子(如IL-6、IL-12)的分泌[95];3)DCs产生的细胞因子与IBD患者的疾病活动性、炎症程度和肠道微生物区系也同样紧密相关。例如,CD患者肠系膜淋巴结(mesenteric lymph nodes,MLN)中的DCs在微生物的刺激下IL-23分泌量增加,促进了CD4+T细胞产生更多的IL-17和IFN-γ,打破了Th1与Th17之间的免疫平衡[96]。此外,与健康人群相比,UC患者结肠DCs数量减少,且DCs诱导产生Treg细胞的能力受损[97]。
3 食物过敏与IBD的治疗方法
基于食物过敏和IBD相似的临床症状以及病理机制,临床上采用了一些相似的免疫调节剂和免疫抑制剂进行治疗,例如类固醇、环孢素[11]。食物过敏和IBD目前均无法根治,最有效治疗食物过敏的方法就是完全避免食物过敏原的摄入[17];而针对IBD患者,采用“轮替”或“忌食”的方法让机体避免摄入部分食物(如特殊碳水化合物饮食、无麸质饮食、低FODMAP(可发酵的寡糖、二糖、单糖和多元醇)、低IgG4水平的食物、乳蛋素食饮食等),可在一定程度上缓解IBD的临床症状[98]。此外,益生菌干预和粪便移植是治疗食物过敏和IBD的潜在手段[21]。
益生菌可促进肠道通透性恢复正常,改善肠道免疫功能,促进IgA产生,调节肠道微生物区系以及抑制促炎细胞因子的产生,从而预防食物过敏和IBD的发生[99]。例如,鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)在小鼠和人体实验中均被发现可降低对牛奶的过敏反应;此外,益生菌VSL#3(一种由8 个经过冷冻干燥的活菌株组成的高浓度益生菌制剂,包括L.paracasei、L.plantarum、L.acidophilus、L.delbrueckii subspecies bulgaricus、B.longum、B.breve、B.infantis和Streptococcus thermophilus)可显著缓解轻度和中度UC的症状[100-106]。但是,益生菌干预食物过敏和IBD有3 个局限性:1)每种益生菌都具有自己独特的功能,会因机体的个体差异而表现出不同的作用效果;2)益生菌干预有时要长期进行,突然停止益生菌干预可能会进一步加剧肠道菌群的失调;3)目前关于益生菌干预的研究不足,在人体系统中的有效性还需进一步验证[65]。
粪便移植(fecal microbiota transplantation,FMT)是目前一种新兴的治疗方法,它是将健康捐赠者的粪便悬浮液注入到患者的胃肠道系统中,重建患者肠道微生物区系的多样性,恢复肠道免疫稳态从而缓解症状[42]。Feehley等[107]研究结果表明,移植健康婴儿的粪便给无菌小鼠可以阻止食物过敏的发生,而移植食物过敏婴儿的粪便给无菌小鼠则会增加其食物过敏的易感性,但目前FMT在食物过敏这一领域仍需更多的研究数据支持。FMT同样显示出治疗IBD的有效性,在随机对照实验中显示28%的IBD患者经FMT治疗后症状得到缓解,而在队列研究中24%的IBD患者经FMT治疗后症状得到缓解[108-109]。但也有研究表明,FMT治疗对IBD没有影响,并且FMT只能在有限的时间内使用,没有靶向性并具有很强的供体效应,有可能产生不可预测的不良影响[110]。
4 结语
食物过敏和IBD在发病率、临床症状、病理机制以及治疗方法上的相似性,很大程度上提高了对食物过敏与IBD关联性的认知。通过了解食物过敏与IBD两者相互影响的内在因素,进一步理解IBD患者发生食物过敏以及食物过敏患者发生IBD的风险性。但综合目前的研究进展,还存在一些问题需要进一步研究与探索。食物过敏和IBD存在相互影响的作用,但内在关联机制还不完全清楚,目前的报道大部分集中于流行病学研究,尚缺乏动物及临床的理论研究。因此,研究人员应致力于探索食物过敏和IBD相互影响的内在作用机制,为预防与控制IBD患者食物过敏的发生以及食物过敏患者IBD的发生提供科学依据与指导。

