酒精浸泡冷藏鲜印度块菌货架期评估、挥发性物质与细菌群落变化及其相关性
黎 琦,邹璐潞,马沁沁,朱 林,何淑豪,梁诗慧,苗玉志
(四川师范大学生命科学学院,四川 成都 610100)
鲜印度块菌(Tuber indicum)因其营养丰富、芳香浓郁并富含抗氧化、抗菌、抗肿瘤、抗抑郁和免疫调节等生物活性物质被誉为“餐桌上的钻石”“地下黄金”,是世界上最美味、最珍贵的食用菌之一,受到国内外消费者的青睐,且由于国内外市场价格高而具有极大的经济价值[1-4]。但块菌生长环境的特殊性和子囊果内部结构的独特性造就了成熟块菌子囊果内含大量的微生物[5],加之采后旺盛的新陈代谢和呼吸作用,使得块菌在新鲜时极易腐烂变质,失去营养作用和经济价值[6],而传统的冻藏技术会导致块菌解冻后芳香物质大量流失和质地软化,所以实现鲜印度块菌采后贮藏保鲜,有效延长其货架期,是块菌产业可持续发展的必经之路。
国内外学者已就黑孢块菌(Tuber melanosporum)、夏块菌(T.aestivum)、白块菌(T.magnatum)以及印度块菌(T.indicum)等不同种块菌的贮藏保鲜技术进行了研究,在已有报道中,多以添加剂处理结合气调或真空包装保藏为主,如Elena等[7]利用质量浓度2.5 mg/mL没食子酸处理黑孢块菌后置于4 ℃冷藏保鲜,其货架期可达28 d;Choo等[8]采用质量浓度400 mg/L壳聚糖-纳他霉素对鲜澳大利亚黑块菌进行涂膜处理,有效降低了块菌微生物数量,将货架期延长至28 d;Sara等[9]采用复配的混合气体于聚丙烯容器中30 kPa气压包装鲜黑孢块菌后冷藏,其货架期延长至28 d。研究表明,采用复合食品添加剂处理鲜印度块菌后真空包装并于4 ℃贮藏其货架期延长至49 d[9-10]。但这些技术多存在处理和包装工序复杂以及设备要求高等问题,难以在日常生活中得以有效应用,从而限制了鲜印度块菌的消费。因此,开发一个简单易行且能有效延长鲜印度块菌货架期的贮藏保鲜技术,不仅能保存鲜印度块菌的营养价值而且能促进鲜印度块菌的消费[11]。
鲜印度块菌贮藏保鲜技术研发过程中,块菌的感官、微生物数量、营养组分以及芳香物质常被用作块菌新鲜度、安全性的重要指标,而其中块菌的挥发性物质尤其重要。研究表明,大多块菌挥发性芳香成分由大约56 种芳香物质组成,其中11~13 种处于嗅觉可感知的水平[12-14],而未经处理的鲜印度块菌在贮藏保鲜过程中其挥发性芳香物质含量会不断下降而腐败类异味物质含量持续增加,虽然变化机制尚不完全清楚,但丰富的内生微生物群落可能参与了这一过程[15-16],并与块菌贮藏期间产生的腐败类异味物质,如三甲基胺和2-甲基异茨醇等相关[17]。但关于鲜印度块菌贮藏保鲜过程中营养组分、挥发性物质和细菌群落在冷藏过程中的变化规律及其相关性迄今未知。
本实验以鲜印度块菌为原料,经过温开水清洗、食用酒精速泡和4 ℃冷藏等工序处理,以感官评价为标准研究简单有效并能提升鲜印度块菌货架期的冷藏技术,并深入分析鲜印度块菌冷藏期间营养组分、挥发性物质和细菌群落变化及相关性,以期为进一步研究鲜印度块菌腐败机制和贮藏保鲜新技术提供参考。
1 材料与方法
1.1 材料与试剂
鲜印度块菌采挖于四川攀枝花3 个块菌自然产区,每个产区各约1000 g。采挖后立即用无菌湿巾纸单个包裹后置于装有冰袋的隔热泡沫盒中2 d内运回实验室,置于4 ℃冰箱备用。
葡萄糖 成都曼思特公司;苯酚、氢氧化钠、浓硫酸、硫酸铜、硫酸钾、硼酸、盐酸、甲基红、亚甲基蓝、仲辛醇等常规化学试剂(均为分析纯)、食用酒精(食品级) 成都科龙化工试剂厂;琼脂 青岛海博生物公司;Qubit dsDNA Assay Kit试剂盒 美国Life Technologies公司;Tks Gflex DNA ploymerase试剂盒美国Takara公司。
1.2 仪器与设备
GI100DS型自动高压蒸汽灭菌锅 美国Zealway公司;THZ-98A型恒温振荡培养箱 上海一恒科技公司;K9840型全自动凯氏定氮仪 济南海能仪器股份公司;Intuvo 9000/5977B型气相色谱/单四极杆气相色谱质谱联用系统、PAL型自动进样器和PDMS/DVB型自动固相微萃取头 美国Agilent公司;2500型凝胶成像仪北京Tanon公司;MiSeqPE300 美国Illumina公司。
1.3 方法
1.3.1 冷藏块菌样品的制备
在充分预实验的基础上制备:从每个产区挑选成熟度和大小基本均匀一致的块菌各16 个,用润湿的软毛刷除净子囊果表面的泥土,于温开水中淘洗干净并于通风橱中风干表面水,置于体积分数75%食用酒精溶液中浸泡消毒30 s,立即用温开水冲洗子囊果5 次再风干表面水。分别将每个子囊果切分成1/9大小(基于9 个时间点取样分析),混合均匀后均分到9 个无菌聚乙烯袋(20 cmh 22 cm)内真空包装后于4 ℃冷藏保鲜,贮藏环境的相对湿度控制在76%~80%,分别于冷藏的0、8、15、20、25、30、33、36 d和38 d取样,进行感官评定、营养和挥发性物质含量分析,同时采用16S rRNA高通量测序技术测序,以不浸泡处理的鲜印度块菌作为对照,每样进行3 个平行实验。
1.3.2 感官评定
感官评定采用9 分制评分标准,具体方法参考Rivera等[18]的评定标准稍作修改。由9 名经过专业训练的评定人员(包含3 名行业专家)组成评价小组,通过挤压质地、嗅闻香气、舌尝风味和眼观样品内部颜色和纹理,并综合评价各个样品的可接受程度,评分标准见表1。

表1 鲜印度块菌感官评分标准Table 1 Criteria for sensory evaluation of fresh truffles
1.3.3 营养组分和质量损失率测定
取待测样品用无菌刀将其切碎,冻干至恒质量、粉碎、过60 目筛,装入清洁的广口瓶密封,放入干燥器内备用。总糖含量的测定参照GB/T 15672-2009《食用菌中总糖含量的测定》,蛋白质含量测定参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》,粗纤维含量的测定参照GB 5009.88-2014《食品安全国家标准 食品中膳食纤维的测定》。冷藏期间块菌质量损失率通过块菌贮藏前后的质量变化计算[19],如公式(1)所示。

1.3.4 挥发性物质分析
1.3.4.1 顶空固相微萃取提取
准确称量块菌各冻干样品2.0 g进行如下操作,将样品置于20 mL顶空硅胶隔垫进样瓶中,加入10 μL用超纯水稀释的仲辛醇溶液(质量浓度0.52 μg/μL)作为内标,将顶空瓶置于53 ℃水浴锅中平衡45 min,将老化后的萃取头插入顶空进样瓶中,顶空吸附40 min后通过PAL自动进样器进样并采用气相色谱/单四极杆气相色谱质谱联用系统进行测定[20]。
1.3.4.2 气相色谱-质谱分析
色谱柱为HP-INNOWax 毛细管色谱柱(30 mh 250 μmh 0.25 μm);进样口温度240 ℃,解吸时间5 min,采用不分流模式进样。升温程序:50 ℃保持5 min,3 ℃/min速率升温至185 ℃,10 ℃/min速率升温至200 ℃保持1 min,以10 ℃/min的速率升温至250 ℃并保持3 min。载气为高纯氦气,柱流速1 mL/min,进样量1.0 μL,不分流。质谱条件:检测器单四极杆,电子轰击EI离子源,电子能量70 eV,接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,溶剂延迟0 min,全扫描信号采集,扫描范围m/z20~550,扫描速率781 u/s。通过计算机标准谱库(NIST 2017)比较分析块菌的挥发性物质,选择匹配度大于80%的物质并结合安捷伦质谱系统进行定性分析;数据定量分析采用内标法半定量分析,按照公式(2)计算各样品挥发物质的含量[20]。

1.3.5 高通量测序
将制取的不同冷藏时间鲜印度块菌样本用干冰包装送至上海派森诺生物科技有限公司,基于Illumina MiSeq平台进行高通量测序,细菌多样性鉴定对应测序区域为16S V3~V4区。实验操作参考赵萍等[21]描述的方法进行。
样本α-多样性分析:1)Sobs稀释性曲线,稀释性曲线根据个体数量和物种数量构建曲线,用来比较测序数据量不同的样本中物种的丰富度,也用于指示测序数据量是否合理。利用Mothur软件做Rarefaction分析,R语言绘图;2)微生物多样性是在生物群落水平上进行研究的,通过对单样本的菌群丰度指数(Chao1指数)和菌群多样性指数(Shannon、Simpson指数和Coverage指数)进行研究,可以反映微生物群落的丰度和多样性;3)Shannon指数用于反映各样本在不同测序量下各样品的微生物多样性。利用Mothur软件计算不同随机抽样下的Shannon指数,并用R语言绘图;4)主成分分析(principal component analysis,PCA),通过分析不同样本的操作分类单元(operational taxonomic units,OTU)(97%相似性),使用R语言作二维坐标图,可以反映样本间的差异和距离。
1.4 数据统计与分析
高通量测序完成后,对原始双端系列去杂,利用Flash软件进行拼接,然后利用Uchime软件检测并去除序列中的嵌合体。有效序列采用Vsearch软件,根据序列的相似性,将相似度≥97%的序列归为多个OTU,使用Qiime软件包挑选出各个OTU的代表序列,并将所有代表序列与数据库进行对比注释。基于分类信息学信息,探讨鲜印度块菌冷藏期间细菌群落结构变化。使用Excel软件对原始数据进行处理、汇总,采用SPSS 26软件进行显著性分析,其中多重比较采用邓肯法,P<0.05、P<0.01分别表示差异显著和极显著,利用Origin 2018软件绘图。
2 结果与分析
2.1 感官评定结果
按照评分标准对不同冷藏时间的实验组和对照组样品进行感官评定,结果见图1A、C(单项得分)和图1B、D(总分)。由图1A可知,与贮藏0 d相比,冷藏15 d实验组块菌的质地、香气、风味和内部纹理得分下降显著(P<0.05),15 d时实验组总得分37.00 分,但仍符合一级新鲜A,而对照组贮存30 d时样本总得分下降极显著(P<0.01),总得分为9.33 分,达到腐败标准,因而对15 d后的对照组样本不再继续研究;实验组样本30 d时质地、香气、风味和内部纹理得分变化与0 d相比差异极显著(P<0.01),总得分降到19.00 分,品质降到二级新鲜度B;在冷藏31~38 d时,块菌质地极软,基本没有块菌的香气和风味,内部颜色和大理石纹理消失,33 d时各项指标总得分降到12.09 分,达到腐败程度C,因而通过感官预测得到鲜印度块菌货架期为30 d,这同采用食品添加剂复合处理真空包装鲜印度块菌冷藏货架期短19 d[10],比采用辐射处理气调包装冷藏的货架期短12 d[22],比其他冷藏保鲜技术的28 d长2 d[9]。综上,经感官评定鲜印度块菌在冷藏过程中历经一级新鲜A(0~15 d)、二级新鲜B(6~30 d)和腐败C(31~38 d)3 个阶段。
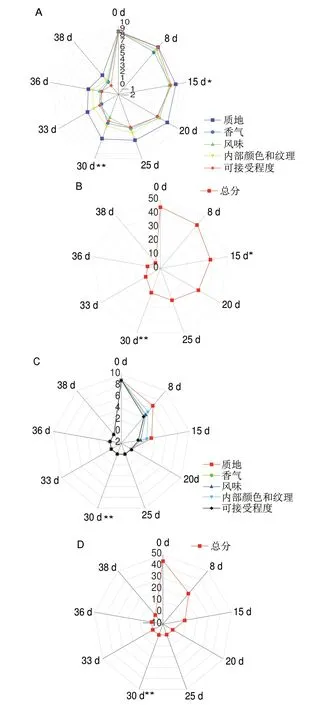
图1 鲜印度块菌冷藏期间的感官单项得分和总得分Fig.1 Sensory scores of fresh Tuber indium pretreated and not pretreated with alcohol during cold storage
2.2 营养组分和质量损失率变化
对各样品的总糖、总蛋白、粗纤维含量和质量损失率分析结果见图2,在冷藏15 d时,与0 d相比总糖相对含量由38.9%下降到31.1%(P<0.01),而15~30 d内,由31.1%下降到30.9%;总蛋白相对含量在0、15 d和30 d时分别为23.3%、22.9%和21.8%,但在38 d时,相对含量减少到17.1%(P<0.05);粗纤维相对含量在0、15 d和30 d时分别为43.9%、42.8%和41.4%,到38 d时粗纤维相对含量为36.8%,与0 d相比下降显著(P<0.05);块菌质量损失率从0 d的2.55%升到38 d的6.95%,差异显著(P<0.05)。Saltarelli等[23]研究发现白块菌、黑孢块菌和夏块菌的总蛋白相对含量没有受到贮藏条件的影响,而波氏块菌的总蛋白在冷藏30 d时含量显著减少,说明块菌冷藏过程中蛋白质含量变化同块菌品种相关。鲜印度块菌在冷藏的0~38 d内,总糖、总蛋白、粗纤维相对含量以及质量损失率分别在0~15、15~30 d和30~38 d呈阶段性变化,这进一步印证了感官评定结果的准确性。
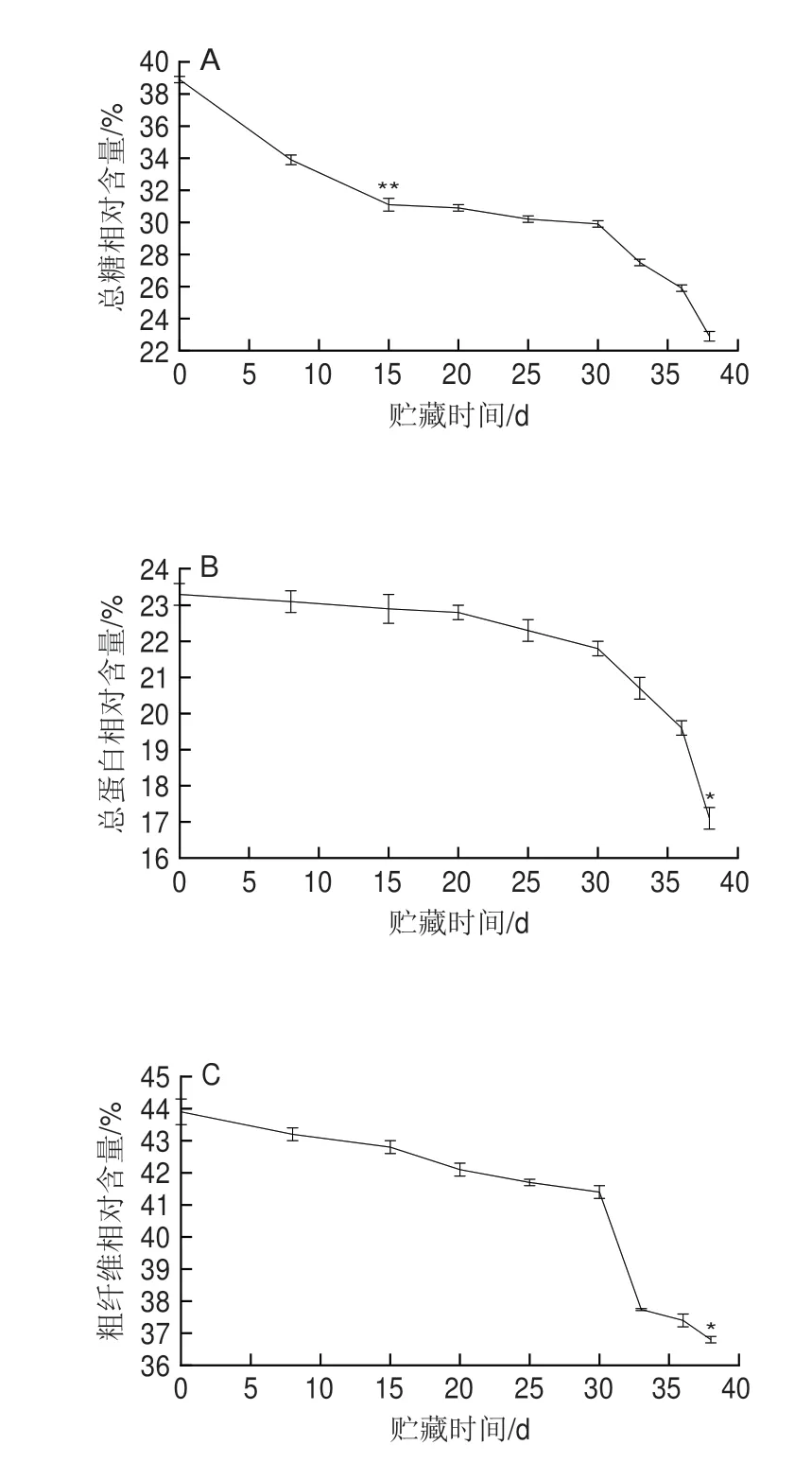
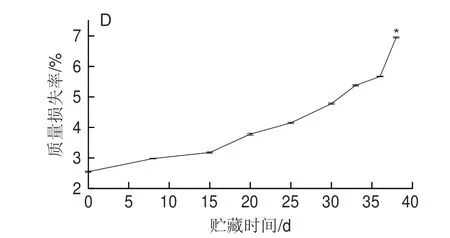
图2 鲜印度块菌冷藏过程中营养组分和质量损失率变化Fig.2 Changes in nutritional components and mass loss percentage of fresh Tuber indium during cold storage
2.3 挥发性物质变化
2.3.1 挥发性芳香和异味物质
通常情况下,挥发性芳香化合物对块菌香气的贡献由其含量和气味阈值共同决定,含量高的挥发性芳香物质对块菌的风味具有重要作用,但一些含量低且气味阈值也低的化合物可能对块菌整体风味也具有显著促进作用[24]。基于挥发性物质的离子流图,从样本中共检测到67 种挥发性物质(图3A),其中挥发性芳香物质合计38 种(图3B),包括12 种酯类、9 种醇类、8 种醛类、5 种醛酮类、2 种酸类以及2 种其他类化合物,变化趋势为从0 d的38 种减少到15 d的17 种,到38 d时仅有7 种被检出且含量极低;而1-辛烯-3-醇是印度块菌香气中最重要的挥发性物质之一,也是印度块菌“蘑菇味”最主要的来源[25],从冷藏0 d的块菌中检出0.43 μg/g 1-辛烯-3-醇,而在15 d后未检出,对鲜印度块菌香气贡献程度较大的挥发性物质还有1-辛烯-3-酮、苯甲醛、己醛、2-辛酮等[26]在0 d的样本中均检出,但随着冷藏时间的延长,其含量下降明显,到30 d时均未检出。二甲基硫醚被认为是块菌最重要和特有的芳香化合物,能呈现块菌独特的香气[27]。Richard等[28]研究表明二甲基硫醚对黑孢块菌和意大利白块菌的芳香品质贡献程度最大,但本研究在印度块菌中未检出二甲基硫醚,而Zhang Bo等[29]则在新鲜印度块菌中检测到该物质的存在,分析认为酒精处理可能对印度块菌中二甲基硫醚有影响,这一结论有待进一步验证。
由图3C可知,“不愉快”“刺激性”的挥发性异味物质从块菌冷藏15 d的1 种持续增加,至38 d时增加到24 种;从含量方面看,3-甲基-1-丁醇自第8天开始出现,贮藏30 d增加到13.55 μg/g,再增加到38 d的40.52 μg/g;乙酸含量由2.06 μg/g(8 d)增加到10.44 μg/g(25 d),再到14.77 μg/g(36 d);二甲醚含量由0.22 μg/g(8 d)增加到13.30 μg/g(25 d),再到31.72 μg/g(36 d);3-甲基丁酸含量由0.15 μg/g(8 d)增加到3.39 μg/g(25 d)再增加到8.81 μg/g(36 d);另外,具有酸败味的庚醛、“不愉快的干椰肉油气味”的己酸以及“腥臭味”的吡啶[24],分别从0 d的0 μg/g增加到30 d的1.15、0.30 μg/g和0.99 μg/g,在38 d时分别达到1.31、1.31 μg/g和1.61 μg/g;此外,还有多达17 种异味物质在30 d后才检出,其出现的原因可能和块菌子囊果内大量存在的微生物有关[15-16]。另外,研究发现在冷藏过程中还存在含量基本保持不变的5 种挥发性物质,其出现的原因和在块菌中的作用有待进一步研究。
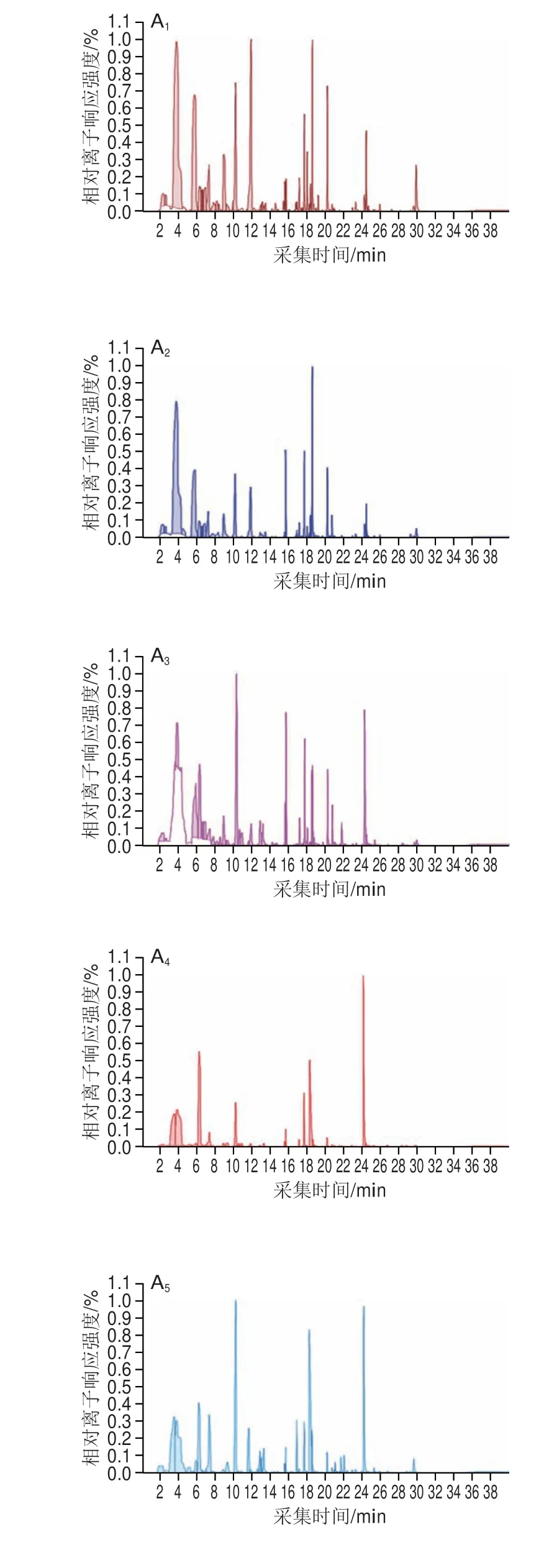
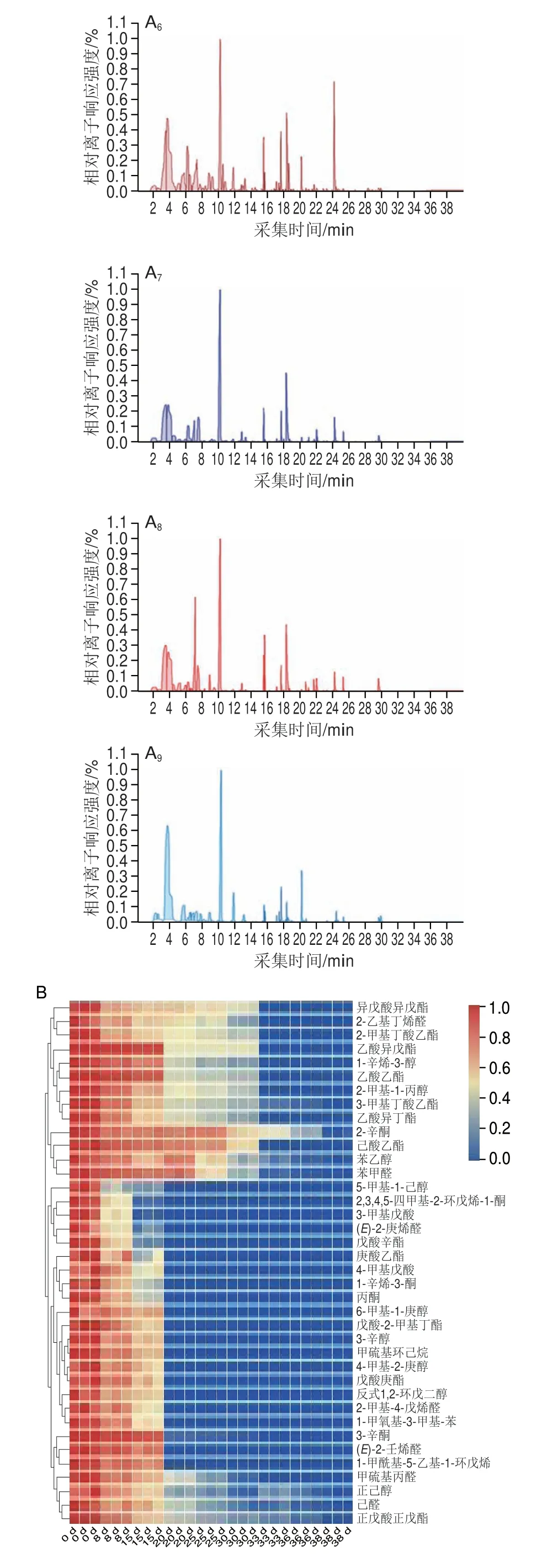
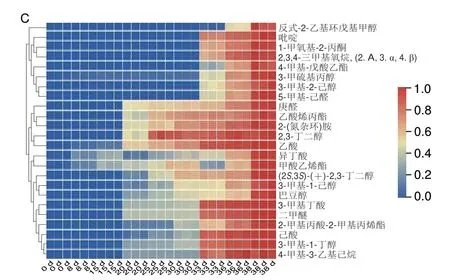
图3 鲜印度块菌冷藏期间挥发性物质离子流图(A)、含量下降(B)和上升(C)的挥发性物质Fig.3 Chromatogram (A) of volatile compounds from fresh Tuber indium,volatile compounds that decreased (B) and those that increased (C) during cold storage
2.3.2 挥发性物质的PCA结果
含量下降的挥发性芳香物质的PCA结果如图4A所示,第一主成分(PC1)对原变量变化的解释率为88.7%,第二主成分(PC2)对原变量变化的解释率为7.8%,总解释率为96.5%,解释可信度极高,表明鲜印度块菌在冷藏的0~20 d挥发性芳香物质种类多浓度较高是维护鲜印度块菌芳香的主要因子;同样,含量上升的挥发性异味物质PCA结果如图4B所示,第一主成分(PC1)对原变量变化的解释率为77.9%,第二主成分(PC2)对原变量变化的解释率为14.9%,总解释率为92.8%,解释可信度较高,表明块菌在冷藏0~15 d挥发性异味物质种类少浓度低对块菌质量影响不明显,在冷藏的20~30 d挥发性臭味物质出现并随冷藏时间的延长而增多,在30 d后挥发性臭味物质种类多浓度高,对冷藏块菌质量影响明显。

图4 鲜印度块菌冷藏期间挥发性芳香物质(A)和异味物质(B)的PCA图Fig.4 PCA plots of volatile aroma compounds (A) and odor compounds (B) in fresh Tuber indium during cold storage
2.4 细菌群落变化
2.4.1 细菌α-多样性
采用16S rRNA Illumina Hiseq测序,从27 个样品中共获得1130829 条优化序列,每样平均长度为41882,有效序列百分比达75%以上,表明样本的有效序列满足后续微生物多样性分析要求。OTU分类表明它们分属于21 个门、50 个纲、110 个目、216 个科、411 个属和615 个种。根据97%相似度水平的OTU信息,通过Sobs、Chao1、Shannon、Ace指数和Simpson指数等对样品的细菌α-多样性进行评估,结果见表2,各个样品的Coverage指数在99.66~99.82之间,表明样品基因序列检出数据可靠;各样品的细菌α-多样性指数组间差异不明显,即在冷藏的0~38 d内细菌群落变化不明显。进一步对各样品的α-多样性指数比较,发现随着冷藏时间的延长,各样本中的Sobs(OTU数目)、Chao1指数和Shannon指数呈下降趋势,且从冷藏15 d后下降明显,说明冷藏前期鲜印度块菌细菌多样性比冷藏后期更丰富。冷藏15 d后的样本同冷藏30 d相比,各指数均有一定幅度的变化,根据各指数的变化特点,可将冷藏过程区分为冷藏前期(0~15 d)、冷藏中期(15~30 d)、冷藏后期(30~38 d),各时期之间细菌α-多样性指数变化较明显,这同感官评估获得的一级新鲜度A、二级新鲜B和腐败C 3 个阶段相印证。

表2 鲜印度块菌不同冷藏时间细菌α-多样性指数Table 2 Alpha diversity indices of bacteria communities in fresh Tuber indium during cold storage
2.4.2 细菌群落变化
鲜印度块菌冷藏期间细菌群落在门分类水平上相对丰度变化见图5A,从各样本中检出的主要菌门有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)。绝对优势菌门为Proteobacteria,相对丰度在76.28%~81.48%之间,从0 d的78.89%缓慢增加到30 d的81.48%,38 d时下降为80.98%;其次为Bacteroidetes,相对丰度在7.21%~19.78%之间,从0 d的10.86%缓慢增加到15 d的19.78%,38 d时下降为7.32%;Actinobacteria、Firmicutes和Verrucomicrobia的相对丰度在0.57%~7.41%之间,Actinobacteria从0 d的4.27%下降到15 d的2.13%,38 d时上升到7.41%;Firmicutes和Verrucomicrobia在冷藏期间变化不明显;其他菌门相对丰度均小于1%。总体上,门水平上的Proteobacteria、Bacteroidetes、Actinobacteria、Firmicutes和Verrucomicrobia是鲜印度块菌冷藏中的优势菌门,它们同冷藏期鲜印度块菌品质密切相关,这和其他研究结果[30-31]基本一致。
为细化研究鲜印度块菌不同样品中细菌群落差异,进一步在属水平上分析鲜印度块菌冷藏过程中细菌群落多样性,结果如图5B所示,在冷藏的0~15 d内相对丰度最高的是慢生根瘤菌属(Bradyrhizobium),相对丰度在18.72%~23.19%之间,从0 d的22.36%降到15 d的18.72%,25 d时上升到23.19%,而后保持稳定;其次是假单胞菌属(Pseudomonas),相对丰度分别从0 d的4.23%开始一直上升,在30 d时达到最高的24.02%,而后保持稳定;根瘤菌属(Rhizobium)从0 d的8.97%下降到25 d时的7.00%,在38 d时上升为7.87%;剑菌属(Ensifer)、贪食菌属(Variovorax)、Dyadobacter和地杆菌属(Pedobacter)在0 d时相对丰度分别为3.10%、4.25%、1.57%和1.47%,在15 d时达到最高(6.81%,6.55%、5.47%和6.06%),此后一直下降,在38 d时分别为4.89%,3.65%、0.66%和2.98%;鞘氨醇杆菌属(Chitinophaga)、黄杆菌属(Flavobacterium)、沙雷氏菌属(Serratia)、紫色杆菌属(Janthinobacterium)以及丛毛单胞菌属(Comamonas)这些菌属在冷藏的0~38 d间相对丰度为1%~2%;另外,包括壤霉菌属(Agromyces)、博斯氏菌属(Bosea)、假黄色单胞菌属(Pseudoxanthomonas)在内的6 个菌属随着冷藏时间的延长,其相对丰度逐渐降低,到20 d消失;其余属相对丰度均小于1%。
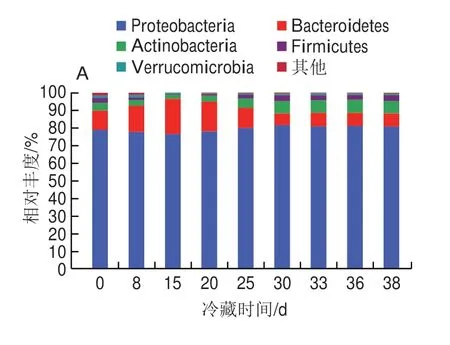
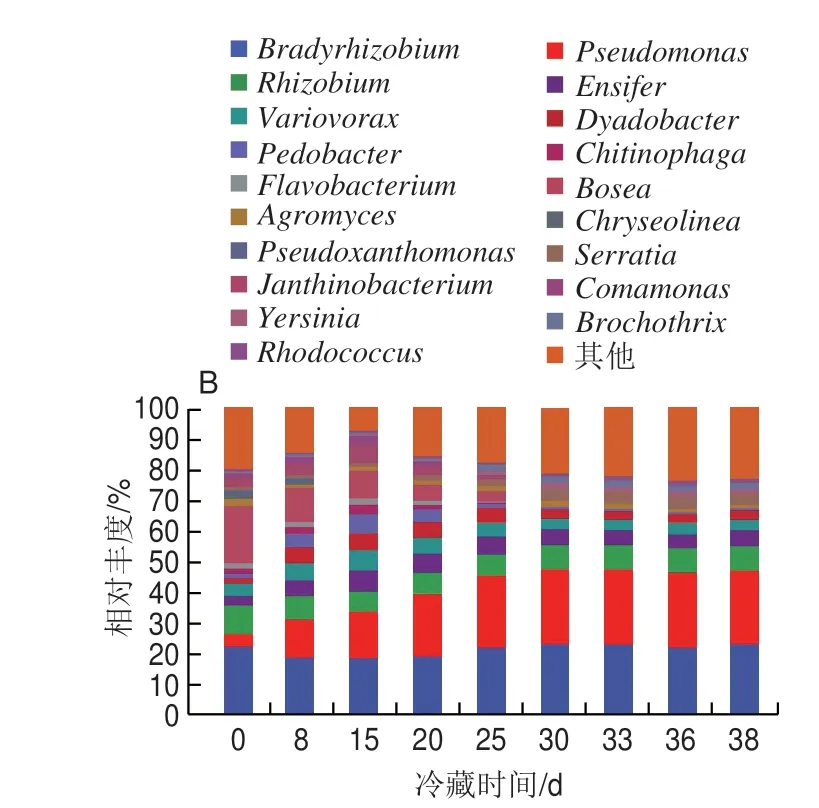
图5 样本中细菌群落在门(A)和属(B)水平上相对丰度分布Fig.5 Relative abundance of bacterial communities at phylum (A) and genus (B) level
2.5 相关性分析
相对丰度前10的细菌群落与各样本营养组分、典型性挥发性物质含量的相关性分析见图6,块菌冷藏过程中各样本分布情况为A阶段样本在0、8 d和15 d均分离,B阶段各样本在20 d和25 d重合但与30 d样本分离,而C阶段所有样本在3 个时间点几乎重合,这表明冷藏的A阶段块菌中细菌多样性更高,到了冷藏的B和C阶段细菌组成较为单一[32]。营养组分变化与细菌群落的PCA结果见图6A,样品总糖含量对细菌群落影响较大,其次是总蛋白含量和粗纤维含量,样品质量损失率影响最小;相关性方面,A阶段的总糖、总蛋白和粗纤维含量与Bosea、Janthinobacterium、Pedobacter、Dyadobacter、Variovorax、Bradyrhizobium、Ensifer与Rhizobium相对丰度呈正相关,Pseudomonas相对丰度与各样本营养组分含量呈负相关;B和C阶段时,Pseudomonas和Serratia相对丰度同各样本质量损失率呈正相关。挥发性芳香物质变化与细菌群落的PCA结果见图6B,样品挥发性芳香物质同细菌群落的相关性主要集中在冷藏的A阶段,这期间1-辛烯-3-醇、正戊酸正戊酯对细菌群落影响较大,其次是乙酸乙酯、3-甲基丁酸乙酯、2-辛酮、1-辛烯-3-酮、己醛、正己醇;上述所有芳香物质含量与Bradyrhizobium、Rhizobium、Bosea、Variovorax、Dyadobacter、Janthinobacterium、Pedobacter相对丰度均呈正相关,其中1-辛烯-3-醇、正戊酸正戊酯含量分别与Rhizobium、Bosea相对丰度有正相关性;Ensifer、Pseudomonas和Serratia相对丰度与所有挥发性芳香物质含量呈负相关。挥发性异味物质变化与细菌群落的PCA结果见图6C,样品挥发性异味物质同细菌群落的相关性主要集中在冷藏的C阶段,其中吡啶、二甲醚、3-甲基丁酸、己酸、庚醛、巴豆醇、3-甲硫基丙醇以及3-甲基-1-丁醇含量同Ensifer、Pseudomonas、Serratia相对丰度呈正相关,而与Bradyrhizobium、Rhizobium、Bosea、Variovorax、Dyadobacter、Janthinobacterium和Pedobacter相对丰度呈负相关。冗余分析(redundancy analysis,RDA)结果印证了鲜印度块菌冷藏期间所有营养组分含量、挥发性芳香物质含量的下降和异味物质含量的上升都与细菌群落存在较大的相关性,而且不同挥发性物质在不同冷藏时期关联的细菌群落不同,这也反映了不同冷藏期样品中细菌群落的差异性。

图6 块菌冷藏过程中营养组分(A)、芳香(B)和异味物质(C)变化与细菌群落属水平冗余分析结果Fig.6 Redundancy analysis of nutrition components (A),aroma compounds (B) and odor compounds (C) versus bacterial communities at genus level in fresh Tuber indium during cold storage
3 结论
通过对75%食用酒精速泡、真空包装、4 ℃冷藏期9 个时间点共27 个鲜印度块菌样品的感官评估,预测出其货架期,并对冷藏期样品的营养组分、挥发性物质和细菌群落变化及相关性进行分析,主要结论如下:1)预测得到酒精速泡处理的鲜印度块菌货架期为30 d;2)在0~38 d的冷藏期内营养组分总体变化规律为总糖相对含量由38.9%下降到30.9%,总蛋白相对含量由23.3%下降到17.1%,粗纤维相对含量由43.9%下降到36.8%,质量损失率从0 d的2.55%升到38 d的6.95%;3)冷藏期挥发性芳香物质从0 d的38 种减少到15 d的17 种,到38 d时仅有7 种存在;挥发性异味物质从块菌冷藏15 d的1 种持续增加,38 d时增加到24 种;4)细菌群落结构变化和相关性分析表明,鲜印度块菌在冷藏过程中的绝对优势菌门为Proteobacteria、Bacteroidetes、Actinobacteria、Firmicutes和Verrucomicrobia。基于属水平的RDA结果表明,在A阶段,营养组分(总糖、总蛋白和粗纤维)和特征性挥发芳香物质(1-辛烯-3-醇、正戊酸正戊酯、乙酸乙酯、3-甲基丁酸乙酯、2-辛酮、1-辛烯-3-酮、己醛以及正己醇)含量变化与Bradyrhizobium、Rhizobium、Bosea、Variovorax、Dyadobacter、Janthinobacterium以及Pedobacter相对丰度呈正相关,其中总蛋白、1-辛烯-3-醇、正戊酸正戊酯含量与Bosea相对丰度呈正相关,Pseudomonas和Serratia相对丰度同质量损失率在25 d后呈正相关;在冷藏的30~38 d,吡啶、二甲醚、3-甲基丁酸、己酸、庚醛、巴豆醇、3-甲硫基丙醇以及3-甲基-1-丁醇含量同Ensifer、Pseudomonas、Serratia相对丰度呈正相关。综合分析表明鲜印度块菌营养组分、挥发性芳香物质和异味物质在冷藏期间的不同阶段发生变化,这种变化与特定的细菌群落密切相关。该结果可为进一步深入研究鲜印度块菌腐败机制和贮藏保鲜新技术提供参考。

