过表达miR-210抑制H2O2诱导大鼠BM-MSCs成脂分化
封宝红,喻业安,晏 莉,伍 军,张艳霞,朱戈丽
武汉大学附属武汉市第三医院 肾内科, 湖北 武汉 430014
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)具有多向分化潜能,但在老年期,BM-MSCs更多地向脂肪细胞分化,可引起骨形成减少,进而导致老年性骨质疏松症[1]。目前关于BM-MSCs成脂分化相关的分子机制尚不明确,因此,探究该机制对于老年性骨质疏松症的治疗具有重要意义。研究表明,H2O2可用于诱导BM-MSCs分化,且多种miRNA参与调控H2O2诱导的BM-MSCs分化,如miR-183-5p在H2O2诱导的BM-MSCs中高表达,过表达miR-183-5p可抑制BM-MSCs成骨分化[2]。过表达miR-210可促进犬BM-MSCs向成骨方向分化[3]。此外,miR-210可参与缓解H2O2诱导产生的氧化应激损伤,改善心肌功能[4]。本研究旨在探讨miR-210对H2O2诱导的BM-MSCs成脂分化的影响以及可能的机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性SD大鼠[广州锐格生物科技有限公司,生产许可证号为SCXK(粤)2021-0059],所有动物实验均遵循3R原则且得到武汉市第三医院动物伦理委员会的批准(ZACUC20210421-14)。
1.1.2 主要试剂:30% H2O2(上海泽叶生物公司);过氧化物酶体增殖物激活受体γ(peroxisome proliferatior-activated receptor,PPARγ)、CCAAT/强子结合蛋白α(CCAAT enhancer binding protein,C/EBPα)抗体(Santa Cruz公司);抗CD29-FITC、CD44-FITC、CD45-PE-Cy5.5、CD90-PE流式抗体、兔源一抗β-连环蛋白(β-catenin)、c-Myc、细胞周期蛋白 D1(cyclin D1)、GAPDH及辣根过氧化物酶标记的羊抗兔二抗(Abcam公司)。
1.2 方法
1.2.1 BM-MSCs的分离、培养[5]:采用颈椎脱位法处死大鼠,分离股骨并暴露骨髓腔,用DMEM低糖培养基反复吹打骨髓腔,将含有骨髓的培养基加入到离心管中,1 000 r/min心10 min,弃上清,将获得细胞在37 ℃、含有5% CO2培养箱中培养,倒置显微镜观察细胞生长情况。
1.2.2 流式细胞测量术检测BM-MSCs表面抗原:取汇合度90%的P3代BM-MSCs,经消化、PBS洗涤后,1 000 r/min离心10min,弃上清,调整细胞为1×106个/mL,分为8个试管,每管加入50 μL细胞悬液,并分别加入5 μL CD29 FITC-A、CD44 FITC-A、CD90 PE-A、CD45 PE-C及对应的同型对照抗体,4 ℃下避光孵育20 min,在常温下以1 000 r/min离心10 min,弃上清,利用流式细胞仪进行检测。
1.2.3 细胞的分组及处理:取增殖状态良好的P3代BM-MSCs,利用200 μmol/L H2O2诱导1 h以构建BM-MSCs成脂分化模型[6],命名为模型组。另取正常培养的BM-MSCs为对照组。 H2O2诱导1 h后将模型组BM-MSCs进行转染,并分为mimic NC组(50 nmol/L)、miR-210 mimic组(50 nmol/L)、inhibitor NC组(100 nmol/L)、miR-210 inhibitor组(100 nmol/L),转染24 h后观察转染效果。
1.2.4 实时荧光定量PCR检测细胞中miR-210表达:用Trizol试剂提取总RNA,将RNA反转录为cDNA后,进行荧光定量PCR检测miR-210表达。以U6为内参,通过2-△△Ct法计算miR-210水平。引物序列为:miR-210正向:5′-CATAGATAGCCACTG CCCACA-3′;反向:5′-GTGCAGGGTCCGAGGTATTC-3′;U6正向:5′-CTCGCTTCGGCAGCACA-3′;反向:5′-AACGCT TTCACGAATTTGCGT-3′。
1.2.5 油红O染色检测细胞胞质内的脂肪颗粒:将细胞(1.0×105个/孔)接种到24孔板中,孵育24 h后,将细胞在4%多聚甲醛中固定20 min,用PBS洗涤两次后,在每孔中加入500 μL油红O染色工作液染色30 min,60%异丙醇洗3次,蒸馏水洗3次,苏木精染色15 s,水洗3次,封片。观察胞质内的脂肪颗粒。
1.2.6 Western blot检测蛋白表达:RIPA裂解缓冲液提取总蛋白,将总蛋白经定量、电泳、转膜、封闭,将膜与一抗PPARγ(1∶2 000)、C/EBPα(1∶1 000)、β-catenin(1∶2 000)、c-Myc(1∶1 000)、cyclin D1(1∶1 000)、GAPDH(1∶2 000)在4 ℃下孵育过夜,然后在室温下与二抗(1∶4 000)孵育1 h后,加入ECL试剂观察蛋白显影,通过软件(Image J)分析蛋白质条带吸光度值。
1.3 统计学分析
2 结果
2.1 BM-MSCs形态学观察及表面抗原鉴定
P0代细胞中混有杂细胞,经多次换液传代可去除,细胞贴壁较快,大部分呈长梭形。P3代细胞呈长梭形,形态及排列趋于一致,呈旋涡状增殖(图1)。P3代细胞高表达CD29(99.27%)、CD44(98.36%)和CD90(99.87%), 低表达CD45(5.26%)(图2)。
2.2 BM-MSCs转染效率及各组BM-MSCs 中miR-210表达比较
镜下均可见较强绿色荧光(图3)。与对照组比较,模型组BM-MSCs中miR-210水平降低(P<0.05);与模型组、mimic NC组比较,miR-210 mimic组BM-MSCs中miR-210表达升高(P<0.05);与模型组、inhibitor NC组比较,miR-210 inhibitor 组BM-MSCs中miR-210表达降低(P<0.05)(图4)。

图1 倒置显微镜观察BM-MSCs形态Fig 1 Inverted microscope to observe the morphology of BM-MSCs
2.3 miR-210对H2O2诱导BM-MSCs成脂分化的影响
与对照组比较,模型组BM-MSCs中脂肪颗粒数目升高(P<0.05);与模型组、mimic NC组比较,miR-210 mimic组BM-MSCs中脂肪颗粒数目降低(P<0.05);与模型组、inhibitor NC组比较,miR-210 inhibitor 组BM-MSCs中脂肪颗粒数目升高(P<0.05)(图5)。
2.4 H2O2诱导BM-MSCs中脂肪细胞标志物PPARγ、C/EBPα 蛋白表达比较
与对照组比较,模型组BM-MSCs中PPARγ、C/EBPα 蛋白表达升高(P<0.05);与模型组、mimic NC组比较,miR-210 mimic组BM-MSCs中PPARγ、C/EBPα蛋白表达降低(P<0.05);与模型组、inhibitor NC组比较,miR-210 inhibitor组BM-MSCs中PPAR γ、C/EBPα蛋白表达升高(P<0.05)(图6)。

Green represents marker expression, red represents isotype control IgG expression图2 流式细胞测量术检测BM-MSCs表面抗原Fig 2 Detection of BM-MSCs surface antigen by flow cytometry
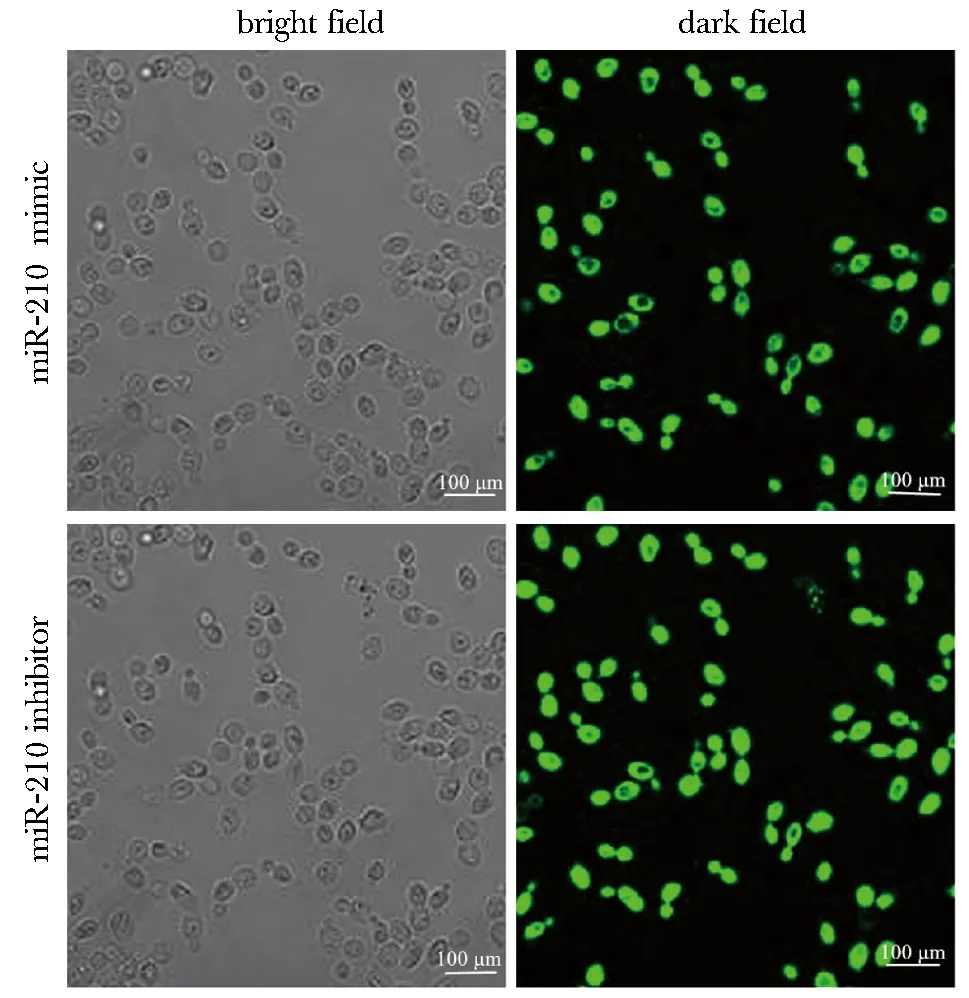
图3 细胞转染结果Fig 3 Results of cell transfection

*P<0.05 compared with control group; #P<0.05 compared with model group; ▲P<0.05 compared with mimic NC group;△P<0.05 compared with inhibitor NC group图4 miR-210在各组细胞中的表达Fig 4 Expression of miR-210 in each group of cells

*P<0.05 compared with control group; #P<0.05 compared with model group; ▲P<0.05 compared with mimic NC group;△P<0.05 compared with inhibitor NC group
2.5 H2O2诱导BM-MSCs中Wnt/β-catenin通路相关蛋白表达比较
与对照组比较,模型组BM-MSCs中β-catenin、c-Myc、cyclin D1蛋白表达降低(P<0.05);与模型组、mimic NC组比较,miR-210 mimic组BM-MSCs中β-catenin、c-Myc、cyclin D1蛋白表达升高(P<0.05);与模型组、inhibitor NC组比较,miR-210 inhibitor 组BM-MSCs中β-catenin、c-Myc、cyclin D1蛋白表达降低(P<0.05)(图7)。
3 讨论
多项研究表明,间充质干细胞对CD29、CD44、CD90呈阳性,而对CD45呈阴性,抗原CD29、CD44、CD45、CD90的表达是评估BM-MSCs纯度的重要标准之一[7]。本研究发现P3代BM-MSCs高表达CD29、CD44和CD90,低表达CD45,符合BM-MSCs的特征。氧化应激使细胞产生大量的自由基,过量自由基会导致细胞衰老,本研究通过H2O2诱导引发细胞功能异常,促进细胞脂滴形成,以构建BM-MSCs成脂分化模型,结果显示模型组BM-MSCs中脂肪颗粒数目升高,提示BM-MSCs成脂分化模型构建成功。PPARγ和C/EBPα是细胞成脂分化的关键调节因子,其可通过协同作用来调节3T3-L1前脂肪细胞向脂肪细胞分化,且PPARγ和C/EBPα表达减弱可缓解H2O2诱导引发的损伤,抑制内脂滴的形成[8];本研究显示,模型组BM-MSCs中PPARγ、C/EBPα蛋白表达升高,再次证明BM-MSCs成脂分化模型构建成功。

*P<0.05 compared with control group; #P<0.05 compared with model group; ▲P<0.05 compared with mimic NC group;△P<0.05 compared with inhibitor NC group

*P<0.05 compared with control group; #P<0.05 compared with model group; ▲P<0.05 compared with mimic NC group;△P<0.05 compared with inhibitor NC group
miRNA可调节多种生物学过程,如细胞分化、增殖和凋亡等。据报道,过表达miR-330-5p可抑制H2O2诱导的BM-MSCs成脂分化[9];miR-210的过表达促进兔BM-MSCs 成骨分化并抑制成脂分化[10]。本研究结果与其一致:miR-210在模型组BM-MSCs中低表达,表明H2O2可引起miR-210水平降低,低水平miR-210可能与H2O2造成活性氧增多、过氧化反应增强进而对细胞造成的损伤有关;过表达miR-210后模型组BM-MSCs中脂肪颗粒数目降低,而抑制miR-210表达后则呈相反趋势,提示过表达miR-210可抑制H2O2诱导后BM-MSCs的成脂分化。
Wnt/β-catenin是一种在进化上保守的信号通路,其在调节胚胎发育和组织稳态方面至关重要。有研究发现,灌服骨碎补水煎液可以抑制去卵巢大鼠BM-MSCs成脂分化,其机制与激活Wnt/β-catenin通路有关[11];卡马西平通过抑制Wnt/β-catenin通路增强脂肪生成[12]。本研究显示,上调miR-210表达后模型组BM-MSCs中β-catenin、c-Myc、cyclin D1蛋白表达升高,而抑制miR-210表达后模型组BM-MSCs中相应蛋白表达降低,提示过表达miR-210可抑制H2O2诱导的BM-MSCs成脂分化,该机制可能与激活Wnt/β-catenin 通路有关。

