外用皮质类固醇预防放射性皮炎效果的meta分析*
任玉芳,向玉云,唐 清,羊 洋,王国蓉
(1.电子科技大学医学院,成都 610051;2.四川省肿瘤医院护理部,成都 610041)
放射性皮炎是放疗中常见的不良反应之一,发生率可达95%[1-2],一般在放疗开始后2~3周内出现,并在放疗结束后持续4~5周[3]。轻度放射性皮炎的表现主要为瘙痒、灼热、色素沉着,重度表现为溃疡、坏死、感染等,严重的反应甚至会导致放疗中断,增加患者的身心负担[4]。目前针对放射性皮炎的预防和治疗已经存在较多的研究[4-7],但是多数的研究都缺乏有力的支持[8]。外用皮质类固醇(topical corticosteroids,TCS)是指任何含有皮质类固醇的乳膏、喷雾或者溶液等,也是被推荐用于预防和治疗放射性皮炎的方法之一,其抗炎作用主要是通过收缩血管、降低毛细血管通透性、抑制白细胞增殖和迁移来实现的[9]。2017年HARUNA等[10]的一项纳入919例乳腺癌放疗患者的meta分析显示,TCS使患者湿性脱皮的风险大约降低5倍,但是该研究包括了TCS与其他药物一起使用的情况,这可能对皮质类固醇的作用产生一定的影响。虽然相关指南也推荐可以使用TCS来预防和治疗放射性皮炎,但是该指南的证据总结是基于乳腺癌患者的研究[11],因此TCS在减少其他肿瘤患者放射性皮炎上的有效性不明。本研究系统评价TCS在预防放射性皮炎中的作用,旨在为临床放射性皮炎的预防提供参考依据。
1 资料与方法
1.1 纳入及排除标准
纳入标准:(1)随机对照试验(RCT);(2)病理学诊断为肿瘤患者且需要接受放疗,年龄>18岁;(3)试验组只以TCS为干预措施,可以是乳膏、喷雾、溶液等,对照组可以采用其他药物、安慰剂药膏或空白对照等,干预时间从放疗第1天开始使用;(4)主要结局指标为≥3级放射性皮炎或湿性脱皮的发生率,次要结局指标为放射性皮炎的主观报告症状如瘙痒、疼痛等。排除标准:(1)无法获取全文;(2)非中、英文文献;(3)干预方法陈述不明确;(4)数据无法提取。
1.2 文献检索
采用主题词加自由词的方法,检索中国知网、万方、维普、PubMed、Cochrane Library、Web of Science、Embase、CINHAL数据库中的所有相关文献。英文检索(“Radiodermatiti*” OR “Radiation Induced Dermatitis” OR “Dermatiti*,Radiation Induced” OR “Radiation-Induced Dermatiti*” OR “Radiation Recall Dermatitis” OR “Dermatiti*,Radiation Recall” OR “Radiation Recall Dermatiti*” OR “Radiation Recall Reaction*” OR “Reaction*,Radiation Recall” OR “Recall Reaction*,Radiation” OR “Acute radiation skin injury”) AND (“Steroid*” OR “corticosteroid” OR “Catatoxic Steroids” OR “Betamethasone” OR “Dexamethasone” OR “Hexadecadrol” OR “Dexasone” OR “Oradexon” OR “Hexadrol” OR “Flumethasone” OR “Fluocinolone Acetonide” OR “Paramethasone” OR “Triamcinolone”);中文检索(“放射性皮炎”OR“放射性皮肤损伤”OR“急性放射性损伤”)AND(“类固醇”OR“糖皮质激素类”OR“激素类”OR“地塞米松”OR“倍他米松”),时间不限。
1.3 文献筛选与数据提取
由2名研究者根据纳入和排除标准独立进行文献阅读,筛选出符合标准的文献,再根据需要提取资料信息并核对,如有分歧则请第3位研究者进行裁定。提取的资料信息包括:作者、发表年份、国家、肿瘤类型、样本量、干预方法、放疗的剂量等。
1.4 文献质量评价
对符合纳入标准的文献,由2名研究者根据系统评价的Cochrane 手册-5.1.0 版对纳入的研究进行独立评价,评价内容包括:随机方法、分配隐藏、盲法、结局指标数据的完整性、选择性报告结果及其他偏倚,对于存在分歧的由第3名研究者进行裁定。
1.5 统计学处理
采用RevMan5.3软件对数据进行统计分析。当P>0.05,I2<50%时,可认为各研究间具有同质性,选用固定效应模型;P<0.05,I2≥50%时,表示异质性较大,则采用随机效应模型,亚组分析或敏感性分析判断异质性来源。计量资料采用加权均数差(MD)及95%CI表示,计数资料采用相对危险度(OR)及95%CI表示。
2 结 果
2.1 文献检索结果
共检索出文献3 270篇,英文文献3 167篇,中文文献103篇,最终符合纳入标准的文献有12篇[12-23]。文献筛选流程见图1。

图1 文献筛选流程图
2.2 纳入文献的基本特征及方法学质量评价
纳入文献的基本特征,见表1。纳入的12项研究中8项研究[13-18,20,22]介绍了随机分组的方法,9项研究[13-15,17-18,20-23]使用了分配隐藏,6项研究[13,17-18,20-22]使用了盲法。方法学质量评价见图2和表2。

图2 文献质量评价结果
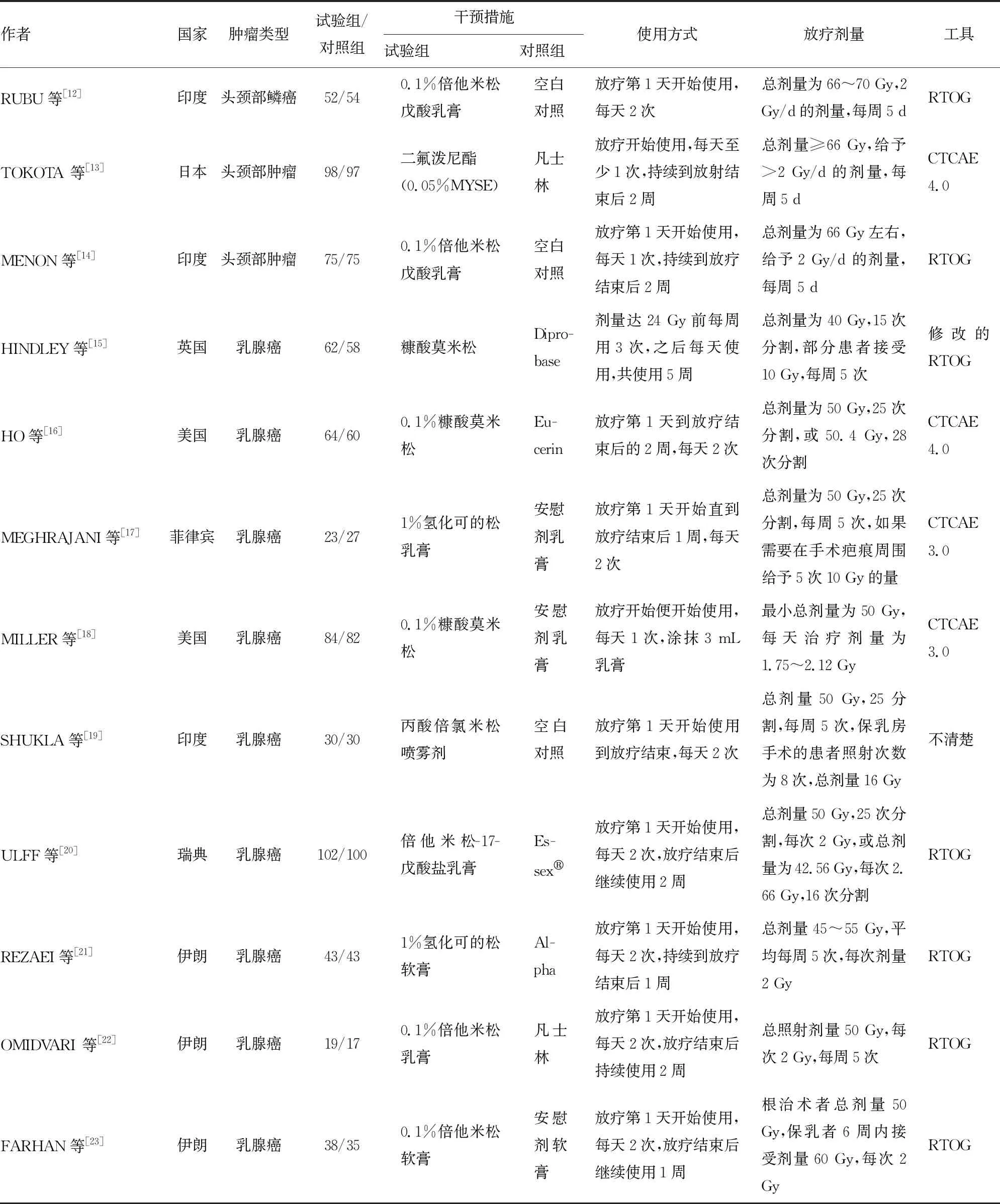
表1 纳入研究的基本特征
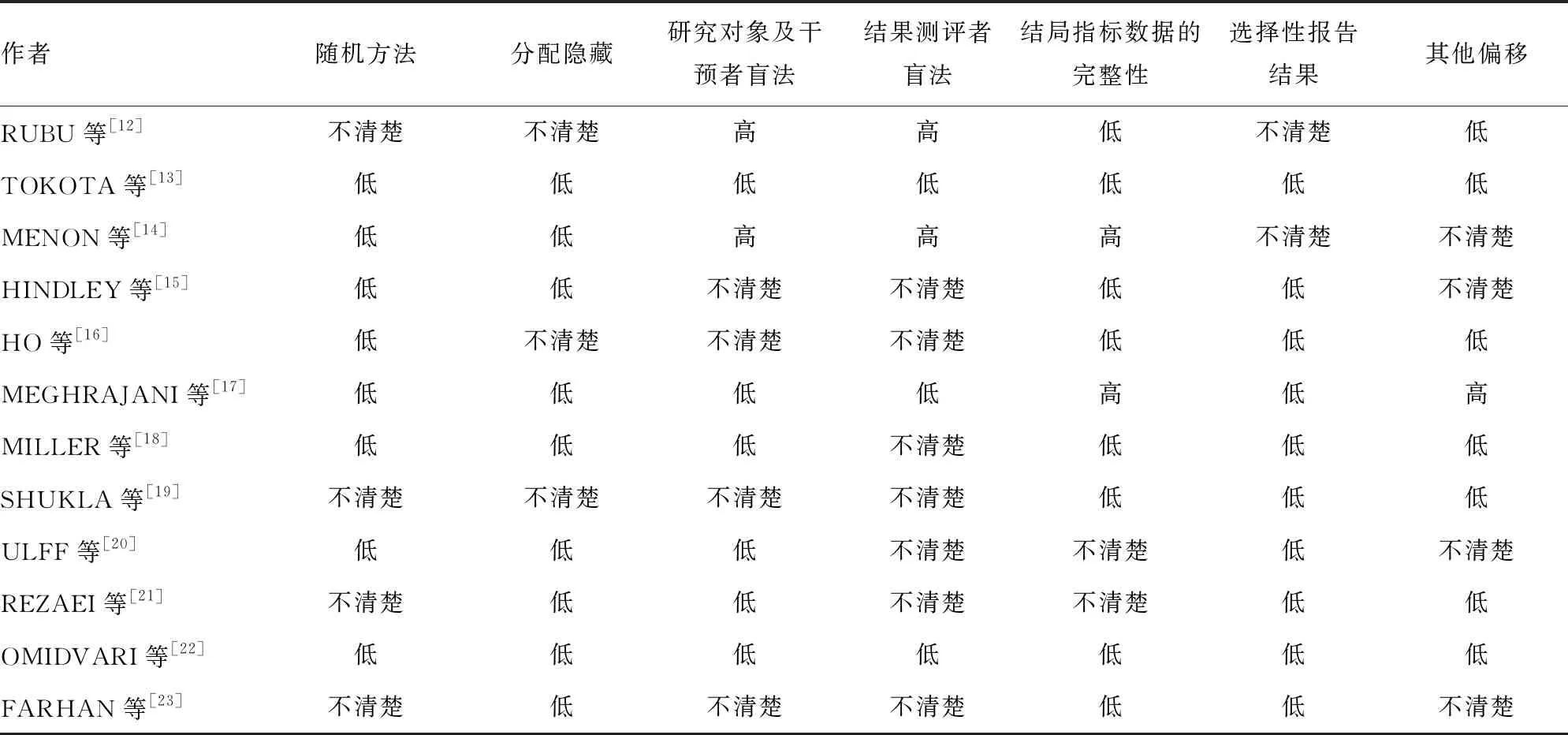
表2 纳入文献的质量评价
2.3 主要结局指标的meta分析
12项研究[12-23]报道了TCS对≥3级放射性皮炎或湿性脱皮的影响,最终共纳入1 368例研究对象,试验组690例,对照组678例。各研究间不存在异质性(P=0.29,I2=16%),选用固定效应模型。结果显示,与对照组相比,试验组TCS能改善放疗患者≥3级放射性皮炎或湿性脱皮的发生(P<0.05),见表3。
考虑到不同的研究对象可能会对研究结果产生影响,因此进行亚组分析。结果显示,乳腺癌亚组与对照组比较,≥3级放射性皮炎或湿性脱皮的发生率差异有统计学意义(P<0.05),而头颈部肿瘤亚组与对照组比较差异无统计学意义(P>0.05),见表3。
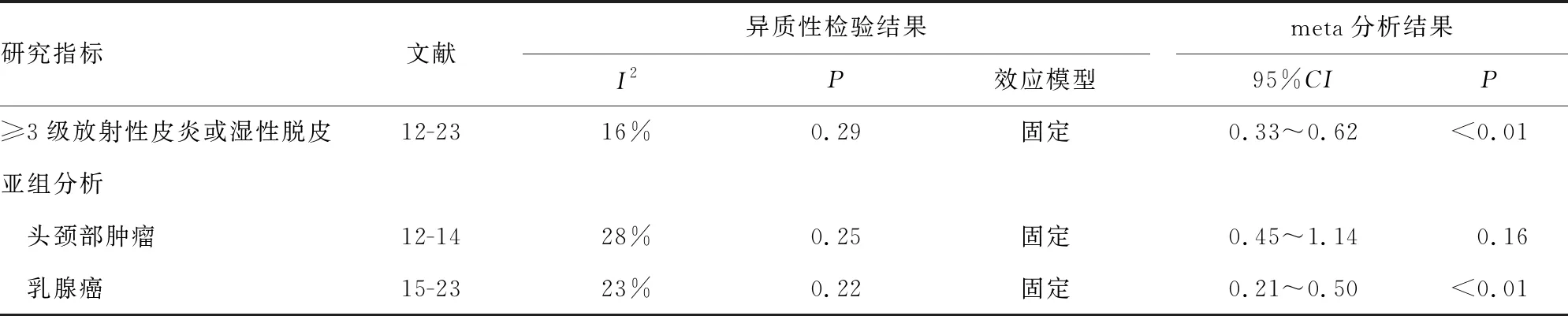
表3 TCS对≥3级放射性皮炎或湿性脱皮发生率的影响
2.4 次要结局指标的结果分析
8项研究[12-14,17-18,20-21,23]报告了患者的主观症状即瘙痒、疼痛和烧灼感。5项研究[17-18,20-21,23]结果表示,与对照组相比,试验组TCS的使用能减少乳腺癌患者的瘙痒症状,但是另外3项[12-14]关于头颈部肿瘤的研究则表示,TCS并不能减少瘙痒症状。同时纳入的6项研究[12,14,17-18,21,23]显示,TCS的使用不能减少放疗所引起的疼痛,见表4。

表4 患者主观症状报告
2.5 敏感性分析
对主要观察指标进行敏感性分析,采用逐一剔除法,重新估计合并效应量。结果显示,异质性无明显变化,上述研究结果有较好的稳健性。
2.6 发表偏移
采用漏斗图对纳入的12项研究[12-23]进行发表偏移分析,结果显示漏斗图较对称,初步判断偏移较小,研究结果较可靠,见图3。

图3 ≥3级放射性皮炎或湿性脱皮发生的漏斗图
3 讨 论
放射性皮炎的机制是由高能量射线直接损伤人体表皮细胞DNA分子单链或双链引起细胞突变,进而引起的一系列皮肤反应和损伤[24-25],其发展过程一般从轻度红斑到干性脱皮再到湿性脱皮,其中≥3级放射性皮炎是导致放疗中断最主要的原因[26]。本研究结果显示,预防性使用TCS可以减少肿瘤患者≥3级放射性皮炎或湿性脱皮的发生,此结论与相关研究结果相一致[10,27]。
但是亚组分析结果显示,TCS不能减少头颈部肿瘤患者≥3级放射性皮炎或湿性脱皮的发生,此研究结果可能与头颈部肿瘤患者发生≥3级放射性皮炎的概率较低(≤10%)[28],同时纳入的研究对象只有451例有关。但是纳入的3项研究中有1项[13]明确表示降低了头颈部肿瘤患者≥3级放射性皮炎或湿性脱皮的发生(P=0.034),另外2项研究表示虽然没有降低发生率,但是推迟了发生和进展。以上研究结果提示,TCS在预防头颈部肿瘤放射性皮炎的发生上可能也有一定作用,但是未来尚需要较多的高质量研究以验证。通常乳腺癌的照射剂量为50~60 Gy,而头颈部肿瘤患者的照射剂量在60~70 Gy,且与铂类化疗药物同步使用,因此这也可能是造成TCS在乳腺癌和头颈部肿瘤患者中对放射性皮炎效果不同的原因。因此未来的研究需要关注TCS在其他肿瘤中的作用,如宫颈癌、外阴癌[29]等。同时在使用TCS的时候也要考虑长期使用会不会给患者带来相关的不良反应,虽然纳入的研究表示,头颈部肿瘤放疗患者TCS的使用并没有延缓患者的伤口愈合和增加局部感染的风险,但是缺乏长期的随访研究。
放射性皮炎的患者主观报告症状主要包括瘙痒、疼痛和烧灼感[30]。本研究结果显示,与对照组比较,TCS的使用能减少乳腺癌患者的瘙痒症状,此结论与相关研究结果一致[10]。但是其中3项关于头颈部肿瘤患者[12-14]的研究则显示,TCS的使用并不能减少瘙痒症状,虽然TOMOYA等[13]表示TCS的使用瘙痒症状患者的比例从13%下降到8%,但是差异无统计学意义。同时有6项研究[12,14,17-18,21,23]结果表示,与对照组比较,TCS不能减少患者疼痛症状,此结论与相关研究一致[10]。但是目前关于患者主观症状的评估工具,除了有视觉模拟量表、放射性皮肤反应评估量表外,还包括CTCAE的相关版本等,因此不能将研究结果纳入meta进行量性分析,基于此情况未来尚需要较多的研究以验证TCS在放射性皮炎主观报告症状中的作用。
本研究最终只纳入了头颈部肿瘤和乳腺癌患者,因此未来需要更多的研究以验证TCS在减少其他肿瘤患者放射性皮炎发生上的作用;同时,虽然研究表示头颈部肿瘤患者在放疗期间局部长期使用皮质类固醇并没有增加感染的风险和带来其他不良反应,但是目前缺乏长期的随访研究。

