沙葱萤叶甲GdHsp70-2,GdHsp70-3的克隆鉴定与表达谱分析
张宏玲, 任 浩, 田 羽, 单艳敏,王 莹, 李 玲, 李艳艳, 庞保平, 谭 瑶*
(1.内蒙古农业大学草原昆虫研究中心,内蒙古 呼和浩特 010019;2.镶黄旗草原工作站,内蒙古 镶黄旗 013250;3.内蒙古自治区林业和草原有害生物防治检疫总站,内蒙古 呼和浩特 010051;4.鄂尔多斯市自然资源局康巴什区分局,内蒙古 鄂尔多斯 017010)
沙葱萤叶甲(Galerucadaurica)属鞘翅目叶甲科,近十年来在内蒙古草原暴发成灾,主要危害百合科植物如野韭(Alliumramosum)、多根葱(Alliumpolyrhizum)、沙葱(Alliummongolium)等[1]。据调查,该虫分布于西伯利亚、蒙古高原、朝鲜半岛及中国北方多地,其一年发生1代,以卵在石块、牛粪底部越冬,于4月初开始孵化,幼虫共3龄,6月中旬开始羽化为成虫并蛰伏越夏,9月上旬解除滞育,开始取食、交配并产卵[2]。沙葱萤叶甲通过成虫滞育越夏、卵滞育越冬,以适应草原夏季极端高温、严冬极端低温的生境[2]。沙葱萤叶甲幼虫大量取食野生沙葱,致使草场植被遭到严重破坏,生产力显著下降,对当地生态环境和畜牧业可持续发展构成了严重威胁[3-4]。目前,研究者们已对沙葱萤叶甲的生长发育与遗传多样性[5-7],滞育机制及调控机理[8-11],化学生态系统[12-13],杀虫剂筛选与应用[14-15],抗寒适应性及其分子机理[16-22]等多方面开展了系统研究,为沙葱萤叶甲的绿色综合防控研究奠定了基础。
热激蛋白(Heat shock proteins,HSPs)普遍存在于所有生物体中,是一类在进化上高度保守的蛋白[23],负责在机体受逆境胁迫后保护蛋白、多肽,促进变性蛋白质修复以维持细胞稳态[24]。当昆虫受到极端温度、重金属污染、干燥、缺氧、紫外线辐射等外界刺激后,其体内HSPs可迅速合成或表达量升高[25-26]。根据相对分子质量和同源性,HSPs被分为HSP100家族、HSP90家族、HSP70家族、HSP60家族、HSP40家族和小分子HSPs(sHSPs)六个家族[27]。HSP70作为生物体内最保守的热激蛋白家族,主要存在于细胞质、线粒体和内质网基质中[28-29],依据其诱导表达特性,可分为组成型HSC70(Heat shock cognate protein 70)和诱导型HSP70(Heat shock protein 70)[30]。其中HSC70的表达相对稳定,而HSP70在各种应激条件下能迅速表达,但需要HSP40 作为协同伴侣形成“HSP70/HSP40复合物系统”共同发挥作用[31]。在生物体中不同HSP70家族成员既有相似的功能,也有各自特定功能,HSP70家族在家蚕(Bombyxmori)全基因组中被鉴定后,Fang等对其进行分类及系统发育分析,并测得在热(37℃和42℃)和冷(2℃)胁迫下,Hsp70-1,Hsp70-2和Hsp70-3的表达均上调[32];而烟粉虱(Bemisiatabaci)经40℃热处理4 h后BtHsp70-4,BtHsp70-5,BtHsp70-6,BtHsp70-11,BtHsp70-12,BtHsp70-13基因表达量上调,但在4℃的低温处理下,除BtHsp70-10外其余Hsp70基因都被强烈诱导[33];同样,白背飞虱(SogatellaFurcifera)在UV-A胁迫下,除Hsp70-2的表达显著下调外,Hsp70-3,Hsp70-4,Hsp70-5和Hsp70-6的表达显著上调[34]。这均表明昆虫Hsp70基因在参与应对不同环境胁迫的反应中涉及的功能不同。
前期研究已证明沙葱萤叶甲在越冬虫态及低温驯化下,编码HSP60蛋白(GdHsp60)和诱导型HSP70蛋白(GdHsp70)的基因显著高表达[18-19],且通过RNAi沉默GdHsp60和GdHsp70基因表达显著降低了沙葱萤叶甲幼虫的抗寒能力[20]。进一步研究发现在克隆沙葱萤叶甲GdHsp70-1时,其5'端部分序列与已注册序列无法匹配,通过比对序列信息,推测该基因可能存在可变剪接。本实验应用cDNA末端快速扩增技术,对假定为GdHsp70-1的剪接异构体GdHsp70-2进行扩增测序,以明确该基因的序列信息,并进行表达谱分析;同时,对沙葱萤叶甲转录组数据中另一条注释为Hsp70的基因GdHsp70-3进行全长克隆及表达谱分析;还以沙葱萤叶甲DNA为模板对GdHsp70-2,GdHsp70-3基因组序列结构进行分析。研究结果将为深入开展HSP70在沙葱萤叶甲生长发育及抗寒性中的功能研究奠定基础。
1 材料与方法
1.1 供试昆虫的饲养
2020年9月在内蒙古锡林郭勒镶黄旗草原(44°62′ N,115°80′ E)采集沙葱萤叶甲越冬卵,待滞育期结束后转移至温度(25±1)℃、相对湿度70%±5%、光周期14L∶10D的人工气候箱(PRX-350C,宁波海曙赛福实验仪器厂)中培养使其孵化,并以室外种植的新鲜韭菜叶片为食料进行饲养。
1.2 研究方法
1.2.1沙葱萤叶甲总RNA的提取和cDNA的合成 取沙葱萤叶甲各龄期样品20 mg,混合后按照RNAiso Plus(9108Q,TaKaRa)试剂盒说明书提取总RNA,并通过超微量分光光度计和1%琼脂糖凝胶电泳检测总RNA的浓度及质量;使用反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser(6210A,TaKaRa)将RNA反转录合成cDNA,于-20℃保存备用。
1.2.2沙葱萤叶甲GdHsp70-2,GdHsp70-3基因的克隆 根据扩增GdHsp70(Genbank登录号:KY460462)得到的测序结果和转录组中注释为Hsp70的序列信息,使用Primer 5.0软件分别设计GdHsp70-2、GdHsp70-3中间片段的上、下游引物(表1),以1.2.1节中合成的沙葱萤叶甲cDNA为模板进行PCR扩增,PCR反应体系参照说明书。PCR反应条件:94℃ 3 min;94℃ 30 s,58℃ 60 s,72℃ 2 min,循环30 次;72℃ 10 min。PCR产物经1.0%的琼脂糖凝胶电泳检测,分离出目的条带,将其连接至pMD19-T(6013,TaKaRa)载体上,并转化到大肠杆菌感受态细胞DH5α(CB101,TIANGEN)中培养,筛选出阳性克隆送往生工生物公司(北京)进行序列测定。测序结果输入在线网站BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性分析。根据测序结果按SMARTer RACE 5′/3′ Kit(634858,634859,TaKaRa)说明书要求设计3′与5′的特异性引物(表1),并采用降落PCR和巢式PCR方法进行5′和3′末端克隆,得到沙葱萤叶甲GdHsp70-2,GdHsp70-3的cDNA全长序列。

表1 GdHsp70-2和GdHsp70-3基因全长克隆和荧光定量PCR引物
1.2.3序列分析及系统发育树构建 对沙葱萤叶甲GdHsp70-2,GdHsp70-3的全长序列进行生物信息学分析并构建系统发育树,所用软件名称及网址如表2所示[35-36]。

表2 基因生物信息学分析所用软件
1.2.4沙葱萤叶甲基因组DNA提取及GdHsp70-2,GdHsp70-3的内含子克隆与分析 收集沙葱萤叶甲羽化第3天的成虫100 mg,采用通用型基因组DNA提取试剂盒(DP304,TIANGEN),提取沙葱萤叶甲基因组总DNA。根据1.2.2克隆得到GdHsp70-2,GdHsp70-3的cDNA序列设计引物(表1),以沙葱萤叶甲总DNA为模板进行基因组分段克隆,PCR反应体系与反应条件同1.2.2。运用软件DNAstar(Version 11.0)对测序结果进行拼接,并通过在线网站GSDS(http://gsds.gao-lab.org/)将拼接后的序列与来自全基因组序列比对,分析内含子序列信息。
1.2.5GdHsp70-2,GdHsp70-3的表达谱分析 对沙葱萤叶甲各发育时期及不同组织中GdHsp70-2,GdHsp70-3的表达规律进行研究。不同生育期选取各龄期蜕皮3日龄的沙葱萤叶甲虫体,每个时期取虫20头;不同组织选取3日龄沙葱萤叶甲成虫的头(含触角)、胸、腹、足(前、中、后足)、翅(前、后翅),雌雄虫各30头。根据沙葱萤叶甲GdHsp70-2,GdHsp70-3的全长序列,采用在线软件Primer 3.0(https://bioinfo.ut.ee/primer3-0.4.0/)设计荧光定量PCR引物(表1),选择沙葱萤叶甲琥珀酸脱氢酶(Succinate dehydrogenase,SDHA)基因作为内参基因[37]。q-PCR反应体系按照GoTaq®qPCR Master Mix(A6001,Promega)说明书进行配置。使用q-PCR仪(FTC-3000,Funglyn Biotech,加拿大)进行测定,反应程序:95℃预变性10 min;95℃变性15 s,60℃退火1 min,72℃延伸30 s,40个循环。采用2-△△Ct法进行相对定量分析[38],利用SPSS 26.0软件对实验数据进行差异显著性比较分析。
2 结果与分析
2.1 沙葱萤叶甲GdHsp70-2和GdHsp70-3的克隆与序列分析
以沙葱萤叶甲的GdHsp70-1基因作为模板,通过中心片段克隆及cDNA末端快速扩增技术,扩增获得130 bp的5′端序列和一段683 bp未知序列,通过测序及同源性鉴定,认为该序列属于GdHsp70-1的剪接异构体,命名为GdHsp70-2(Genbank登录号为MZ853083)。GdHsp70-2基因全长2 410 bp,开放阅读框(Open reading frame,ORF)长1 974 bp,5′非翻译区为130 bp,3′非翻译区为306 bp,包含PolyA尾巴;编码657个氨基酸,蛋白质分子量为72.90 kD,等电点(Isoelectric point,pI)为5.07;无跨膜区,5′端含有信号肽区域,位于第1~54位残基(ATGAGGTTATATC TAAGTT TTGGTTGTGCTGCTGCTCTTAGCCAGCGTC CTGGCT),蛋白质亚细胞定位预测GdHsp70-2主要位于细胞质内;具有3个HSP70家族特征序列,分别位于第9~16位残基(IDLGTTYS),第197~209位残基(IFDLGGGTFDVSLL),第334~348位残基(IVLVGGSTRIPKVQQ),含有一个内质网特征元件,位于第629~632位残基(RDEL)(图1)。

图1 沙葱萤叶甲GdHsp70-2的碱基序列及其推导的氨基酸序列
以沙葱萤叶甲转录组数据中一条注释为Hsp70的基因作为模板,通过中心片段克隆及cDNA末端快速扩增技术,克隆获得沙葱萤叶甲GdHsp70-3(Genbank登录号为:OK585088),其基因全长为2 242 bp,包含131 bp的5′端序列和一段170 bp的3’端序列,开放阅读框(ORF)长1 941 bp,编码646个氨基酸,蛋白质分子量为71.11 kD,等电点(pI)为5.59;未预测到跨膜区与信号肽,蛋白质亚细胞定位预测GdHsp70-3主要位于细胞核与细胞质基质内;具有3个HSP70家族特征序列,分别位于第9~16位残基(IDLGTTYS),第197~210位残基(IFDLGGGTFDVSLL),第335~349位残基(IVLVGGSTRIPKVQQ)(图2)。

图2 沙葱萤叶甲GdHsp70-3的碱基序列及其推导的氨基酸序列
2.2 沙葱萤叶甲GdHSP70-2和GdHSP70-3的蛋白质结构分析
利用在线分析网站SOPMA预测沙葱萤叶甲GdHsp70-2与GdHsp70-3的蛋白质二级结构,GdHSP70-2中α-螺旋(Alpha helix)占43.23%,β-折叠(Beta turn)占7.61%,无规则卷曲(Random coil)占30.59%,延伸链(Extended strand)占18.57%;GdHSP70-3中α-螺旋占41.18%,β-折叠占6.97%,无规则卷曲占33.28%,延伸链占18.58%。应用SWISS-MODEL工具建模,预测了沙葱萤叶甲GdHSP70-2与GdHSP70-3的蛋白三维结构。GdHSP70-2以牛热激同源蛋白HSC70(aa1-554)E213A/D214A突变体的晶体结构(SMTL ID:7o6r.1.A)为模板建模,相似性为66.48%(图3A);GdHSP70-3以牛热激同源蛋白hsc70(aa1-554)E213A/D214A的晶体结构为模板建模(SMTL ID:4fl9.1.A),相似性为78.16%。并且GdHSP70-2与GdHSP70-3的三维结构高度一致(图3B),均由N端ATPase功能域和C端底物结合功能域所组成。
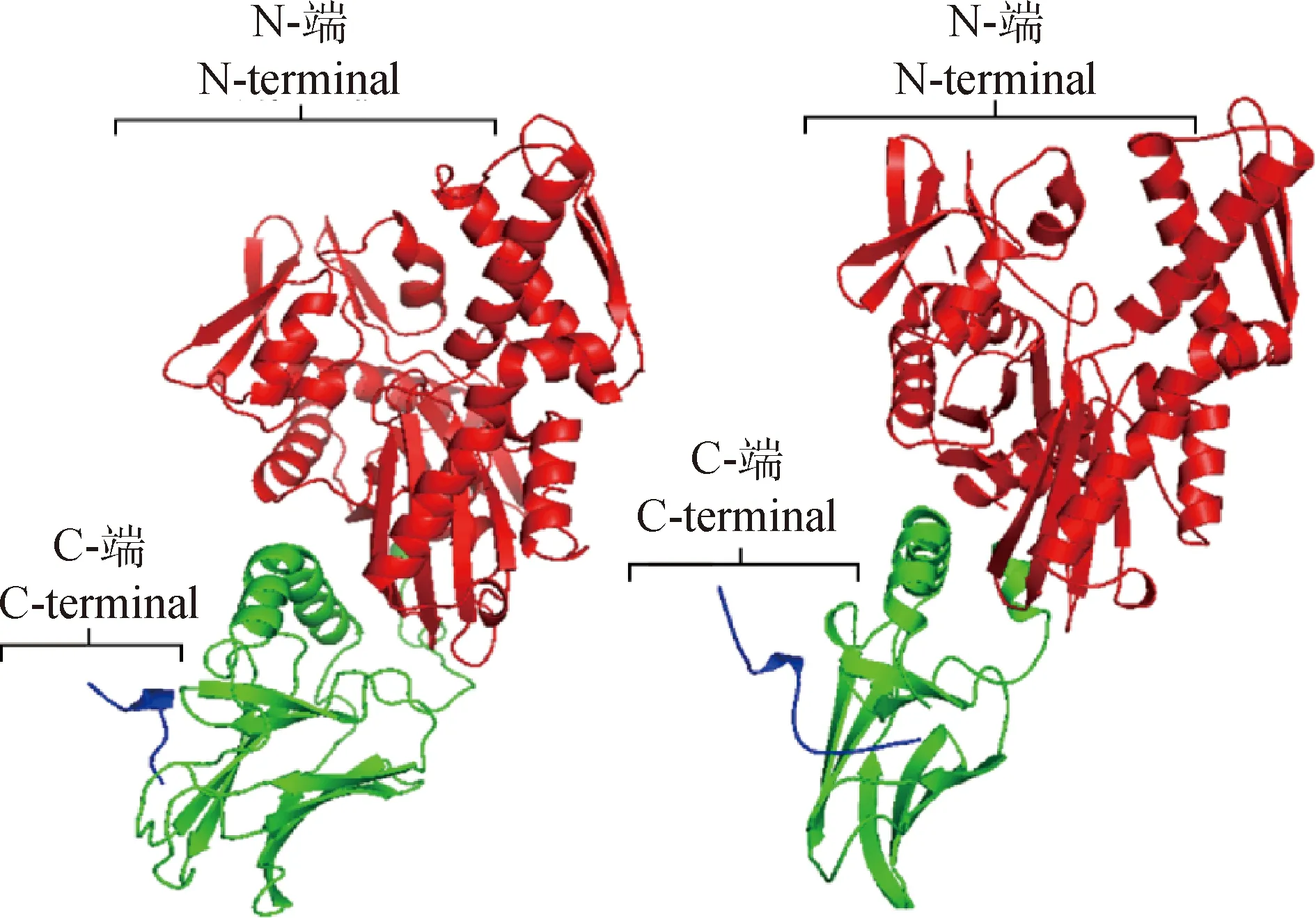
图3 沙葱萤叶甲GdHSP70-2(A)与GdHSP70-3(B)的三维结构预测模型
2.3 沙葱萤叶甲GdHSP70-2,GdHSP70-3同源比对及系统进化分析
为检测不同昆虫种间HSP70的亲缘关系,将推导出的沙葱萤叶甲GdHSP70-2和GdHSP70-3氨基酸序列,与NCBI数据库中不同目昆虫的HSP70 氨基酸序列共同构建NJ系统进化树。如图4所示,GdHSP70-2和GdHSP70-1位于同一分支,GdHSP70-2与同为鞘翅目的松墨天牛MonochamusalternatusMaltHSC70-1(GenBank登录号:QTA73204.1)亲缘关系最近,氨基酸序列相似性为91.58%;而GdHSP70-3属于另一分支,与玉米根萤叶甲DiabroticavirgiferavirgiferaDvirHSP70-2(GenBank登录号:XP_028129506.1)亲缘关系最近,氨基酸序列相似性为88.77%。已测得的3条沙葱萤叶甲Hsp70的氨基酸序列一致性为79.21%,且HSP70家族标签序列在不同昆虫种中高度一致(图5)。
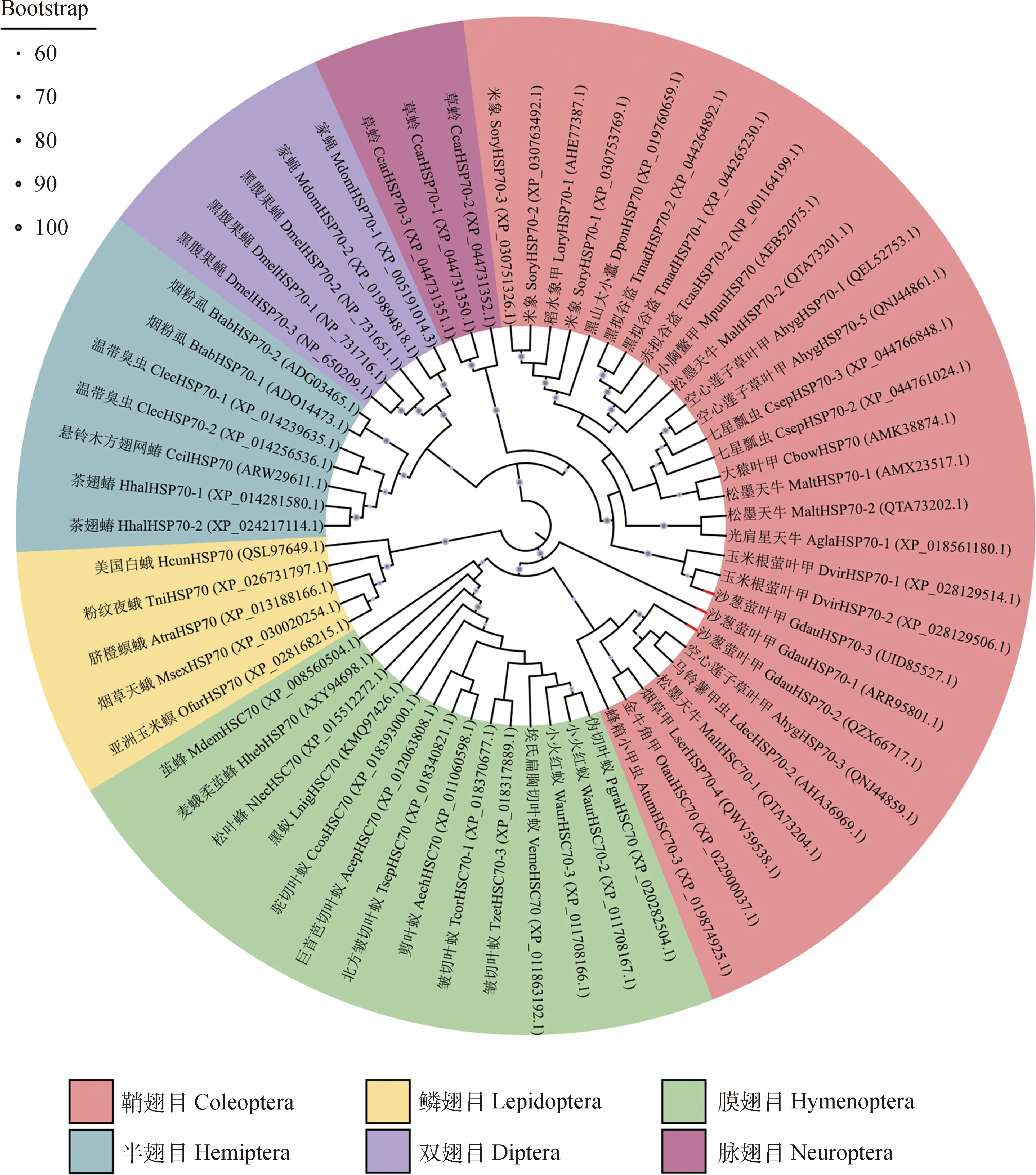
图4 基于昆虫HSP70与沙葱萤叶甲HSP70的氨基酸序列构建的系统进化树

图5 基于昆虫HSP70与沙葱萤叶甲HSP70的氨基酸序列比对分析
2.4 沙葱萤叶甲GdHsp70-2,GdHsp70-3基因组DNA的结构分析
根据已经获得的GdHsp70-2,GdHsp70-3基因cDNA序列,设计引物进行基因组全长扩增,获得了GdHsp70-2,GdHsp70-3的DNA序列,经分析发现GdHsp70-2基因含有两段内含子插入(图6),分别位于开放阅读框996~1 060位碱基(GTTAGTTCACAAG AAACTTTAATATTTTAAA CTCGTTATTTACGATTTTATTAATTTATTT TAG)与1 337~1 397位碱基(GTAAGTTATTAC AATAAAAAAGTTTTTGTACAA AAAA-ACTAATTTAATTCTTAATTTCAG),A+T含量分别为81%与83%。而GdHsp70-3基因不含内含子,如图6所示,其中大多数Hsp70基因同样不含有内含子序列。
为了进一步了解昆虫Hsp70基因家族成员之间的进化关系,在基因组系统发育分析的基础上对其基因结构进行比较。图6显示了Hsp70可以分为四组,均具有较高的自展值,已测得的3条沙葱萤叶甲Hsp70序列均属于同一分支,其中GdHsp70-2与GdHsp70-1亲缘关系最近,而GdHsp70-3与玉米根萤叶甲DvHsp70-2(GenBank登录号:XM_028273705.1)亲缘关系最近。

图6 沙葱萤叶甲等昆虫Hsp70基因的系统发育关系及基因结构分析
2.5 沙葱萤叶甲GdHsp70-2,GdHsp70-3在不同发育阶段的表达量
沙葱萤叶甲GdHsp70-2在不同发育阶段的表达水平差异显著(F=231.59,P<0.05)(图7A)。以卵期的表达量作为对照,2龄幼虫和蛹期的表达量显著高于其它发育阶段(P<0.05),分别是卵期表达量的7.48倍和7.75倍,而其他各龄期的表达量不存在显著差异。GdHsp70-3在不同发育阶段的表达水平差异极显著(F=657.09,P<0.001)(图7B)。以卵期的表达量作为对照,蛹期和雌性成虫中的表达量显著高于其它发育阶段(P<0.001),分别是卵期表达量的115.32倍和8.35倍,而1,2,3龄幼虫阶段表达量极低(P<0.001),仅为卵期表达量的4.09%,10.45%,5.80%。

图7 沙葱萤叶甲GdHsp70-2(A)和GdHsp70-3(B)在不同发育阶段的表达谱
2.6 沙葱萤叶甲GdHsp70-2,GdHsp70-3在成虫不同组织中的表达量
沙葱萤叶甲GdHsp70-2在成虫不同部位的表达量存在极显著差异(F=66.49,P<0.001)(图8A),翅部的表达量明显高于其它部位,其次为胸部与腹部,分别为头部表达量的2.03倍、1.54倍与1.53倍;各部位GdHsp70-3的表达量也有极显著性差异(F=288.26,P<0.001)(图8B),其中足部的表达量最高,为头部表达量的2.28倍,腹部表达量最低,仅为头部表达量的52.91%,其他部位表达量差异不显著(图8B)。

图8 沙葱萤叶甲GdHsp70-2(A)和GdHsp70-3(B)组织表达分析
3 讨论
本研究通过RT-PCR和RACE技术克隆获得了两条沙葱萤叶甲Hsp70基因,分别命名为GdHsp70-2(Genbank登录号为MZ853083)与GdHsp70-3(Genbank登录号为OK585088)。使用DNAMAN(Version 8.0)对GdHsp70-2与GdHsp70-1进行序列比对,发现GdHsp70-2除5′端非翻译区及开放阅读框前端683 bp外,其余碱基与GdHsp70-1的序列相似度为99.8%,二者同源性极高,根据可变剪切的定义及剪接模式的分类[39],推测该基因可能属于GdHsp70-1的剪接异构体。GdHsp70-1与GdHsp70-2可能是由同一mRNA前体(Pre-mRNA)通过不同的剪接方式,而产生的不同剪接异构体。这种方式使得一个基因可编码多个不同转录产物和蛋白产物,是真核生物中增加蛋白质多样性和调控基因表达的一种常见方式,是由多种因素诱导产生的高效动态过程[40]。在蛋白质三维结构预测中GdHSP70-2与GdHSP70-3均由N-端的ATPase功能域及C-端的底物结合功能域构成,这与乔恒等对美国白蛾HyphantriacuneaHcHSP70蛋白预测的三维结构高度相似,HcHSP70的N-端ATPase功能域呈螺旋状结构,与肌动蛋白和己酮酶有类似的折叠,C-端底物结合功能域是扁平的砖状结构,具有结合延伸的多肽链通道[41]。同源比对及系统进化分析显示昆虫HSP70系统发育树被分成3支,不同目昆虫的HSP70家族基因具有较高的保守性,其中GdHSP70-2与松墨天牛MaltHSC70-1同源性相似度最高,这与早期谭瑶等的研究结果相似[19],表明沙葱萤叶甲与松墨天牛在进化中有相近的起源关系;而GdHSO70-3与玉米根萤叶甲DvirHsp70-2同源性相似度高,说明沙葱萤叶甲不同Hsp70基因在进化上存在差异性,HSP70家族不同基因功能具有多样性[42]。
内含子(Intron)是真核生物细胞DNA中的间插序列,基因在转录后保留编码部分,间插序列经过剪接被除去,最终不存在于成熟的mRNA分子序列中[43]。随着研究的深入,内含子的功能逐渐被发掘,例如增加转录组和蛋白质组的多样性、在细胞中进行调控活动、影响基因表达、mRNA的加工、降解和翻译效率等[44]。但并非所有基因组序列中都包含内含子(图6),吴春凤以弓形虫Toxoplasmagondii的DNA为模板,通过T-A克隆测序发现其GRA1基因为断裂基因,在原基因序列的860~861 bp间存在一段135 bp的内含子序列[45];刘昭华根据已经获得的中华蜜蜂ApisceranaAccHsp27.6 cDNA序列进行基因组全长的扩增时,则发现该基因不含内含子[46]。本实验对两个Hsp70基因进行基因组DNA克隆,将其与从NCBI数据库中搜索来自其他目昆虫的Hsp70基因组序列构建NJ系统进化树,并分析其基因结构,但未发现Hsp70基因的编码结构与其表达形式存在必然联系,这可能是物种差异所致[47-48]。明确GdHsp70的基因结构将为应用CRISPR-Cas9基因敲除策略开展HSP70在沙葱萤叶甲生长发育[49-50]、抗寒性及相关的生物学功能研究奠定基础。
因为基因表达具有阶段特异性与组织特异性,不同时期细胞的分化和发育过程中,基因的表达会有很大差异[51]。研究报道显示Hsp70基因不仅在对抗外界压力中起主要作用,在调控昆虫生长发育及分化过程中也发挥着重要作用[52-53]。不同发育阶段表达谱显示:GdHsp70-2在2龄幼虫期和蛹期表达量较高,而GdHsp70-3只在蛹期的表达量显著高于其它各时期,表明这两个Hsp70基因可能参与了沙葱萤叶甲的生长发育过程。类似的结果在白背飞虱各发育阶段表达谱分析中也被报道,其Hsp70-2在1龄若虫中表达最高,Hsp70-3在雌虫羽化第3天达到最高表达水平,Hsp70-4,Hsp70-5和Hsp70-6在5龄第2天若虫中表达水平最高[34]。在不同组织表达量分析中,GdHsp70-2与GdHsp70-3分别在沙葱萤叶甲成虫翅和足的表达量最高,推测这两个基因可能与昆虫的运动行为相关,有助于其躲避天敌并扩大分布范围[54],同时也反应了沙葱萤叶甲对外环境的一种适应机制。在早期谭瑶等的研究中发现,GdHsp70-1在卵期表达量远高于其他发育阶段,且不同组织中以胸部表达量最高[19],这也表明不同的Hsp70基因在沙葱萤叶甲不同生长发育阶段中发挥着不同的作用。
4 结论
本研究通过克隆技术获得了两条沙葱萤叶甲Hsp70基因,明确其编码序列及基因结构,并对其表达谱进行分析。之后将进一步对沙葱萤叶甲Hsp70家族基因的同源性、功能与进化分析等开展深入研究,探索热激蛋白70家族不同基因在沙葱萤叶甲适应性进化方面承载的生物学功能。

