五宝胶囊通过调节Ⅱ型固有淋巴细胞上下游细胞因子抑制哮喘模型小鼠气道炎症的研究 Δ
张秋实 ,黄丰 ,童晓云 ,杨竹雅 ,李宝晶 ,林玉萍 ,瞿璐 ,聂坚 ,虎春艳 (.云南中医药大学南药重点实验室,昆明 650500;.云南中医药大学第一附属医院科研部,昆明 6500;.云南中医药大学中药学院,昆明 650500;.云南中医药大学基础医学院,昆明 650500)
哮喘是世界范围内严重危害人类健康的一种气道慢性炎症性疾病[1-2]。2019年《柳叶刀》报道,我国哮喘患病率呈逐年增长的趋势,其中20岁以上人群哮喘患病率为4.2%,涉及人口超过了4 500万[3]。研究表明,除了获得性免疫外,固有免疫也被认为与哮喘有关[4]。在固有免疫细胞中,Ⅱ型固有淋巴细胞(type Ⅱ innate lymphoid cells,ILC2s)被认为是通过释放辅助性T细胞(helper T cell,Th)因子而导致嗜酸性气道炎症的关键[5-6]。过敏原可诱导气道上皮细胞产生白细胞介素25(interleukin 25,IL-25)、IL-33和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)。这些细胞因子可激活ILC2s而产生IL-4、IL-5、IL-9、IL-13等炎症因子,并引起气道炎症[7-10]。
五宝胶囊又名“五宝散”(或“雅叫哈顿散”),为傣医传统解药名方,自1977年以来被历版《中国药典》所收载。五宝胶囊由小百部、藤苦参、苦冬瓜、箭根薯、蔓荆子茎叶以及羊耳菊根6味药等量组成,具有清热解毒、止血止痛以及调平“风、火、水、土”四塔和“色、识、受、想、行”五蕴的功效,临床用来治疗寒热感冒、咽喉肿痛、虚劳心悸、咳嗽咯血、月经不调、气血不足、产后诸风、胸腹胀痛和产后流血不止等症[11]。本课题组前期研究发现,五宝胶囊能够改善气道炎症,可能通过调节Th1/Th2和Th17/调节性T细胞(Treg)的平衡来发挥防治哮喘的作用[12]。本研究进一步探索了五宝胶囊对哮喘模型小鼠气道炎症及ILC2s上下游细胞因子的影响,以期为傣药五宝胶囊更广泛的临床应用和开发提供科学依据。
1 材料
1.1 仪器
本研究所用主要仪器包括INQUA NEB plus型超声雾化仪(德国PARI公司)、AR224CN型分析天平[奥豪斯仪器(上海)有限公司]、Spectra Max Plus 384型多功能酶标仪(美国Molecular Devices公司)、1706型离心机(德国Hettich公司)、8920型超低温冰箱(美国Thermo Fisher Scientific公司)。
1.2 主要药品与试剂
五宝胶囊(批号170703,每粒含生药量0.2 g)购自云南西双版纳药业有限公司;卵清蛋白(ovalbumin,OVA;批号A5253)和地塞米松原料药(货号D1756,纯度≥98%)均购自美国Sigma公司;纳米氢氧化铝(批号37801)购自阿拉丁科技(中国)有限公司;苏木精-伊红(hematoxylin and eosin,HE)染色液(货号G1005)和过碘酸雪夫(PAS)染色液(货号G1008)均购自武汉赛维尔生物科技有限公司;IL-5、IL-9、IL-13、IL-33、TSLP、免疫球蛋白 E(immunoglobulin E,IgE)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(批号分别为 A20580821、A20980513、A21381132、A23380314、A26580933、A27581115)均购自杭州联科生物技术股份有限公司;IL-25(IL-17E)ELISA检测试剂盒(批号M201211-007a)购自深圳欣博盛生物科技有限公司;黏蛋白5AC(MUC5AC)ELISA检测试剂盒(批号ZKVBMELGV3)购自武汉伊莱瑞特生物科技股份有限公司;OVA-IgE ELISA检测试剂盒(批号544983)购自美国Cayman公司;脱氧核糖核酸酶Ⅰ(deoxyribonucleaseⅠ ,DNase Ⅰ ;批号 35027800)和 LiberaseTM(批号35537400)均购自瑞士Roche公司;水为超纯水。
1.3 动物
SPF级雌性6~8周龄的BALB/c健康小鼠40只,体质量为18~20 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号为SCXK(辽)2020-0001。小鼠适应性饲养1周后开始实验,饲养温度22~24 ℃,环境相对湿度50%~60%。本实验经云南中医学院动物实验伦理审查委员会批准,批准号为R-06201910。
2 方法
2.1 试剂的制备
2.1.1 地塞米松药液 准确称取地塞米松粉末3.0 mg,用30 μL乙醇溶解后用生理盐水定容至30 mL,配制成0.1 mg/mL的溶液,置于4 ℃冰箱保存,使用前用涡旋仪混匀。
2.1.2 五宝胶囊溶液 称取五宝胶囊粉末5.0 g,加入50 mL的生理盐水溶解,制备成100 mg/mL的母液,再用生理盐水稀释为50 mg/mL的溶液,于4 ℃冰箱中保存备用。
2.2 分组、造模和给药
40只小鼠随机分为正常组、模型组、阳性对照组和五宝胶囊低、高剂量组,每组8只。参考相关文献[12]建立哮喘模型:模型组和给药组小鼠分别于第1、8、15天腹腔注射0.2 mL含氢氧化铝的OVA致敏液(OVA 1 mg/mL、氢氧化铝5 mg/mL、生理盐水0.2 mL);正常组小鼠腹腔注射0.2 mL生理盐水。从实验第21天开始,阳性对照组小鼠每天灌胃1 mg/kg地塞米松药液,五宝胶囊低、高剂量组小鼠每天分别灌胃0.5、1 g/kg五宝胶囊溶液[12],正常组和模型组小鼠每天灌胃10 mL/kg生理盐水,连续7 d。每次灌胃1 h后,将模型组和给药组小鼠置于雾化器内,予2%OVA溶液6 mL雾化激发,每天1次,每次30 min;正常组小鼠予生理盐水雾化激发。
2.3 血清中IgE、OVA-IgE含量的检测
最后一次雾化激发小鼠24 h后,各组小鼠腹腔注射1%的戊巴比妥钠(0.01 mL/g)麻醉,剪除小鼠眼睛周围毛发后,用75%的乙醇消毒,摘除眼球取血,血液静置1 h,于4 ℃下以3 000 r/min离心10 min,取上清液保存于-80 ℃冰箱中待测。按ELISA检测试剂盒说明书检测血清中的IgE、OVA-IgE含量。
2.4 BALF中相关细胞因子和黏蛋白含量的检测
各组小鼠取血后,脱颈椎处死,固定于小鼠解剖板上,用75%乙醇消毒小鼠胸腹腔,进行气管内插管。右肺用血管夹夹闭,左肺用0.6 mL磷酸盐缓冲液分2次灌洗,每次冲洗3遍;回收并合并2次支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),于4 ℃下以1 000 r/min离心10 min,取上清液按ELISA检测试剂盒说明书检测 BALF 中 IL-5、IL-9、IL-13、IL-25、IL-33、TSLP、MUC5AC的含量。
2.5 肺组织病理变化和杯状细胞增生的观察
收集完小鼠BALF后,取各组小鼠右肺中叶,用磷酸盐缓冲液冲洗后,滤纸吸干,置于4%多聚甲醛固定液中24 h后,将组织切片并包埋于石蜡中,制备5~8 μm切片。用HE染色并评估分析小鼠肺组织炎性浸润情况和气管增厚情况;通过PAS染色观察各组小鼠气道杯状细胞的分布。
2.6 肺组织中ILC2s数量的检测
收集完小鼠BALF后,分离除五宝胶囊低剂量组(由于在预实验中发现低剂量五宝胶囊没有药效,所以本实验没有分离五宝胶囊低剂量组)以外各组小鼠右肺上叶及下叶,并研磨成碎片,加入DNase Ⅰ和LiberaseTM,在37 ℃下消化20 min,用红细胞裂解液去除红细胞,制成单细胞悬液后通过流式细胞术检测肺组织中ILC2s的数量。流式配色方案为7AAD-CD45+LIN-KLRG 1+ST2+。
2.7 统计学方法
采用GraphPad Prism 8统计软件对数据进行分析,检测结果以±s表示。多组间比较采用单因素方差分析,两两比较采用Bonferroni法检验。检验水准α=0.05。
3 结果
3.1 五宝胶囊对哮喘小鼠血清中IgE、OVA-IgE的影响
如表1所示,与正常组比较,模型组小鼠血清中IgE、OVA-IgE含量均显著升高(P<0.01);与模型组比较,五宝胶囊高、低剂量组和阳性对照组小鼠血清中IgE、OVA-IgE含量均显著降低(P<0.01)。
表1 各组小鼠血清中IgE、OVA-IgE含量检测结果(±s,n=8,pg/mL)

表1 各组小鼠血清中IgE、OVA-IgE含量检测结果(±s,n=8,pg/mL)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01
组别正常组模型组阳性对照组五宝胶囊低剂量组五宝胶囊高剂量组OVA-IgE 0.78±0.49 5.91±0.45a 2.08±0.64b 2.79±0.62b 1.55±0.31b IgE 104.77±4.70 177.14±7.17a 114.45±6.26b 142.06±5.82b 129.64±5.46b
3.2 五宝胶囊对小鼠BALF中ILC2s上游细胞因子IL-25、IL-33、TSLP的影响
如表2所示,与正常组比较,模型组小鼠BALF中ILC2s上游细胞因子IL-25、IL-33、TSLP含量均显著升高(P<0.01);与模型组比较,五宝胶囊高、低剂量组和阳性对照组小鼠BALF中IL-25、IL-33、TSLP含量均显著降低(P<0.01)。
3.3 五宝胶囊对小鼠BALF中ILC2s下游细胞因子IL-5、IL-9、IL-13的影响
如表2所示,与正常组比较,模型组小鼠BALF中ILC2s下游细胞因子IL-5、IL-9、IL-13含量均显著升高(P<0.01);与模型组比较,五宝胶囊高、低剂量组和阳性对照组小鼠BALF中IL-5、IL-9、IL-13含量均显著降低(P<0.01)。
3.4 五宝胶囊对小鼠肺组织病理变化的影响
如图1所示,正常组小鼠的肺组织结构完整,黏膜上皮完整,气管平滑肌和基底膜正常,无明显增厚现象;模型组小鼠气管、肺泡以及肺间质周围有大量炎症细胞浸润,基底膜增厚严重,上皮增生;与模型组比较,五宝胶囊高、低剂量组和阳性对照组小鼠的炎症细胞浸润及基底膜增厚均有不同程度的缓解。

图1 各组小鼠肺组织的病理学显微图(HE染色,×200)
3.5 五宝胶囊对小鼠肺组织杯状细胞增生的影响
气道内的杯状细胞可分泌黏液,黏液中黏蛋白糖原部分可被PAS染为蓝紫色。如图2所示,正常组小鼠气道完整,无杯状细胞增生,未见黏液;模型组小鼠气道见大量蓝紫色,说明黏液较多,杯状细胞增生明显;五宝胶囊高、低剂量组和阳性对照组小鼠气道内蓝紫色均有所减少,可见杯状细胞增生和黏液分泌被抑制。如表2所示,与正常组比较,模型组小鼠BALF中MUC5AC含量显著升高(P<0.01);与模型组比较,五宝胶囊高、低剂量组和阳性对照组小鼠BALF中MUC5AC含量均显著降低(P<0.01)。

图2 各组小鼠肺组织杯状细胞增生显微图(PAS染色,×200)
表2 各组小鼠BALF中ILC2s上下游细胞因子和黏蛋白含量检测结果(±s,n=8,pg/mL)
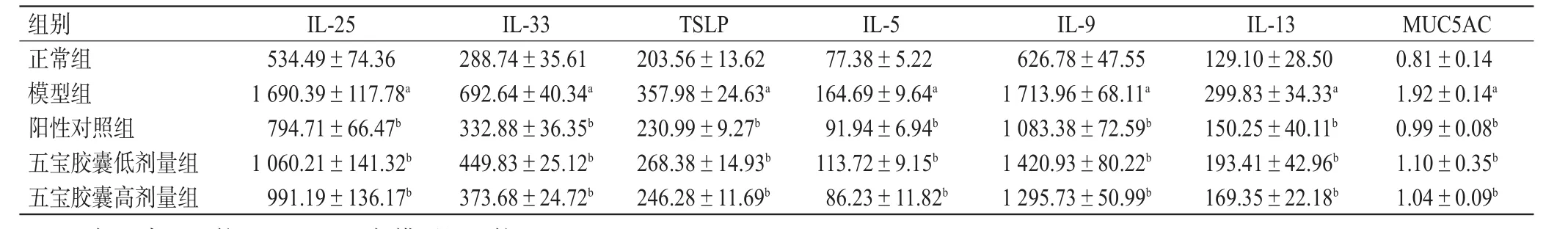
表2 各组小鼠BALF中ILC2s上下游细胞因子和黏蛋白含量检测结果(±s,n=8,pg/mL)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01
组别M U C 5 A C I L-2 5 I L-3 3 T S L P I L-5 I L-9 I L-1 3正常组模型组阳性对照组五宝胶囊低剂量组五宝胶囊高剂量组0.8 1±0.1 4 1.9 2±0.1 4 a 0.9 9±0.0 8 b 1.1 0±0.3 5 b 1.0 4±0.0 9 b 5 3 4.4 9±7 4.3 6 1 6 9 0.3 9±1 1 7.7 8 a 7 9 4.7 1±6 6.4 7 b 1 0 6 0.2 1±1 4 1.3 2 b 9 9 1.1 9±1 3 6.1 7 b 2 8 8.7 4±3 5.6 1 6 9 2.6 4±4 0.3 4 a 3 3 2.8 8±3 6.3 5 b 4 4 9.8 3±2 5.1 2 b 3 7 3.6 8±2 4.7 2 b 2 0 3.5 6±1 3.6 2 3 5 7.9 8±2 4.6 3 a 2 3 0.9 9±9.2 7 b 2 6 8.3 8±1 4.9 3 b 2 4 6.2 8±1 1.6 9 b 7 7.3 8±5.2 2 1 6 4.6 9±9.6 4 a 9 1.9 4±6.9 4 b 1 1 3.7 2±9.1 5 b 8 6.2 3±1 1.8 2 b 6 2 6.7 8±4 7.5 5 1 7 1 3.9 6±6 8.1 1 a 1 0 8 3.3 8±7 2.5 9 b 1 4 2 0.9 3±8 0.2 2 b 1 2 9 5.7 3±5 0.9 9 b 1 2 9.1 0±2 8.5 0 2 9 9.8 3±3 4.3 3 a 1 5 0.2 5±4 0.1 1 b 1 9 3.4 1±4 2.9 6 b 1 6 9.3 5±2 2.1 8 b
3.6 五宝胶囊对小鼠肺组织中ILC2s数量的影响
如图3和图4所示,与正常组比较,模型组小鼠肺组织中ILC2s数量显著升高(P<0.01);与模型组比较,五宝胶囊高剂量组和阳性对照组小鼠肺组织中ILC2s数量均显著降低(P<0.01)。

图3 各组小鼠肺组织中ILC2s的流式图

图4 各组小鼠肺组织中ILC2s数量的检测结果(n=8)
4 讨论
傣医学认为,“四塔”“五蕴”在人体内的动态平衡是维持人体正常生命活动的基础。哮喘主要因体内四塔、五蕴功能失调,加之冷风寒邪、痰湿不化、上犯于肺,阻塞肺气而发。其传统经方五宝胶囊具有“调平四塔、清火解毒”等功效,在临床上可用于治疗咳喘、咳痰[11]。但目前国内对该复方的研究报道相对较少。
肺部病理改变是哮喘的表征。在哮喘病理组织切片上可观察到气道、肺泡及肺间质周围有大量炎性细胞、上皮增生、黏蛋白增多、气道壁增厚、气道管腔狭窄。而这些病理变化以气道炎症为基础产生,炎症是哮喘发病机制的中心[13]。ILC2s通过介导2型细胞因子(包括IL-4、IL-5、IL-9和IL-13)的产生从而激活2型炎症性疾病(过敏性哮喘、过敏性鼻炎、过敏性皮炎等)中的嗜酸性粒细胞、B细胞、肥大细胞、巨噬细胞、成纤维细胞和上皮细胞来启动和放大气道炎症[9]。IL-5可激活嗜酸性粒细胞,并将其募集到肺部;IL-9可参与肥大细胞增殖,并在ILC2s存活中发挥关键作用[9-10];IL-13是诱导MUC5AC分泌过多和导致炎症的重要因素,IL-13还可通过介导单核细胞和嗜酸性粒细胞引起炎症反应,进而引起黏液细胞化生、气道纤维化和气道阻塞[14]。IL-25,也称为IL-17E,是IL-17细胞因子家族的成员。IL-17家族的大多数成员可导致中性粒细胞浸润,诱发Th1型炎症,而IL-25可导致嗜酸性粒细胞增多,诱导Th2型炎症,并引起IL-4、IL-5和IL-13的过度产生[15-16]。IL-33是IL-1细胞因子家族的成员,在许多炎症过程和疾病中起着至关重要的作用。IL-33与其受体ST2结合可增强体外和体内Th2细胞因子IL-4、IL-5和IL-13的产生[17]。有文献表明,上皮来源的IL-33是诱导IL-13产生ILC2s的有效刺激剂[18]。上皮细胞来源的细胞因子TSLP与哮喘炎症途径的启动和持续有关,其参与了炎症性气道疾病的发病机制,包括变应性鼻炎、慢性鼻窦炎、哮喘和慢性阻塞性肺病等[19]。哮喘的各种致病因素,包括气道高反应性、黏液过度产生和气道重塑,被认为至少部分是由TSLP通过其下游促炎作用驱动的,涉及的细胞因子包括IL-4、IL-5和IL-13等[20]。因此,ILC2s的积累和激活被认为是哮喘炎症的关键因素[7]。
本研究采用经典的哮喘小鼠模型建立方法,选取BALB/c雌性小鼠,多次腹腔注射OVA致敏,雾化吸入OVA后激发,建立哮喘模型。病理组织切片HE染色显示,模型组小鼠肺组织气管周围炎症显著增加,气道黏液及炎症细胞浸润增多,气管平滑肌和气道基底膜增厚,提示哮喘模型建立成功[12,21]。本研究结果显示,与正常组比较,模型组小鼠BALF中的IL-25、IL-33、IL-5、IL-9、IL-13、TSLP含量和肺组织中的ILC2s数量均显著升高;经五宝胶囊干预后,上述细胞因子和ILC2s数量均不同程度降低,说明五宝胶囊可能通过调节ILC2s上下游细胞因子来缓解哮喘模型小鼠的炎症反应。
IgE是由B细胞响应细胞介导的免疫反应的过敏原激活而产生的。过敏原特异性IgE与免疫效应细胞上表达的FcεRI受体具有高亲和力,二者结合会导致效应细胞立即激活,最终导致细胞脱颗粒及促炎介质的释放[22]。本研究表明,五宝胶囊可以降低哮喘模型小鼠血清中OVA-IgE和IgE的含量,减少炎症因子的释放,改善杯状细胞增生,减少杯状细胞分泌的MUC5AC,从而改善气道炎症,进而缓解哮喘。
综上所述,五宝胶囊可通过调节ILC2s上下游细胞因子改善哮喘模型小鼠的气道炎症反应和病理变化,减少哮喘模型小鼠黏蛋白分泌和炎症细胞对肺组织的浸润,减轻哮喘模型小鼠的呼吸道损伤。

