PI3K在舒尼替尼致hiPSC-CMs收缩功能障碍中的作用 Δ
李从欣 ,刘国强 ,刘洋 ,张之晗 ,阎伟 ,梁春慧 (.河北医科大学第三医院药剂科,石家庄 05005;.河北医科大学第四医院临床营养科,石家庄 0500)
小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)在临床应用广泛且效果显著,对提高肿瘤患者存活率、改善其生存质量具有重要意义[1]。然而,临床实践显示,部分TKIs具有明显的心脏毒性,主要表现为QT间期延长、高血压、心肌肥厚、左室收缩功能障碍等,严重者可引发心力衰竭,甚至影响肿瘤患者的治疗计划及生存期[1-2]。舒尼替尼是一种多靶点TKIs,研究表明,其可导致28%的患者出现不同程度的心脏收缩功能障碍,其中8%的患者可进展为心力衰竭[3]。动物研究发现,舒尼替尼可剂量依赖性地降低小鼠心肌细胞钙瞬变幅度,抑制心脏肌张力[4];可通过显著抑制腺苷一磷酸活化蛋白激酶、磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶A和Ca2+/钙调蛋白依赖性蛋白激酶Ⅱδ等的活性来影响实验动物的心脏功能[5-7]。目前,舒尼替尼致心脏毒性的确切分子机制尚不明确,且无特异性的防治策略,导致该药的临床应用受限[7]。
PI3K是一种进化高度保守的激酶家族,其α、β亚型均可参与心肌细胞Ca2+循环及兴奋收缩偶联,敲除PI3K α或β编码基因可引发心力衰竭[8]。由于心肌细胞正常收缩与Ca2+循环密切相关,因此本课题组假设舒尼替尼可通过抑制PI3K活性而引发Ca2+调控紊乱,从而导致心脏收缩功能障碍。人源诱导型多能干细胞来源的心肌细胞(human induced pluripotent stem cell-derived cardiomyocytes,hiPSC-CMs)具有人类心肌细胞的基本功能及特点(如心肌细胞的信号调控、离子通道及通道蛋白转运等),同时能够对药物或电生理刺激作出心肌细胞样反应,是目前评价药物致心肌细胞电生理功能障碍和开展心血管疾病研究、药物临床前毒性监测的重要细胞模型[9]。基于此,本研究以舒尼替尼诱导hiPSC-CMs建立收缩功能障碍细胞模型,探讨PI3K在此过程中的作用,为TKIs等抗肿瘤药物的心脏毒性机制研究和药物临床前心脏毒性风险筛查提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括CardioExcyte 96型非标记心脏安全评价系统、NSP-96型电极孔板(德国Nanion Technology公司),TCS SP5-Ⅱ型激光共聚焦显微镜系统(德国Leica公司),HF90型CO2恒温细胞培养箱(上海力申科学仪器有限公司),NanoDrop 100型微量核酸蛋白检测仪(美国Genentech公司),TU-1800型分光光度计(北京普析通用仪器有限责任公司),DW-86L388L型-80 ℃生物冰箱(青岛海尔生物医疗股份有限公司)等。
1.2 主要药品与试剂
hiPSC-CMs完全培养基购自北京赛贝生物技术有限公司;苹果酸舒尼替尼原料药(货号HY-10255,纯度99.60%)、阴性对照阿西替尼原料药(货号HY-10065,纯度99.60%)均购自美国MedChemExpress公司;阳性对照阿霉素原料药(货号25316-40-9,纯度>95.0%)购自东京化成工业株式会社;PI3K的激活剂3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-triphosphate,PIP3)购自美国Echelon Biosciences公司(货号P-3917,纯度>95.0%);钙离子荧光探针Fluo-4/AM(货号F14217)购自美国Life Technology公司;表面活性剂F127(货号9003-11-6)购自美国Sigma公司;反转录试剂盒购自美国Promega公司;SYBR PCR Mix试剂盒购自日本TaKaRa公司。本研究所用心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)和β-肌凝蛋白重链(β-myosin heavy chain,β-MHC)的引物由生工生物工程(上海)股份有限公司合成,引物序列及扩增产物长度见表1。

表1 引物序列及扩增产物长度
1.3 实验细胞
hiPSC-CMs购自北京赛贝生物技术有限公司。
2 方法
2.1 hiPSC-CMs的培养
细胞复苏后,分别按30 000、10 000个/孔接种至NSP-96型电极孔板(经纤连蛋白铺底)和48孔板(提前放入6 mm的玻璃小片)内,混匀,常温下放置30 min后,于37 ℃、5%CO2的恒温培养箱中培养。待细胞铺板复苏48 h后,吸弃上清液,加入hiPSC-CMs完全培养基。在给药前,每24 h更换一半培养基。预实验显示,在复苏5 d后,细胞电信号逐渐达到平台期,可进行后续实验。
2.2 舒尼替尼对hiPSC-CMs收缩力的影响考察
阿霉素和阿西替尼采用二甲基亚砜(DMSO)配制成1 mmol/L的母液,舒尼替尼采用DMSO分别配制成0.5、1、3、5、10 mmol/L的母液,PIP3采用高压灭菌水配制成1 mmol/L的母液,上述母液均于-20 ℃保存。根据预实验结果,将阿霉素和阿西替尼的给药浓度设为1 μmol/L,分别在给药前和孵育24 h后,采用CardioExcyte 96系统检测2种药物对hiPSC-CMs收缩力的影响,以验证检测系统的敏感性。
将hiPSC-CMs按30 000个/孔接种于NSP-96型电极孔板(经纤连蛋白铺底)中,然后以不同浓度[0(对照,含0.1%DMSO溶剂)、0.5、1、3、5、10 μmol/L,根据本课题组前期预实验设置]舒尼替尼干预,每个浓度平行设置4个复孔。采用CardioExcyte 96系统进行检测,给药前30 min记录给药前收缩力,给药后设定检测程序:前2 h,每10 min检测1次收缩信号,观察舒尼替尼对hiPSC-CMs收缩力的急性抑制作用;给药2 h后,系统每1 h记录1次数据,记录至给药24 h时,然后拟合舒尼替尼抑制hiPSC-CMs收缩力的半数抑制浓度(half inhibitory concentration,IC50)。
2.3 舒尼替尼对hiPSC-CMs收缩频率的影响考察
将hiPSC-CMs复苏,按30 000个/孔接种于NSP-96型电极孔板(经纤连蛋白铺底),分为对照组(0.1%DMSO)和舒尼替尼组(3.14 μmol/L,根据“2.2”项下结果设置)。采用CardioExcyte 96系统检测给药/溶剂前30 min及给药/溶剂后24 h各组细胞的收缩频率。
2.4 舒尼替尼对hiPSC-CMs钙瞬变幅度和钙瞬变恢复时程的影响考察
将hiPSC-CMs复苏,按10 000个/孔接种于48孔板(提前放入6 mm的玻璃小片)内,分为对照组(0.1%DMSO)和舒尼替尼组(3.14 μmol/L,根据“2.2”项下结果设置),每组设4个复孔。作用24 h后,取出细胞小片置于氧饱和的有钙台式液中,随后用含5 μmol/L Fluo-4/AM的钙离子荧光探针和0.02%F127的有钙台式液,于37 ℃避光孵育20 min;更换有钙台式液后,将各组细胞于37 ℃恒温浴槽内持续灌流台式液,通过激光共聚焦显微镜线扫模式记录细胞自发钙瞬变幅度和钙瞬变恢复时程。
2.5 舒尼替尼对 hiPSC-CMs中 ANP、BNP、β-MHC mRNA表达水平的影响考察
将hiPSC-CMs复苏,按30 000个/孔接种于96孔板中,按“2.3”项下方法分组与干预,每组设4个复孔,作用24 h后,提取hiPSC-CMs总RNA,反转录得到cDNA,以cDNA为模板进行PCR。PCR反应体系(共20 μL)包括:SYBR Premix Ex Taq Ⅱ 10 μL,ddH2O 6 μL,上下游引物各0.8 μL,cDNA 2 μL,ROX 0.4 μL。反应条件为:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火1 min,40个循环。以GAPDH为内参,采用2-ΔΔCt法分析目的基因mRNA的表达水平。
2.6 PI3K对舒尼替尼致hiPSC-CMs收缩抑制的影响考察
将hiPSC-CMs复苏后,按30 000个/孔接种于NSP-96型电极孔板(经纤连蛋白铺底)中,分为对照组、PIP3组(1 μmol/L,剂量根据预实验设置)、舒尼替尼组(3.14 μmol/L)和舒尼替尼+PIP3组(3.14 μmol/L舒尼替尼+1 μmol/L PIP3),每组设4个复孔。PIP3组和舒尼替尼+PIP3组细胞提前用PIP3孵育4 h,然后各组再分别用0.1%DMSO或舒尼替尼(3.14 μmol/L)孵育24 h,采用CardioExcyte 96系统检测各组细胞的收缩力。
2.7 统计学方法
采用GraphPad Prism 7、SPSS 20.0、Adobe Illustrator CS5进行图像处理及数据分析,实验数据用±s表示。对服从正态分布和方差齐性的数据,多组间比较采用单因素方差分析,组间两两比较采用Dunnett’s post hoc检验。对不服从正态分布的数据,采用Mann-Whitney非参数检验。检验水准α=0.05。
3 结果
3.1 舒尼替尼对hiPSC-CMs收缩力的影响
由图1可知,给药24 h后,阿霉素显著减弱了hiPSCCMs的收缩力(P<0.05),而阿西替尼对hiPSC-CMs收缩力并无显著影响(P>0.05),这表明检测系统敏感。由图2可知,舒尼替尼对hiPSC-CMs收缩力的抑制作用有浓度依赖趋势,且当舒尼替尼浓度≥1 μmol/L时,hiPSC-CMs收缩力呈明显下降的趋势。经拟合,舒尼替尼抑制hiPSC-CMs收缩力的IC50值为3.14 μmol/L。
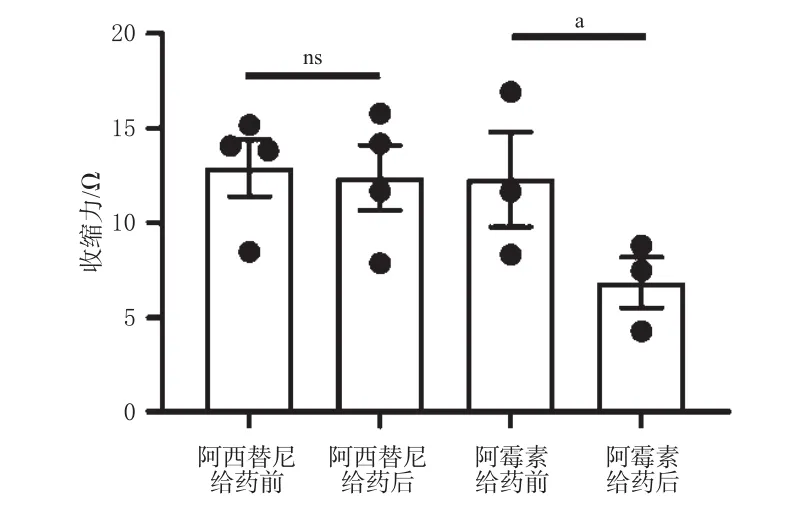
图1 阿西替尼和阿霉素对hiPSC-CMs收缩力的影响[±s,n=4(阿西替尼)或n=3(阿霉素)]
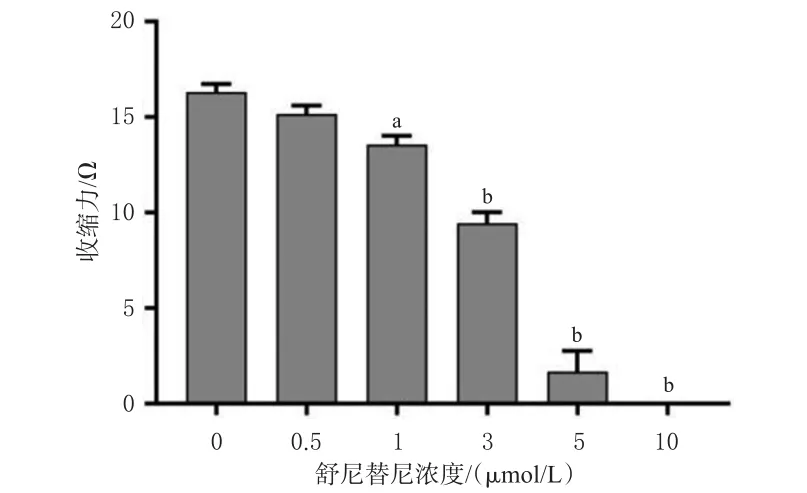
图2 不同浓度舒尼替尼对hiPSC-CMs收缩力的影响(±s,n=4)
3.2 舒尼替尼对hiPSC-CMs收缩频率的影响
对照组hiPSC-CMs给溶剂前后,差异无统计学意义。舒尼替尼组给药后,与对照组或给药前比较,hiPSC-CMs收缩频率均显著降低(P<0.01)。结果见图3。
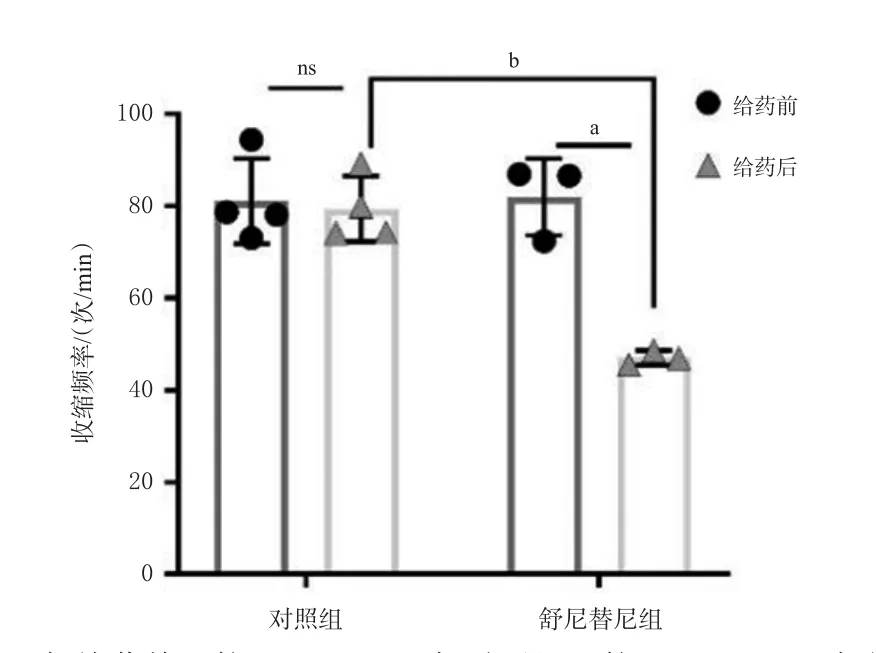
图3 舒尼替尼对hiPSC-CMs收缩频率的影响[±s,n=4(对照组)或n=3(舒尼替尼组)]
3.3 舒尼替尼对hiPSC-CMs钙瞬变幅度和钙瞬变恢复时程的影响
与对照组相比,舒尼替尼组hiPSC-CMs钙瞬变幅度显著降低(P<0.05),钙瞬变恢复时程显著延长(P<0.05)。结果见图4。

图4 舒尼替尼对hiPSC-CMs钙瞬变幅度和钙瞬变恢复时程的影响(±s,n=4)
3.4 舒尼替尼对 hiPSC-CMs 中 ANP、BNP、β-MHC mRNA表达的影响
与对照组比较,舒尼替尼组hiPSC-CMs中ANP、BNP、β-MHC mRNA表达水平均显著升高(P<0.01)。结果见图5。
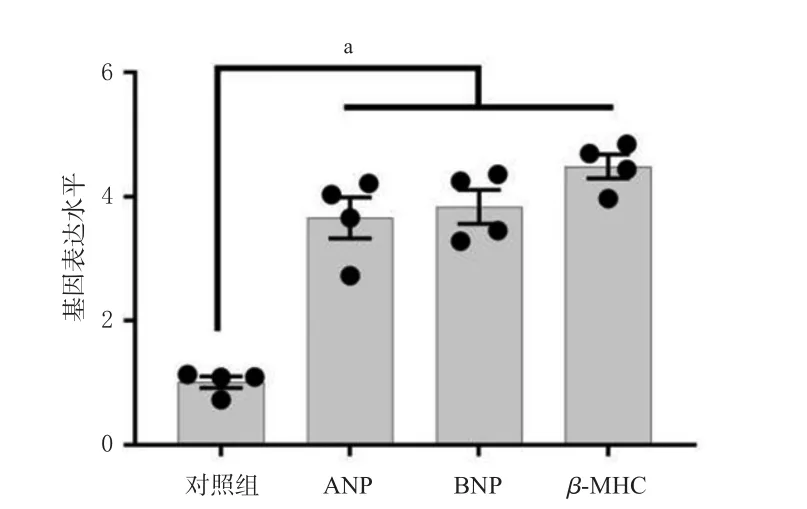
图5 舒尼替尼对hiPSC-CMs中ANP、BNP、β-MHC mRNA表达的影响(±s,n=4)
3.5 PI3K对舒尼替尼致hiPSC-CMs收缩抑制的影响
与对照组相比,PIP3组hiPSC-CMs收缩力差异无统计学意义,舒尼替尼组hiPSC-CMs收缩力显著降低(P<0.05);与舒尼替尼组比较,舒尼替尼+PIP3组hiPSCCMs收缩力显著升高(P<0.01)。结果见图6。
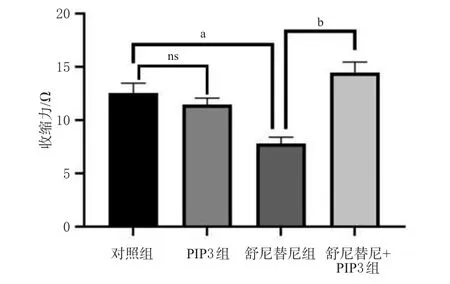
图6 PI3K对舒尼替尼致hiPSC-CMs收缩抑制的影响(±s,n=4)
4 讨论
目前,TKIs心脏毒性的分子机制研究及临床药物毒性筛选大多仍基于动物体内模型或动物体外原代细胞模型、异源表达细胞模型或非心室来源的心肌细胞系,不能完全模拟人体心肌细胞的特征。hiPSC-CMs克服了人和其他动物种属间的差异和其他细胞模型的局限性,是理想的人源心肌细胞研究模型,目前已逐步应用于多种药物的心脏毒性风险筛查[10]。相关研究在动物和非人源细胞水平观察了舒尼替尼心脏毒性及相关分子机制[3,11-12],但确切的分子机制还不明确。同时,尚缺乏舒尼替尼在hiPSC-CMs水平急性心肌毒性的机制及防治措施的相关研究。基于此,本研究以hiPSC-CMs为模型细胞,用舒尼替尼诱导建立收缩功能障碍细胞模型,结果发现,舒尼替尼可引发hiPSC-CMs钙调控紊乱,进而抑制细胞收缩力和收缩频率,表明在hiPSC-CMs水平建立TKIs致心肌细胞收缩功能障碍模型具有可行性。但是,本研究所购买的细胞为正常个体的人诱导性多潜能干细胞,而药物临床应用诱发的心脏毒性往往存在个体差异,可能存在基因敏感性[13]。鉴于目前实验技术日益成熟,TKIs药物毒性研究可从临床出发,获得药物使用过程中发生了心脏毒性患者的体细胞,将其诱导成多潜能干细胞,再进一步分化获得携带特定遗传背景的hiPSC-CMs[14],在此基础上再进行TKIs心脏毒性机制研究,可能对患者的个体化治疗更具意义。
心肌细胞兴奋-收缩耦联平衡和钙稳态是心肌收缩的核心环节。研究发现,多靶点TKIs伊马替尼可激活Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ,使其磷酸化水平增强,进而导致新生大鼠心肌细胞钙调控异常,引发病理性心肌肥厚[15]。另一种TKIs索拉非尼的急性毒性作用则可导致心肌细胞受磷蛋白磷酸化降低,从而减弱其对心肌肌质网Ca2+-ATP酶的亲和力,使肌质网钙瞬变幅度降低50%、钙储备降低33%,从而抑制心肌细胞收缩力[16]。本研究发现,舒尼替尼可呈浓度依赖趋势地抑制hiPSC-CMs的收缩,同时可破坏钙调控的稳态,具体表现为显著的钙瞬变幅度下降和钙瞬变恢复时程延长。这与前期相关研究观察到的舒尼替尼急性毒性作用会浓度依赖性地降低钙瞬变幅度,从而减弱心肌细胞收缩力的结果一致[4]。这说明舒尼替尼引发钙调控紊乱导致hiPSC-CMs收缩抑制可能和钙通道内流和肌质网钙泵活性降低有关,与其他体内研究和体外细胞水平结果相一致[4-6]。前期相关研究发现,抑制PI3K活性是舒尼替尼、达沙替尼和厄洛替尼引发心律失常的重要因素[14]。本研究发现激活PI3K可显著改善舒尼替尼导致的心肌收缩功能障碍,进一步提示,抑制PI3K活性是TKIs心脏毒性的分子机制。另外,TKIs按作用靶点可分为单靶点、多靶点,本研究选择多靶点的舒尼替尼作为代表药物研究了TKIs的心脏毒性,下一步拟选择多种TKIs类药物(包括不同靶点类型、不同抗肿瘤机制)验证本研究结论。
综上所述,本研究证明激活PI3K活性是改善舒尼替尼致心肌毒性的潜在分子机制。

