抗菌药物联合用药体外研究方法的现状及进展
方会慧 , 许元宝 张 菁 , 刘笑芬
多重耐药、广泛耐药细菌的出现和迅速传播已成为一个重大的公共卫生问题,临床可用的抗菌药物有限。为有效控制多重耐药、广泛耐药菌所致严重感染,防止耐药性的进一步产生,抗菌药物联合用药成为一个重要的治疗手段。抗菌药物联合用药对多重耐药菌的抗菌活性及协同作用可通过E试验,棋盘法、时间杀菌曲线等体外研究方法评估[1],荟萃分析显示以体外协同作用为导向的抗菌药物联合治疗与生存率显著相关[2],体外研究发现具有协同作用的联合用药可进一步用于临床研究。因此,本文对抗菌药物联合用药体外研究方法的现状及进展进行综述,以期为多重耐药、广泛耐药菌感染的联合治疗体外研究提供参考。
1 琼脂扩散法
琼脂扩散法包括纸片扩散法和浓度梯度纸条扩散法,又称E试验。纸片扩散法是将2种或2种以上含抗菌药物纸片贴于均匀涂布菌液的平板表面,观察抑菌圈的变化,示意如图1。纸片扩散法简单、易操作,但仅为定性研究。Stein等[3]采用纸片扩散法研究美罗培南、替加环素及多黏菌素E之间的协同作用,筛选出具有增效作用的7株菌株和无增效作用的2株菌株。

图1 纸片扩散法
E试验一般用于微生物药敏试验,用于测定两药的协同作用时,有两种方法:①将2种E试验纸条组合交叉放在涂布细菌的琼脂平板表面,根据相交纸条抑菌圈的最低抑菌浓度(MIC)来计算部分抑菌浓度指数(FICI),FICI=MICA药联合/MICA药单用+MICB药联合/MICB药单用。试验结果判断 :FICI≤0.5,两药有协同作用;0.5<FICI<1为相加作用;1≤FICI<4为无关作用;FICI≥4为拮抗作用[4],示意见图2。②利用E试验法测定抗菌药物A在含或不含抗菌药物B(固定浓度)的细菌琼脂平板中的MIC值变化。结果的判定:联合用药时A药的MIC值降低1个稀释度为无关,降低2个稀释度为相加,降低3个稀释度为协同[5]。E试验的缺点是成本较贵。
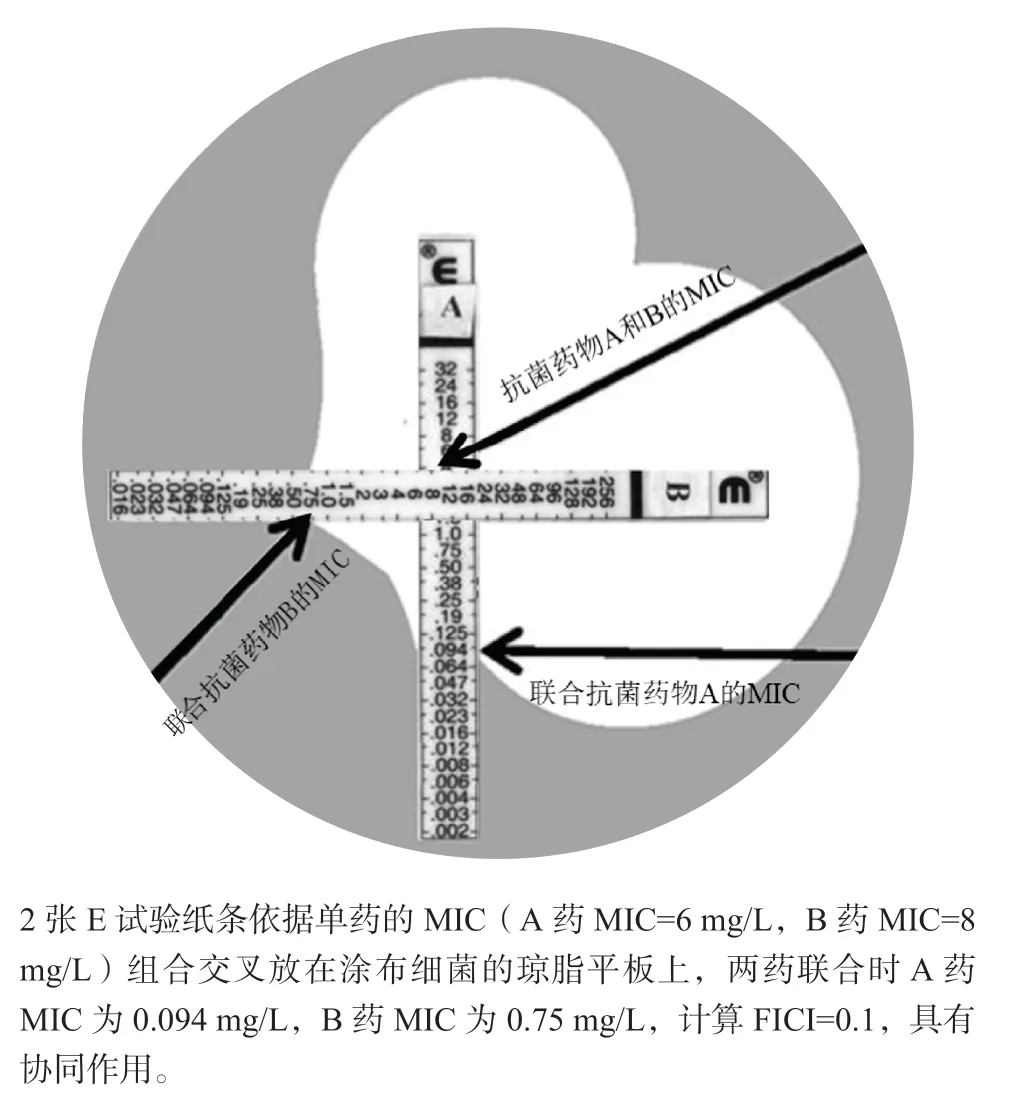
图2 E试验交叉法
2 棋盘法
棋盘法(checkerboard assays)是研究体外协同作用最广泛使用的方法之一,主要采用肉汤微量稀释法测定单药MIC,根据测定的MIC值上推2~4个和下推4~8个浓度梯度设定棋盘法中抗菌药物的浓度范围,两种抗菌药物按棋盘法设计的浓度梯度组合加入96孔微孔板中,24 h后观察微孔中细菌的生长,以微孔中培养基澄清的最低浓度为两药联合MIC,计算FICI判断协同作用,计算方法及结果解读同E试验交叉法。棋盘法示意见图3。近年来,“三相”及“四相”棋盘法可探讨3种、4种药物之间的剂量反应关系[6-7],Santos等[7]利用该方法考察了利奈唑胺、左氧氟沙星与异烟肼/利福平三药联合对10株耐药结核分枝杆菌的协同作用,FICI=(MICA药联合/MICA药) + (MICB药联合/MICB药) + (MICC药联合/MICC药),FICI的最低值用于结果的判断,FICI≤0.75为协同作用;0.75<FICI<4为无关作用;FICI≥4为拮抗作用。但Stein等[3]在“三相”棋盘法中计算FICI时采用的是中位值而非最低值,结果的判断认为FICI≤0.8为协同作用。不同研究中3种抗菌药物联合应用判断协同作用的FICI标准不同,可能影响协同作用的判断,因此,有必要统一协同作用的判断标准。
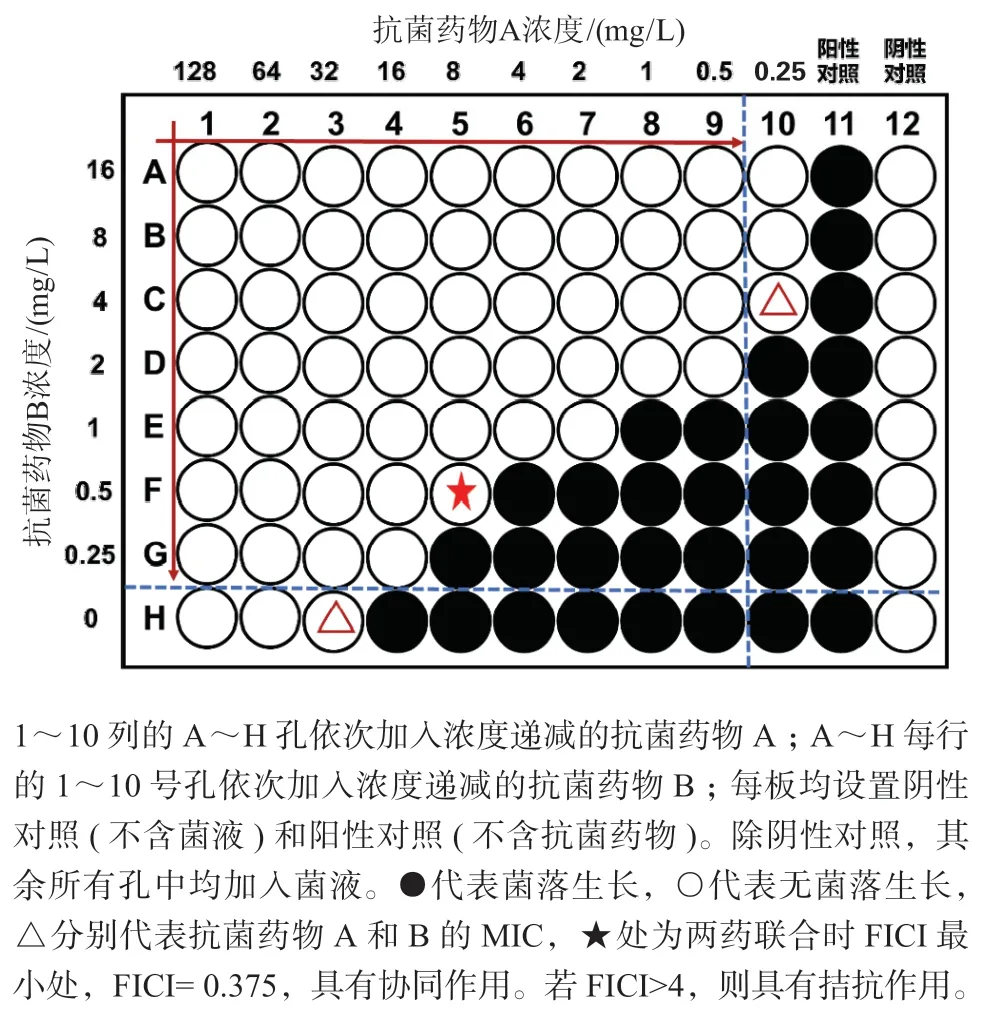
图3 棋盘法示意图
E试验和棋盘法的优点是研究方法简单,容易操作,但也存在很多的问题:①MIC测定方法不同。E试验和棋盘法协同作用的判断依赖于MIC值的变化。肉汤微量稀释法是测定抗菌药物MIC的金标准,但不同体外研究中MIC的测定有琼脂稀释法、E试验等不同方法[3-4,8],MIC可能存在误差,因此不同体外研究中协同作用的结果可比性差;②抗菌药物联合用药的杀菌活性被忽视,因此Gomara等[9]建议检测抗菌药物的最低杀菌浓度(MBC),计算部分杀菌浓度指数(fractional bactericidal concentration index,FBCI)代替 FICI作为抗菌协同作用的主要指标,对于心内膜炎、脑膜炎等严重感染具有重要意义。
3 时间杀菌曲线
时间杀菌曲线(time-kill assays)在新抗菌药物体外药效学评价研究中应用广泛,将处于对数生长期的菌液(通常5×105CFU/mL)暴露于固定浓度的抗菌药物中,考察一段时间内菌落数的变化,当24 h后菌落数下降≥ 3log10CFU/mL认为有杀菌作用,下降≥2log10CFU/mL则认为有抑菌作用。协同作用通常定义为与最有效的成分相比联合用药24 h内菌落数下降≥2log10CFU/mL;当菌落数下降<2log10CFU/mL时为无关作用;当菌落数升高≥2log10CFU/mL时考虑拮抗作用,时间杀菌曲线示意见图4。有部分研究应用杀菌曲线 下 面 积(area under the bacterial killing curve,AUBC)来判断抗菌药物联合用药的协同作用,AUBC通过梯形法计算时间杀菌曲线下0~24 h菌落数的变化,如果联合用药的AUBC低于杀菌活性最强的单一药物(两药中AUBC较小的),则认为该组合是有效的[10-11]。多项研究显示时间杀菌曲线比E试验、棋盘法能检测出更多的协同作用[12-14]。Pankey等[14]利用两种不同的方法检测多黏菌素B联合利福平对14株耐碳青霉烯类肺炎克雷伯菌(CRKP)的协同作用,E试验仅检测出对3株细菌有协同作用,而时间杀菌曲线显示利福平(药物浓度为1MIC)联合多黏菌素B(药物浓度为1MIC、1/2MIC、1/4MIC)对100%菌株均有协同作用。

图4 时间杀菌曲线示意图
时间杀菌曲线还可探讨抗菌药物联合用药对生物膜的作用。Geladari等[15]建立了4株CRKP生物膜模型,测定多黏菌素E、利福平、美罗培南、庆大霉素、替加环素对生物膜的最低抑制浓 度(minimum biofilm inhibitory concentration,MBIC50,定义为至少破坏50%生物膜的最低抗菌药物浓度)分别为64、8、>256、12、8 mg/L,采用Bliss独立模型分析显示16~64 mg/L的多黏菌素E与利福平、美罗培南或替加环素联合均可观察到对生物膜的协同作用,协同作用最强的是多黏菌素E联合利福平。这对存在生物膜感染(如假体关节感染、囊性肺纤维化、感染性心内膜炎等)的治疗具有重要意义。
时间杀菌曲线研究存在的主要问题有:①大多数体外研究都是在相对较短的时间内进行的(多数为24 h),但临床治疗持续时间通常要长得多,在此期间细菌密度可能会异常升高(>108CFU/mL);②时间杀菌曲线的细菌接种量多为105~106CFU/mL,仅有少数时间杀菌曲线进行了高接种量下杀菌作用的研究。有研究比较了常规接种量(105CFU/mL)和高接种量(107CFU/mL)下多黏菌素E联合方案协同作用的区别,结果发现多黏菌素与亚胺培南、替加环素有协同作用,但均存在接种效应[16-17];③时间杀菌曲线结果难以向临床转化。时间杀菌曲线因细菌的接种菌量、药物暴露时间的差异以及无法模拟体内动态抗菌药物浓度,导致体外抗菌药物协同作用很难直接向临床转化。Oliva等[18]回顾性分析32例产KPC酶的CRKP感染患者(包括血流感染、肺部及泌尿道感染等)应用双碳青霉烯类(18例)和双碳青霉烯类联合多黏菌素E(14例)两种治疗方案的临床早期反应和60 d的病死率,并对两组治疗方案中采集的病原菌进行体外研究(时间杀菌曲线),体外研究结果显示双碳青霉烯类联合多黏菌素具有更高的协同率,但临床结局表明两组在治疗的早期反应和60 d死亡率方面差异没有统计学意义,双碳青霉烯类联合多黏菌素E三联疗法的患者仅临床反应常比双碳青霉烯类二联疗法更早。
4 体外药动学/药效学(PK/PD)模型
体外PK/PD模型是指一类借助体外装置来模拟药物在体内的药动学过程和药效学的研究方法,可反映体内抗菌药物浓度变化情况下的杀菌作用[19]。体外PK/PD模型获得的研究数据与人类和动物有良好的相关性,在抗菌药物体外研究与临床应用之间的衔接上发挥了重要作用。与动物体内感染模型相比,抗菌药物体外PK/PD模型表现出以下优点:①避免了人与动物或动物间种属差异;②便于多点采样及高剂量接种;③避免了菌种不易在动物体内生长的情况;④便于耐药性研究等[20]。体外PK/PD模型包括一室模型和两室模型,一室模型通常包括一个中央室、一个培养基池和一个废液池,蠕动泵将培养基泵入含有细菌和抗菌药物的中央室来消除药物,模拟体内抗菌药物药动学过程。该模型同时也引入透析膜能防止细菌滤出中央室,但细菌易堵塞过滤孔,影响抗菌药物浓度变化[21]。二室模型的代表是中空纤维系统(hollow fiber infection model,HFIM)。HFIM主要由含有中空纤维的套筒组成,细菌被限制在作为感染部位的中空纤维筒中,模拟体内感染,药物和培养基可以自由通过,药物暴露量根据药动学特征参数来模拟,该系统可以模拟具有相同或不同半衰期的一种或多种药物的任何药物浓度时间过程[22]。见图5。
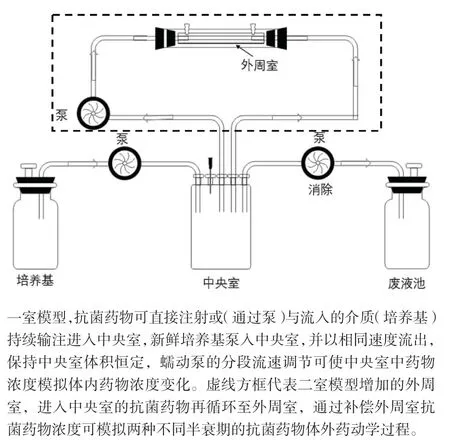
图5 体外PK/PD模型示意图
近年来,体外PK/PD模型已越来越多应用于抗菌药物联合用药研究,探讨联合用药方案对耐药突变菌感染的抑制作用或协同杀菌作用。体外PK/PD模型显示多黏菌素E联合美罗培南[23-24]、多立培南联合多黏菌素E[25]、多黏菌素E联合替加环素[24]、多黏菌素B/E联合磷霉素[26-30]及三药多黏菌素B、美罗培南、利福平联合[23,31]等对CRKP感染均有协同作用,并可消除多黏菌素耐药亚群的出现。此外,基于生物膜的体外PK/PD模型可用于研究联合用药对细菌杀灭作用。Ribera等[32]利用“生物膜发生器”建立2株产ESBL肺炎克雷伯菌的生物膜,研究美罗培南、多黏菌素E和两药联合对已产生物膜的细菌杀灭作用,美罗培南单药(Cmax=90 mg/L,t1/2=1 h,每8小时1次给药)对2株形成生物膜的肺炎克雷伯菌仍有明显的杀菌作用 [下降(3.5±0.8) log10CFU/mL],联合多黏菌素E并未增加杀菌活性[下降(3.2±0.4)log10CFU/mL]。
体外PK/PD模型在评估细菌耐药性中发挥了重要作用。HFIM允许使用高接种量,这对耐药性发展的研究尤其重要,因为高细菌载量(例如108CFU/mL)更容易检测到耐药突变体。HFIM可以在患者严重细菌感染的抗生素治疗期间(5~14 d)评估联合用药对耐药性预防作用。Bulman等[31]在体外PK/PD模型(HFIM)中评估大剂量多黏菌素B(剂量5.53 mg/kg,Cmax=6 mg/L)与利福平联合治疗时多黏菌素B耐药亚群的生长水平,10 d后发现菌株仍对多黏菌素B保持高度敏感( MIC240h=0.5 mg/L)。
体外PK/PD研究中需要注意的问题:①菌株的选择:研究过程中一般应包含适当的参考菌株(如ATCC菌株或敏感菌株)来证明可重复性。需评估细菌的耐药机制,可以提供某一特定耐药机制的影响;②药动学参数,尽量选择感染患者的药动学数据应用于模拟,因为健康受试者与患者或重症患者之间的药动学过程差异非常大;③解释体外PK/PD结果,考虑抗菌药物是否快速杀菌以及判断终点(如细菌不再生长或减少2log10CFU/mL)与临床最相关,如对于严重感染菌落降低2log10CFU/mL的时间点可能更重要。
5 其他方法
Mezzatesta等[33]报道了一种快速测定多种抗菌药物组合杀菌作用的多重组合杀菌试验(multiple-combination bactericidal test,MCBT),在96孔板中加入抗菌药物30 μL及菌液70 μL(0.5麦氏浊度),24 h后检测小孔中的菌落数变化。21株多重耐药的肺炎克雷伯菌(其中11株产KPC-3酶,6株 产KPC-2酶,2株 产VIM-1酶,2株产OXA-48酶)的联合用药:①美罗培南(120 mg/L)联合厄他培南(70 mg/L)和/或多黏菌素E(20 mg/L);②利福平(6 mg/L)联合替加环素(0.9 mg/L)和/或多黏菌素E(20 mg/L);③利福平(6 mg/L)联合多黏菌素E(20 mg/L)。研究发现含有多黏菌素E的组合对所有细菌均有杀菌作用,与时间-杀菌曲线结果一致。MCBT是一种快速测试多种抗菌药物组合对多重耐药菌作用的方法,参照药物能达到的血清药物浓度设计药物浓度,能同时进行多达4种抗菌药物的联合。一项新加坡总医院291例住院患者的回顾性研究证实,MCBT体外验证有杀菌作用的抗菌药物联合用药(多黏菌素B联合碳青霉烯类或氟喹诺酮类)治疗广泛耐药革兰阴性菌的感染相关死亡率为6.0%,而经验性联合用药的死亡率为74.6%,死亡风险OR=5.75(95%CI=1.25-25.73)[34]。
个性化的药物组合筛选可以鉴别出用于治疗的分离株特异性组合。Sun等[35]开发了自动超高通量筛选技术结合细菌生长检测,对5 170种已批准的药物和其他化合物的快速筛选,筛选出25种具有抗肺炎克雷伯菌的活性(1 536孔板高通量筛选)化合物。研究进一步结合抗菌药物的临床敏感性折点、可达到的血浆浓度、临床不良反应和作用机制来确定最佳的联合用药方法,鉴定出3组3种药物组合(多黏菌素E +金诺芬+头孢他啶、多黏菌素E +金诺芬+利福平、利福平+多黏菌素E +亚胺培南)对10株多重耐药临床分离株具有广谱抗菌活性。该方法在临床应用中也得到进一步证实,1例重症感染患者血液中分离出3株多重耐药的革兰阴性菌,对8种药物组成的14种两药、三药和四药联合用药方案进行高通量筛选,庆大霉素+多黏菌素E+利福平体外抑菌率>90%,其他方案多黏菌素E+亚胺培南+利福平,多黏菌素E+美罗培南+替加环素抑菌率54%~90%,多黏菌素E+美罗培南+替加环素+头孢他啶,多黏菌素E+美罗培南+替加环素+利福平抑菌率22%~83%,选择协同作用最佳的联合方案(庆大霉素+多黏菌素E+利福平),调整治疗后取得了良好的临床疗效[36]。因此,高通量药物组合筛选有助于临床医师在有限的时间内从大量的药物组合中寻找合适的联合方案控制严重感染。
多重耐药菌感染的联合治疗目前已引起广泛关注,但体外抗菌药物联合用药协同作用的研究方法存在一定的复杂性、技术问题及结果解释的差异性,体外研究与临床治疗有效率有一定的差异。因此,建议利用体外联合用药的协同作用数据进行前瞻性临床试验来提高多重耐药菌感染临床治疗效果。

