当归多糖通过调控miR-148a-3p 抑制高糖诱导的视网膜神经节细胞氧化应激损伤及凋亡研究
曹 朗,王艳新,贾冠美
(保定市第二中心医院眼科,河北 保定 072750)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病高发眼部并发症,随着病情加重患者视力逐渐降低,严重时引发黄斑区牵引性视网膜脱落,导致失明[1]。DR 病理过程复杂,目前认为长期慢性高血糖是其重要的发病基础,视网膜神经节细胞(retinal ganglion cell,RGC)是视神经的主要构成成分,在高糖刺激下将发生氧化损伤与过度凋亡,引发DR[2]。当归多糖是当归主要活性物质之一,具有抗氧化、抗炎、抗辐射、增强免疫力、助造血及抗肿瘤等药理活性,近年来在糖尿病相关并发症中的作用逐渐受到关注。研究[3]认为,当归多糖可通过降低糖尿病肾病大鼠血糖及肾组织中炎性指标延缓病情发生。微小RNA(microRNA,miRNA)是近年来发现的一种非编码RNA 分子,在进化中具有高度保守性,且在细胞炎症反应、氧化应激及凋亡中起到重要作用。研究[4]显示,不同浓度梯度的高葡萄糖处理可降低人视网膜微血管内皮细胞中miR-148a-3p 水平,其过表达导致细胞活力增加和细胞凋亡减少,表明其或可作为DR 诊断或治疗的潜在靶点。本研究采用高糖诱导RGC 细胞株RGC-5,建立RGC-5 损伤模型,观察当归多糖对其氧化应激损伤及凋亡的影响,以及miR-148a-3p 在该过程中的作用,以期为临床提供参考。
1 材料与方法
1.1 细胞系 大鼠RGC 细胞株RGC-5,购自上海复旦细胞中心。
1.2 药物、主要试剂、仪器 当归多糖,陕西慈缘生物技术有限公司;阴性对照载体miR-NC、miR-148a-3p 过表达载体miR-148a-3p mimics、miR-148a-3p 低表达载体miR-148a-3p inhibitor,上海雅吉生物科技有限公司合成;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒,舜冉(上海)生物科技有限公司;兔抗大鼠B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)一抗,美国Abcam 公司;实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)试剂盒,上海钦诚生物科技有限公司。
DxFLEX 流式细胞仪,美国贝克曼库尔特公司;qRT-PCR 仪,美国ABI 公司;CheniDoc XRS 化学发光成像分析系统,美国Bio-rad 公司。
1.3 细胞培养 RGC-5 细胞培养于DMEM 培养基(含10%胎牛血清)中,培养箱标准条件下(37℃,5%CO2)培育,每3 天传代培养1 次,取对数期细胞进行后续实验。
1.4 分组 取对数期RGC-5 细胞,以每孔2.5×104个接种至24 孔板中。将细胞分为对照组(常规培养基培养)、高糖组(含葡萄糖30 mmol/L 的培养基培养)、高糖+低剂量组(含葡萄糖30 mmol/L 与当归多糖100 mg/L 的培养基培养)、高糖+中剂量组(含葡萄糖30 mmol/L 与当归多糖200 mg/L 的培养基培养)、高糖+高剂量组(含葡萄糖30 mmol/L 与当归多糖400 mg/L 的培养基培养)[5]。培养48 h 后用于后续实验。
1.5 ELISA 法检测细胞SOD 活性及MDA 水平 收集培养48 h 后的各组细胞,加入细胞裂解液冰上裂解,4 000 r/min 离心15 min,取上清液,冷冻保存备用。采用SOD 及MDA 试剂盒检测上清液中SOD 活性及MDA 水平。
1.6 AnnexinV/PITC 双染法检测细胞凋亡率 收集培养48 h 后的各组细胞,PBS 溶液洗涤,弃上清,取100 μL 细胞悬液(每毫升1×106个)接种至6 孔板,继续培养24 h,离心,PBS 洗涤,弃上清,与Anexin V-FITC 染液5 μL、PI 染液10 μL 混合均匀,避光孵育20 min,加入binding buff er 200 μL 标记液洗涤2 次,60 min 内经流式细胞仪测定凋亡情况,Cell Quest TMD Analysis 软件分析凋亡率。
1.7 Western blot 法检测细胞Bax、Bcl-2 蛋白表达量收集培养48 h 后的各组细胞,PBS 溶液洗涤,移至离心管,RIPA 裂解液裂解,离心15 min,BCA 试剂盒测定并定量总蛋白。取待测蛋白50 μg,与4 倍上样缓冲液混合,沸水浴变性,离心取上清,恒压下电泳分离、转膜,封闭液封闭2 h,加入兔抗大鼠Bax、Bcl-2 一抗(1:500),4 ℃冷藏过夜,TBST 清洗,加入二抗(1:2 000),摇床孵育2 h,TBST 清洗,ECL液发光,暗室显影,成像分析仪分析,以Bax、Bcl-2蛋白与内参GAPDH 的灰度值比值代表蛋白表达量。
1.8 qRT-PCR 法检测细胞miR-148a-3p 表达量 收集培养48 h 后的各组细胞,PBS 溶液洗涤,Trizol 法提取总RNA,反转录获取cDNA,根据qRT-PCR 试剂盒说明书设置反应体系:双倍核酸染料12 μL,上、下游引物(10 μmol/L)各1 μL,cDNA 1 μL,加dd H2O 补充至总体积20 μL。扩增条件:92 ℃预变性4 min;92 ℃变性30 s,60 ℃退火60 s,72 ℃延伸30 s,重复35个循环。以GAPDH 为管家基因,2-△△Ct为目的基因相对表达强度,所有实验重复3次取CT平均值。以U6为内参基因,检测miR-148a-3p 表达,2-△△Ct法分析并计算相对表达强度。实验所用引物:miR-148a-3p Forward primer,5’-ACTGTGTCATGCACGCGTCAGTGG-3’;Reverse primer,5’-CGTACGCGTGCACCGCCTTGTGTA-3’;U6 Forward primer,5’-TACACAACAGTGCACACACC GTGC-3’;Reverse primer,5’-AAACTGTGCACGGTT CTGTCACGC-3’。
1.9 细胞转染及分组 取对数期RGC-5 细胞,以每孔2.5×104个接种至24 孔板中。将细胞分为高糖+miR-NC 组(含葡萄糖30 mmol/L 的培养基培养,按照LipofectamineTM3000 脂质体法转染说明书转染阴性对照载体miR-NC)、高糖+miR-148a-3p mimics 组(含葡萄糖30 mmol/L 的培养基培养,转染miR-148a-3p 过表达载体miR-148a-3p mimics)、高糖+miR-148a-3p inhibitor 组(含葡萄糖30 mmol/L 的培养基培养,转染miR-148a-3p 低表达载体miR-148a-3p inhibitor)、高糖+当归多糖+miR-148a-3p mimics 组(含葡萄糖30 mmol/L 与当归多糖400 mg/L 的培养基培养,转染miR-148a-3p 过表达载体miR-148a-3p mimics)、高糖+当归多糖+miR-148a-3p inhibitor 组(含葡萄糖30 mmol/L 与当归多糖400 mg/L 的培养基培养,转染miR-148a-3p 低表达载体miR-148a-3p inhibitor)。转染48 h 后用于后续实验。
1.10 qRT-PCR 法检测细胞miR-148a-3p 表达量 收集转染48 h 后的各组细胞,操作同1.8,检测细胞miR-148a-3p 表达量。
1.11 检测高糖诱导的RGC 氧化应激损伤及凋亡 收集转染48 h 后的各组细胞,操作同1.5、1.6、1.7,检测细胞SOD 活性及MDA 水平,细胞凋亡率,细胞Bax、Bcl-2 蛋白表达量。
1.12 统计学方法 采用SPSS 21.0 统计学软件进行数据分析,以均数±标准差()表示计量资料,以单因素方差分析比较多样本资料,两两样本资料比较采用LSD-t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 当归多糖对高糖诱导的RGC 氧化应激损伤的影响 与对照组比较,高糖组SOD 活性降低,MDA 水平升高(P<0.05);与高糖组比较,高糖+低剂量组SOD 活性升高,MDA 水平降低(P<0.05);与高糖+低剂量组比较,高糖+中剂量组SOD活性升高,MDA 水平降低(P<0.05);与高糖+中剂量组比较,高糖+高剂量组SOD 活性升高,MDA 水平降低(P<0.05)。见表1。
表1 各组SOD 活性、MDA 水平比较()
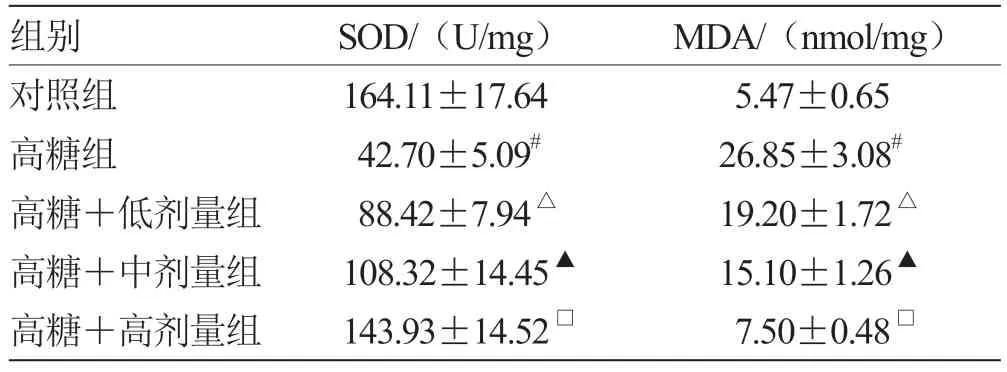
表1 各组SOD 活性、MDA 水平比较()
注:与对照组比较,# P <0.05;与高糖组比较,△P <0.05;与高糖+低剂量组比较,▲P <0.05;与高糖+中剂量组比较,□P <0.05
2.2 当归多糖对高糖诱导的RGC 凋亡率的影响 与对照组比较,高糖组凋亡率升高(P<0.05);与高糖组比较,高糖+低剂量组凋亡率降低(P<0.05);与高糖+低剂量组比较,高糖+中剂量组凋亡率降低(P<0.05);与高糖+中剂量组比较,高糖+高剂量组凋亡率降低(P<0.05)。见表2。
表2 各组凋亡率比较( ) %

表2 各组凋亡率比较( ) %
注:与对照组比较,# P <0.05;与高糖组比较,△P <0.05;与高糖+低剂量组比较,▲P <0.05;与高糖+中剂量组比较,□P <0.05
2.3 当归多糖对高糖诱导的RGC 凋亡相关蛋白Bax、Bcl-2 表达的影响 与对照组比较,高糖组Bax 蛋白表达量升高,Bcl-2 蛋白表达量降低(P<0.05);与高糖组比较,高糖+低剂量组Bax 蛋白表达量降低,Bcl-2 蛋白表达量升高(P<0.05);与高糖+低剂量组比较,高糖+中剂量组Bax 蛋白表达量降低,Bcl-2蛋白表达量升高(P<0.05);与高糖+中剂量组比较,高糖+高剂量组Bax 蛋白表达量降低,Bcl-2 蛋白表达量升高(P<0.05)。见表3,图1。
表3 各组Bax、Bcl-2 蛋白表达量比较()

表3 各组Bax、Bcl-2 蛋白表达量比较()
注:与对照组比较,# P <0.05;与高糖组比较,△P <0.05;与高糖+低剂量组比较,▲P <0.05;与高糖+中剂量组比较,□P <0.05
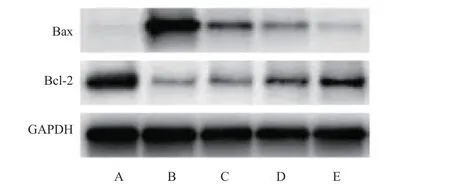
图1 细胞Bax、Bcl-2 蛋白表达
2.4 当归多糖对高糖诱导的RGC 中miR-148a-3p 表达的影响 与对照组比较,高糖组miR-148a-3p 表达量降低(P<0.05);与高糖组比较,高糖+低剂量组miR-148a-3p 表达量升高(P<0.05);与高糖+低剂量组比较,高糖+中剂量组miR-148a-3p 表达量升高(P<0.05);与高糖+中剂量组比较,高糖+高剂量组miR-148a-3p 表达量升高(P <0.05)。见表4。
表4 各组miR-148a-3p 表达量比较( )
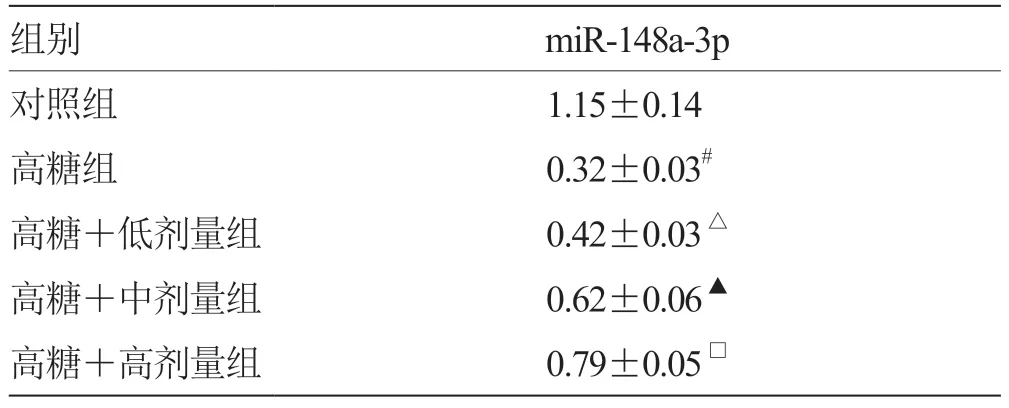
表4 各组miR-148a-3p 表达量比较( )
注:与对照组比较,# P <0.05;与高糖组比较,△P <0.05;与高糖+低剂量组比较,▲P <0.05;与高糖+中剂量组比较,□P <0.05
2.5 miR-148a-3p 表达对高糖诱导的RGC 氧化应激损伤的影响 与高糖+miR-NC 组比较,高糖+miR-148a-3p mimics 组miR-148a-3p 表达量及SOD 活性升高,MDA 水平降低(P<0.05),高糖+miR-148a-3p inhibitor 组miR-148a-3p 表达量及SOD 活性降低,MDA 水平升高(P<0.05);与高糖+miR-148a-3p mimics 组比较,高糖+当归多糖+miR-148a-3p mimics组miR-148a-3p 表达量及SOD 活性升高,MDA 水平降低(P<0.05);与高糖+miR-148a-3p inhibitor 组比较,高糖+当归多糖+miR-148a-3p inhibitor 组miR-148a-3p 表达量及SOD 活性升高,MDA 水平降低(P<0.05)。见表5,表6。
表5 各组miR-148a-3p 表达量比较( )
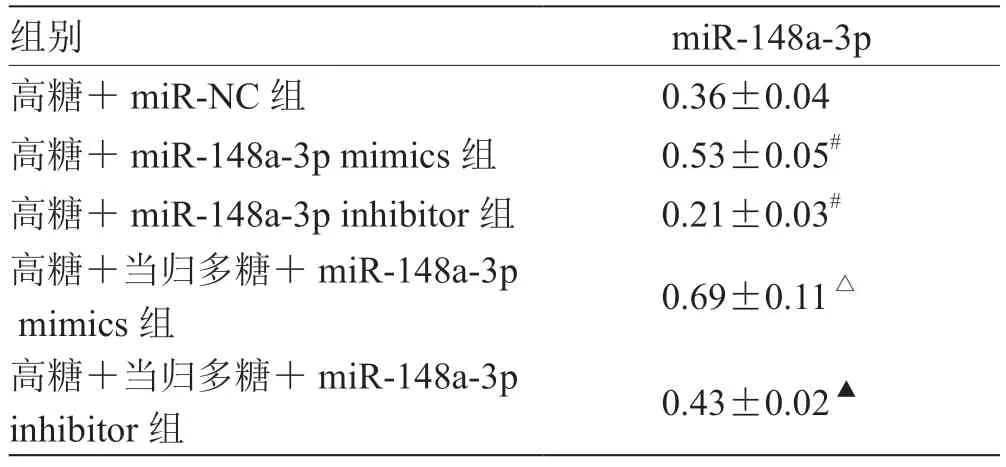
表5 各组miR-148a-3p 表达量比较( )
注:与高糖+miR-NC 组比较,# P <0.05;与高糖+miR-148a-3p mimics 组比较,△P <0.05;与高糖+miR-148a-3p inhibitor 组比较,▲P <0.05
表6 各组SOD 活性、MDA 水平比较()

表6 各组SOD 活性、MDA 水平比较()
注:与高糖+miR-NC 组比较,# P <0.05;与高糖+miR-148a-3p mimics 组比较,△P <0.05;与高糖+miR-148a-3p inhibitor 组比较,▲P <0.05
2.6 miR-148a-3p 表达对高糖诱导的RGC 凋亡率的影响 与高糖+miR-NC 组比较,高糖+miR-148a-3p mimics 组凋亡率降低(P<0.05),高糖+miR-148a-3p inhibitor 组凋亡率升高(P<0.05);与高糖+miR-148a-3p mimics 组比较,高糖+当归多糖+miR-148a-3p mimics 组凋亡率降低(P<0.05);与高糖+miR-148a-3p inhibitor 组比较,高糖+当归多糖+miR-148a-3p inhibitor 组凋亡率降低(P<0.05)。见表7。
表7 各组凋亡率比较( ) %

表7 各组凋亡率比较( ) %
注:与高糖+miR-NC 组比较,# P <0.05;与高糖+miR-148a-3p mimics 组比较,△P <0.05;与高糖+miR-148a-3p inhibitor 组比较,▲P <0.05
2.7 miR-148a-3p 表达对高糖诱导的RGC 凋亡相关蛋白Bax、Bcl-2 表达的影响 与高糖+miR-NC 组比较,高糖+miR-148a-3p mimics 组Bax 蛋白表达量降低,Bcl-2 蛋白表达量升高(P<0.05),高糖+miR-148a-3p inhibitor 组Bax 蛋白表达量升高,Bcl-2 蛋白表达量降低(P<0.05);与高糖+miR-148a-3p mimics组比较,高糖+当归多糖+miR-148a-3p mimics 组Bax 蛋白表达量降低,Bcl-2 蛋白表达量升高(P<0.05);与高糖+miR-148a-3p inhibitor 组比较,高糖+当归多糖+miR-148a-3p inhibitor 组Bax 蛋白表达量降低,Bcl-2 蛋白表达量升高(P<0.05)。见表8,图2。
表8 各组Bax、Bcl-2 蛋白表达量比较()

表8 各组Bax、Bcl-2 蛋白表达量比较()
注:与高糖+miR-NC 组比较,# P <0.05;与高糖+miR-148a-3p mimics 组比较,△P <0.05;与高糖+miR-148a-3p inhibitor 组比较,▲P <0.05

图2 细胞Bax、Bcl-2 蛋白表达
3 讨论
RGC 是各级视网膜神经元中唯一参与视神经纤维形成且将视网膜视觉信息传递至视觉中枢的神经元,RGC 间相互镶嵌构成视网膜的内层结构,其轴突集合形成视神经。RGC 损伤是DR 的早期特征及主要病因,持续高血糖是诱导其发生的重要原因之一[6]。研究[7]认为,高糖诱导RGC 损伤与线粒体功能障碍、自身免疫、钙离子超载、谷氨酸兴奋毒性、神经营养因子缺乏及氧化应激密切相关。研究[8]指出,保护RGC、减轻其高糖诱导的氧化应激损伤可延缓DR 发生。
正常生理状态下,机体中氧自由基为动态平衡状态,在高糖状态下,RGC 中的SOD 活性降低,无法及时清除活性氧而致其聚集在细胞中,引起脂质过氧化,生成大量MDA,引发氧化损伤[9]。氧化应激进一步诱导细胞凋亡发生,其途径与凋亡相关蛋白Bax、Bcl-2 有关,Bax 蛋白表达量升高对细胞凋亡具有促进作用,Bcl-2 蛋白表达量升高对细胞凋亡具有抑制作用[10]。本研究结果显示,经当归多糖处理后,高糖诱导的RGC 中SOD 活性、Bcl-2 蛋白表达量升高,MDA 水平、凋亡率、Bax 蛋白表达量降低,且表现为剂量依赖性,提示当归多糖可减轻高糖诱导的RGC 氧化应激损伤,减少凋亡。当归多糖是伞形科植物当归的提取物,含有D-木糖、鼠李糖、阿拉伯糖、D-半乳糖、半乳糖醛酸等多种成分,具有显著的免疫促进效应及抗氧化活性,可减轻胰岛β 细胞损伤,增强胰、肾、心、脑及眼中SOD 活性,降低MDA 含量,减轻过氧化损伤[11]。
miRNA 广泛存在于真核生物中,通过与靶向基因的mRNA 完全或者不完全互补结合,使其降解或抑制其蛋白翻译,从而调控细胞功能[12-13]。本研究结果显示,高糖可抑制miR-148a-3p 表达,过表达miR-148a-3p 可减轻高糖诱导的RGC 氧化应激损伤及凋亡,抑制其表达将加剧高糖诱导的RGC 氧化应激损伤及凋亡,提示miR-148a-3p 可作为治疗DR 的潜在靶点。本研究结果显示,当归多糖可上调高糖诱导的RGC 中miR-148a-3p 表达,且表现为剂量依赖性,而抑制miR-148a-3p表达则可逆转当归多糖对高糖诱导的RGC 的影响,提示当归多糖可能通过上调miR-148a-3p 表达减轻高糖诱导的RGC 氧化应激损伤,减少细胞凋亡。
综上所述,当归多糖可减轻高糖诱导的RGC 氧化应激损伤,减少细胞凋亡,且表现为剂量依赖性,其作用机制可能与上调miR-148a-3p 表达有关。

