基于体外发酵模型分析植物多糖对T2DM患者肠道菌群及代谢的影响
贾丽娜,马 倩,王新月,葛艳艳,王 楠,何红鹏,罗学刚,朱立颖,贾卫国,郝力壮,齐 威,
(1.天津科技大学生物工程学院,天津 300457;2.浙江省农业科学院,浙江 杭州 310021;3.四川省第五人民医院,四川 成都 610014;4.青海省高原放牧家畜动物营养与饲料科学重点实验室,青海省牦牛工程技术研究中心,青海大学畜牧兽医科学院,青海 西宁 810016)
2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病患者的90%~95%,是一种发病率和患病率都呈现快速增长的全球性流行病[1]。2019年全球糖尿病地图(第9版)报告指出,2019年全球约有4.63亿20~79 岁的成人患糖尿病。其中,中国糖尿病患者数量排在了印度和美国前面,位居第一,达1.164亿[2]。T2DM的发病是环境和遗传因素相互作用的结果,环境因素的影响大于遗传因素。大量研究证明,肠道微生物失调作为一个重要的环境因素,在糖尿病发展中起着重要作用[1]。T2DM现在已成为第一个被定义肠道菌群特征的人类慢性疾病[3],因此,靶向调节肠道微生物可能是改善T2DM的有效策略[4]。
多糖是重要的天然高分子化合物,广泛存在于药食同源植物中,也是中药水煎液的关键生物活性成分,具有降血糖、抗氧化、免疫调节等生理作用,在改善T2DM等疾病方面发挥着重要作用[5]。由于人类基因组编码的消化酶有限,多糖摄入人体后经口、胃、小肠等器官通常不被消化,最终进入结肠并被不同肠道微生物降解产生许多不同链长、结构构象和分支数量的低聚糖,这些低聚糖可以促进有益菌的生长,如双歧杆菌和拟杆菌[6]。同时,这些低聚糖还能够被肠道菌群代谢形成多种生物活性物质,如短链脂肪酸(shortchain fatty acid,SCFA)、乳酸、氢和二氧化碳等,进而影响宿主的生理状态[7]。
大量研究报道植物多糖具有降血糖活性,虽然不同植物多糖的降糖机制存在差异,但其主要是在促进胰岛素分泌、抑制胰岛细胞凋亡、增强胰岛素敏感性、降低胰岛素抵抗、提高抗氧化应激能力、调节相关信号通路、调节肠道菌群等方面发挥作用,因此植物多糖可作为抗糖尿病的潜在药物[8]。肠道菌群影响T2DM患者代谢的潜在机制主要有以下几个方面[9]:一是调节炎症,总的来说T2DM与促炎细胞因子、趋化因子和炎性蛋白水平有关,一些肠道微生物及其代谢物可以通过促进抗炎细胞因子和趋化因子分泌,同时抑制促炎细胞因子的分泌预防和改善机体的炎症反应;二是降低肠道通透性,肠道通透性增加是T2DM的一个特征,它会导致肠道菌群代谢物易位进入血液并引起代谢性内毒素血症,据报道,两种对T2DM可能有益的拟杆菌(Bacteroides vulgatus和B.dorei)可通过调节结肠中紧密连接基因的表达,降低肠道通透性,减少脂多糖的生成,改善小鼠的内毒素血症[10];三是葡萄糖代谢,肠道菌群可以通过调节肝脏等主要代谢器官中的胰岛素抵抗和葡萄糖稳态,以及肠道中的消化和控糖激素的产生影响T2DM,例如一种潜在益生菌(Bifidobacterium lactis)可以增加糖原合成并降低肝脏糖异生相关基因的表达[11];四是脂肪酸氧化、合成和能量消耗,增加脂肪酸氧化和能量消耗并减少脂肪酸合成可改善肥胖和T2DM,据报道,Akkermansia muciniphila、B.acidifaciens、Lactobacillus gasseri和SCFA会增加脂肪组织中的脂肪酸氧化[12];五是细菌间的综合作用,一些微生物可以通过增加其他潜在的有益微生物或通过交叉喂养影响宿主生理,如Bifodobacterium的几个菌种与其他菌群(如Faecalibacterium和Roseburia)具有交叉喂养作用[13],L.rhamnosus可以增加大鼠盲肠中Bifidobacterium的丰度[14],L.casei可以增加产丁酸细菌的丰度[15]。
本研究采用体外发酵模型,分析黄芪多糖、苍术多糖、玄参多糖、红枣多糖和乌梅多糖5 种植物多糖对T2DM患者粪便微生物及其产气情况、SCFA和代谢物质的影响,探究5 种多糖潜在的益生作用,以期为植物多糖与肠道菌群的相互作用研究提供参考。
1 材料与方法
1.1 材料与试剂
黄芪购买自甘肃岷县,苍术购买自内蒙古自治区,玄参、乌梅购买自云南大理,红枣购买自新疆和田地区。
无水乙醇 天津市江天化工技术股份有限公司;核糖醇、N-甲基-N-(三甲基硅烷)三氟乙酰胺(N-methyl-N-(trimethylsilyl)trifluoroacetamide,MSTFA)、甲氧胺盐酸盐 美国Sigma公司;乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸 上海麦克林生化科技有限公司。
1.2 仪器与设备
-80 ℃冰箱 浙江捷盛低温设备有限公司;超净工作台 苏州净化设备有限公司;离心机 湖南湘仪离心机仪器有限公司;电子天平 美国康州电子科技有限公司;7890B-5977B气相色谱-质谱联用仪 美国Agilent公司;快速冷冻干燥机 德国Christ公司;旋转蒸发仪 瑞士Büchi公司;GC9720 plus气相色谱仪 浙江福立分析仪器股份有限公司;HL-QT01体外发酵气体分析仪 苏州海路生物技术有限公司。
1.3 方法
1.3.1 多糖提取及成分测定
原料用粉碎机粉碎置于锥形瓶中,按1∶8(g/mL)加入蒸馏水,混合均匀后于90 ℃条件下水浴6~7 h,用3 层纱布过滤后6000 r/min离心10 min得粗多糖提取液。用旋转蒸发仪低于65 ℃浓缩粗多糖提取液,之后缓慢加入5 倍量(V/V)的95%乙醇溶液,过夜沉降,8000 r/min离心10 min,收集沉淀,静置挥发残留乙醇,-80 ℃预冻多糖溶液24 h以上后冷冻干燥,收集备用。黄芪多糖、苍术多糖、玄参多糖、红枣多糖和乌梅多糖得率分别为9.48%、27.80%、5.62%、3.82%和10.40%。
对5 种多糖进行简单的成分测定:采用苯酚-硫酸法测得黄芪多糖、苍术多糖、玄参多糖、红枣多糖和乌梅多糖总糖质量分数分别为65.73%、91.13%、87.35%、25.60%、81.90%;采用Bradford法测得黄芪多糖、苍术多糖、玄参多糖、红枣多糖和乌梅多糖蛋白质质量分数分别为0.79%、1.58%、2.19%、0.35%、2.59%。
1.3.2 粪便样本采集及体外发酵
本实验召集6 名志愿者,2 男4 女,年龄阶段20~70 岁。实验分为2 组:NC组,3 名正常人;T2DM组,3 名糖尿病人。所有志愿者近3 个月正常饮食,在这3 个月内没有服用抗生素或益生菌等。研究人员对所有志愿者进行了全面解释,并获得了书面同意。并经四川大学华西医院生物医学伦理委员会审核通过,批准号为2018(286)。
使用自动粪便处理仪将新鲜粪便(0.8±0.02)g加入到8 mL 0.1 mol/L磷酸盐缓冲液(pH 7.0)中,处理成10 g/100 mL的粪便悬浊液。吸取500 μL悬浮液分别接种于酵母浸粉-水解酪蛋白-脂肪酸(yeast extract-casein hydrolysate-fatty acids,YCFA)培养基和添加5‰多糖的YCFA培养基中,37 ℃厌氧培养24 h。
1.3.3 16S rRNA基因测序
取发酵液4 ℃、12000 r/min离心10 min,菌体沉淀送至上海美吉生物医药科技有限公司,完成16S rRNA基因测序。
1.3.4 代谢组分析
取发酵液4 ℃、12000 r/min离心10 min,取200 μL上清液,加入20 μL核糖醇(内标),真空冷冻干燥。冻干样品中加入50 μL含甲氧胺盐酸盐(20 mg/mL)的吡啶溶液,在40 ℃水浴肟化反应90 min,加入80 μL的MSTFA,在37 ℃水浴硅烷化反应30 min,经0.22 μm有机微孔滤膜过滤溶液除去杂质后,进行气相色谱-质谱检测[16]。利用NIST05谱库初步鉴定成分,结合化学成分的实际成分和保留时间等进行定性。采用面积归一化法进行相对定量。
1.3.5 SCFA检测
取500 μL发酵液加入100 μL巴豆酸偏磷酸溶液,振荡混匀后-30 ℃酸化反应24 h,随后将样品于4 ℃、10000 r/min离心3 min,上清液过0.22 μm滤膜,使用气相色谱仪分析乙酸、丙酸、丁酸、异丁酸、异戊酸和戊酸。利用外标法进行绝对定量。
1.3.6 气体成分测定
利用气体分析仪检测发酵后样品小瓶中CO2、CH4、H2、H2S气体的体积。
1.4 数据处理与分析
所有样品的测定均重复3 次。利用SPSS Statistics 22.0软件对数据进行显著性分析(P<0.05),采用GraphPrism 8软件绘图,利用SIMCA 14.1软件和Metaboanalyst 5.0网站(http://www.metaboanalyst.ca)进行代谢通路分析。
2 结果与分析
2.1 植物多糖对肠道菌群产气情况的影响
人体肠道气体图谱在很大程度上取决于微生物组成和底物[17],因此,利用体外发酵技术评估肠道微生物利用植物多糖产生的气体情况。相较于正常人,T2DM患者肠道菌群发酵多糖产气体积有所减少,CO2、H2、CH4、H2S含量也减少(表1)。不同植物多糖对肠道菌群代谢产气作用有差异,乌梅多糖降低了各组的产气体积和H2S产量,其余多糖组的产气量均有增加。5 种多糖均能降低NC组的H2S含量。5 种多糖均能提高T2DM组的CO2和CH4含量,降低H2S含量,红枣多糖能够提高T2DM组H2含量。T2DM患者肠道微生物发酵苍术多糖产生的CO2含量最高,发酵红枣多糖产生CH4、H2和H2S含量最高。结果表明添加植物多糖能够影响肠道菌群产气情况,因此,植物多糖可能通过调节肠道中细菌产生的气体成分及含量对宿主产生影响。
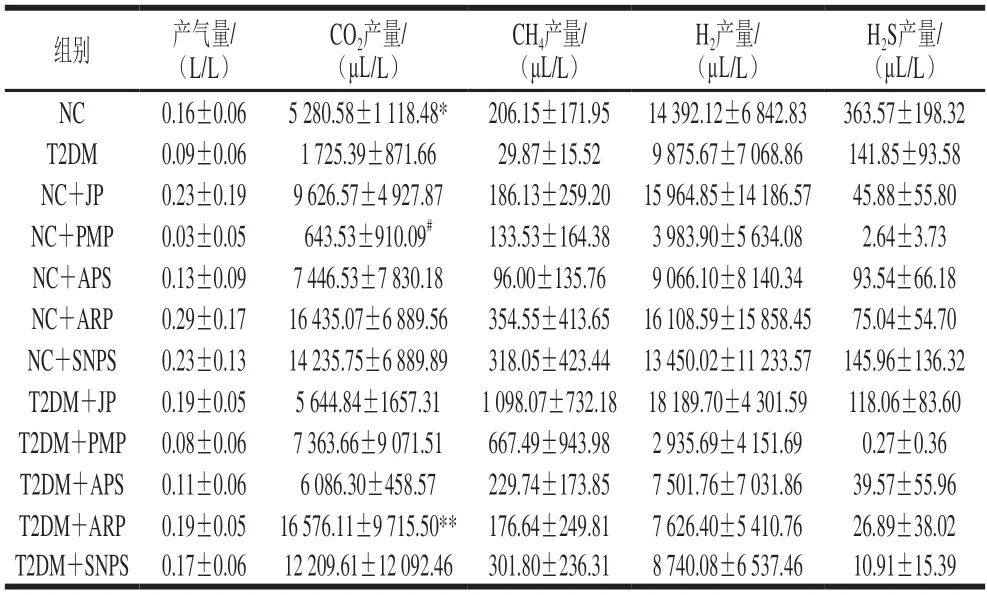
表1 植物多糖对肠道菌群体外发酵产气的影响Table 1 Effects of plant polysaccharides on gas production by fermentation of intestinal bacteria in vitro
2.2 植物多糖对肠道菌群产生SCFA的影响
T2DM患者肠道菌群体外发酵产生SCFA水平显著低于正常人(表2)。5 种植物多糖均能够提高T2DM组的SCFA总量、丁酸、戊酸、异丁酸和异戊酸含量,尤其是以黄芪多糖、苍术多糖和玄参多糖效果显著。红枣多糖、苍术多糖对T2DM组乙酸具有一定的调节作用,分别提高了20.29%、75.01%。红枣多糖、黄芪多糖、苍术多糖和玄参多糖对T2DM组丙酸具有一定的调节作用,分别提升了130.80%、259.06%、185.33%和248.01%。SCFA作为肠道细菌产生的代谢物,介导人体和肠道微生物之间的相互作用。SCFA是肠道菌群与宿主之间信号传递的重要物质,能够增强屏障功能、维持免疫系统健康和降低肠腔内的氧含量等功能,对糖尿病具有益处[18]。植物多糖能够影响肠道菌群代谢乙酸、丙酸、丁酸、戊酸等含量,且可能通过调节肠道中细菌产生的SCFA成分及含量对宿主产生影响。

表2 植物多糖对SCFA浓度的影响Table 2 Effects of plant polysaccharides on SCFA contents μmol/mL
2.3 植物多糖对肠道菌群代谢组的影响
利用气相色谱-质谱代谢组学技术对所有样品的代谢物进行分析,共检测到105 种代谢产物,其中包括有机酸类(39 种)、氨基酸类(23 种)、糖类(2 种)、醇类(12 种)、酯类(2 种)、酚类(1 种)、核酸类(3 种)、胺类(9 种)。应用正交偏最小二乘判别分析方法,结果显示样品能明显区分,说明不同处理组的代谢物有差异,菌群的代谢情况发生改变(图1)。

图1 正交偏最小二乘判别分析图Fig.1 Orthogonal partial least squares-discriminant analysis
与NC组相比,T2DM患者肠道菌群体外发酵组17 种代谢物发生了显著变化:木糖醇、亮氨酸、丙氨酸、缬氨酸、谷氨酸、异亮氨酸、尸胺、焦谷氨酸、苯丙氨酸、甘氨酸、鸟氨酸、D-焦谷氨酸、酪氨酸、脯氨酸、苯丙氨酸、乳酸、5-氨基戊酸。其中前16 种代谢物相对于NC组显著上调,5-氨基戊酸显著下调。显著性差异代谢物主要与氨基酸代谢通路相关,包括谷胱甘肽代谢,精氨酸和脯氨酸代谢,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,谷氨酰胺和谷氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,酪氨酸代谢,乙醛酸和二羧酸代谢,戊糖和葡萄糖醛酸的相互转化。
多糖处理能够改变T2DM患者菌群体外发酵的代谢图谱。乌梅多糖、红枣多糖、玄参多糖、黄芪多糖和苍术多糖处理组都显著上调了乳酸、D-焦谷氨酸,下调了尸胺。值得注意的是,不同多糖对代谢的影响存在差异性。黄芪多糖组上调了丙氨酸、亮氨酸、甘氨酸,下调了尸胺;苍术多糖组上调了甘氨酸、亮氨酸,下调了脯氨酸、缬氨酸、异亮氨酸、尸胺;玄参多糖组下调了缬氨酸、脯氨酸、亮氨酸、异亮氨酸、苯丙氨酸;乌梅多糖组上调了木糖醇,下调了缬氨酸、脯氨酸、亮氨酸、丙氨酸;红枣多糖组上调了甘氨酸、丙氨酸、苯丙氨酸,下调了苯丙氨酸、脯氨酸。
2.4 植物多糖对肠道菌群结构的影响
2.4.1 多样性分析
如图2所示,曲线平缓显示测序的数据准确可靠。α多样性分析常用Chao指数和ACE指数衡量群落丰富度,这两个指数越高表明微生物的丰度越高。如图3所示,T2DM组与NC组间的α多样性指数无显著差异,这与已报道的研究结果一致[19];经过多糖处理后,α多样性指数也无明显差异。如图4所示,β多样性分析显示不同处理组样品两两分离,说明不同处理组的微生物组成存在差异性,肠道菌群组成发生了一定程度的改变。


图2 稀释曲线Fig.2 Rarefaction curves
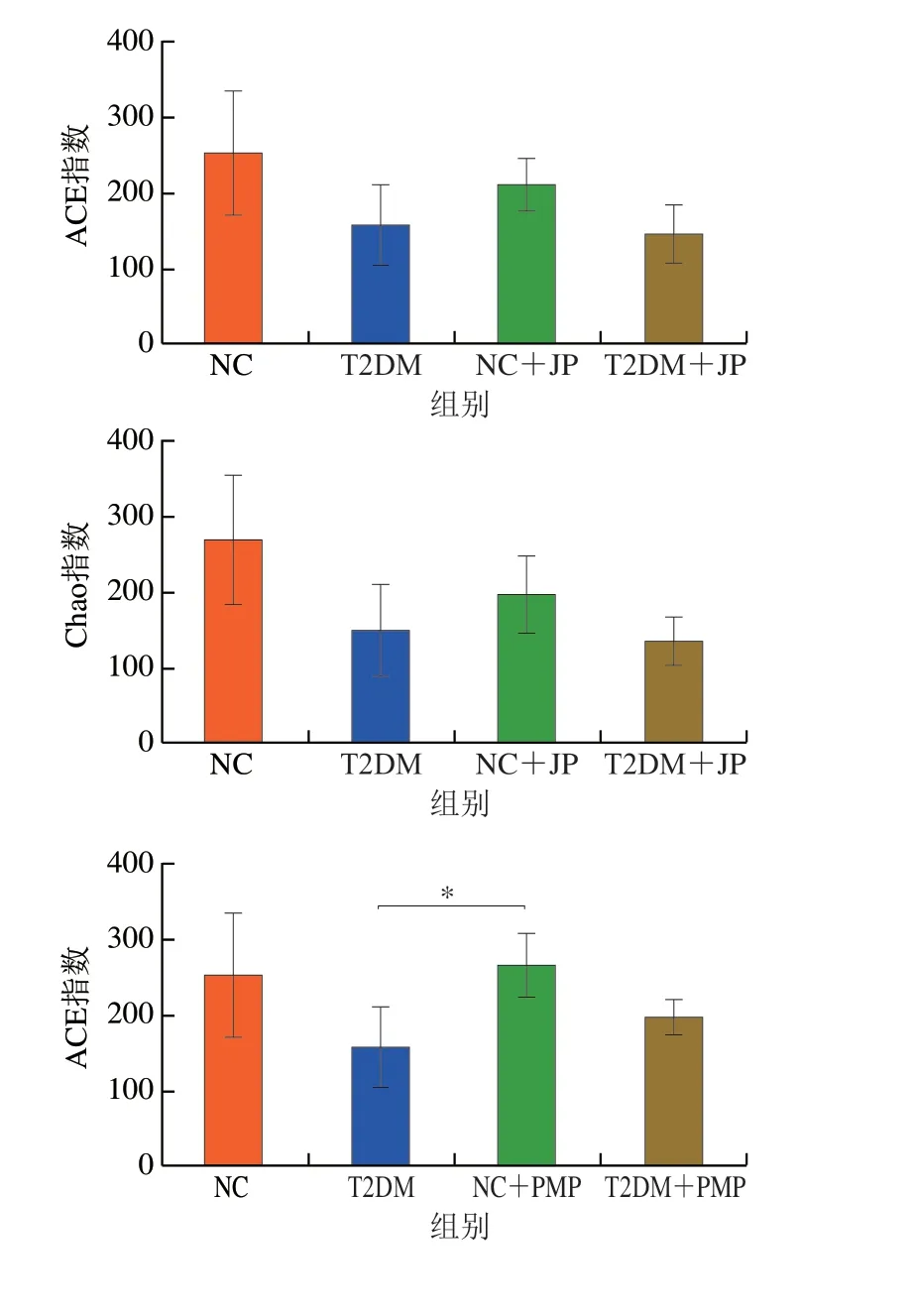


图3 α多样性分析Fig.3 α Diversity analysis

图4 主坐标分析Fig.4 PCoA analysis
2.4.2 肠道微生物组成分析
Venn图是统计多个组别中所共有和独有的物种数目,可以比较直观地看出不同环境样本中物种组成情况。肠道菌群在属水平上分布的结果见图5,NC组共152 个属、T2DM组含有108 个属,黄芪多糖+NC组含有122 个属(特有属5 个)、黄芪多糖+T2DM组102 个属(特有属11 个),乌梅多糖+NC组含有180 个属(特有属27 个)、乌梅多糖+T2DM组含有138 个属(特有属18 个),苍术多糖+NC组含有128 个属(特有属4 个)、苍术多糖+T2DM组含有93 个属(特有属7 个),红枣多糖+NC组含有128 个属(特有属10 个)、红枣多糖+T2DM组含有93 个属(特有属2 个),玄参多糖+NC组含有129 个属(特有属4 个)、玄参多糖+T2DM组含有102 个属(特有属7 个)。
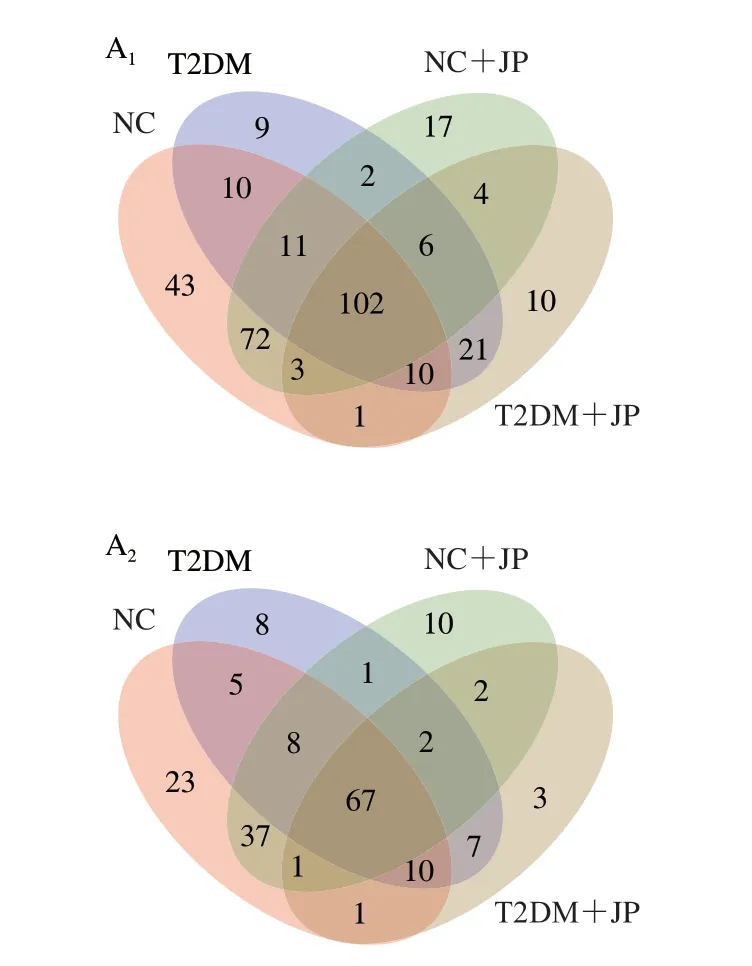


图5 Venn图分析Fig.5 Venn diagram analysis
肠道菌群在种水平上分布的结果显示,NC组共252 个种、T2DM组含有171 个种、黄芪多糖+NC组含有207 个种(特有种12 个)、黄芪多糖+T2DM组167 个种(特有种18 个),乌梅多糖+NC组含有298 个种(特有种49 个)、乌梅多糖+T2DM组含有212 个种(特有种29 个),苍术多糖+NC组含有219 个种(特有种11 个)、苍术多糖+T2DM组含有154 个种(特有种9 个),红枣多糖+NC组含有217 个种(特有种17 个)、红枣多糖+T2DM组含有157 个种(特有种8 个),玄参多糖+NC组含有230 个种(特有种4 个)、玄参多糖+T2DM组含有167 个种(特有种7 个)。不同多糖处理组样品间微生物组成存在差异,植物多糖发酵可能对微生物菌落结构和物种组成有影响。
2.4.3 肠道微生物相对丰度显著差异的分析
肠道菌群在门水平上组成主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)。由图6A可知,5 种植物多糖都提高了Firmicutes丰度、提高了NC组Bacteroidota丰度、降低了T2DM组Bacteroidota丰度。乌梅多糖显著降低了Actinobacteriota丰度。5 种植物多糖降低Bacteroidota丰度,并增加Firmicutes丰度,与滇黄精中的总多糖作用类似,多糖可以在门水平上改善肠道的微生态环境[20]。
由图6 B 可知,与T2 DM 组相比,植物多糖+T2DM组均提高了Faecalibacterium、Roseburia的丰度,降低了Escherichia的丰度,表明5 种多糖能够富集Faecalibacterium、Roseburia;同时除乌梅多糖外,其他多糖均能够提高Megamonas的丰度;黄芪多糖+T2DM组提高Bifidobacterium、Bacteroides、Akkermansia丰度,降低Ruminococcus丰度;玄参多糖+T2DM组提高Bacteroides丰度;红枣多糖+T2DM组提高Bifidobacterium、Akkermansia丰度,降低Ruminococcus丰度;乌梅多糖+T2DM组提高Blautia的丰度;苍术多糖+T2DM组提高Bifidobacterium、Akkermansia丰度。Escherichia coli能够促进糖尿病,而Akkermansia和Bifidobacterium对T2DM具有改善作用,B.longum、B.infantis、B.Animals、B.carinii、B.brevis等都显示对糖耐量有所改善[3,21]。简言之,植物多糖能够改善菌群结构,促进有益微生物的生长,抑制有害微生物的增长。

图6 群落组成分析Fig.6 Analysis of intestinal microbial composition
2.4.4 肠道菌群功能预测
对测序结果样本中微生物群落的功能组成进行预测(图7),丰度较高的京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路包括氨基酸生物合成、氨基酸和核苷酸糖代谢、ABC转运蛋白、碳代谢、次生代谢产物的生物合成、嘌呤代谢。此外,与T2DM组相比,红枣多糖+T2DM、苍术多糖+T2DM、乌梅多糖+T2DM组下调了苯丙氨酸代谢。黄芪+T2DM组下调了丙氨酸、天冬氨酸和谷氨酸代谢、氨基糖和核苷酸糖代谢等代谢通路。红枣+T2DM组下调了丙氨酸、天冬氨酸和谷氨酸代谢、磷酸转移酶系统等代谢通路。氨基酸代谢与糖尿病风险相关[22]。多糖可能通过影响肠道菌群的氨基酸代谢途径,进一步对宿主发挥作用。

图7 KEGG功能丰度统计Fig.7 KEGG functional abundance statistics
2.5 多组学联合分析
应用多组学联合分析,对NC、T2DM和加糖实验组的肠道菌群与气体成分、SCFA和差异性代谢物绘制热图(图8)。玄参多糖组中甘氨酸与Ruminococcus呈正相关;戊酸与Romboutsia、Clostridium_sensu_stricto_1、Oscillospiraceae_UCG-002呈正相关;异丁酸与Alistipes呈正相关;异戊酸与Phascolarctobacterium、Eggerthella、Escherichia-Shigella、Negativibacillus呈正相关;5-氨基戊酸与Phascolarctobacterium、Bilophila呈正相关;尸胺与Dorea呈正相关;H2与Collinsella呈负相关,与Subdoligranulum、Klebsiella呈正相关;H2S与Dorea、Escherichia-Shigella、Enterococcus正相关,与Bifidobacterium呈负相关;丙酸与Desulfovibrio呈正相关。



图8 相关性热图分析Fig.8 Correlation heatmap
黄芪多糖组中甘氨酸与Lactobacillus、Bifidobacterium呈正相关,与E.coli、Escherichia-Shigella呈负相关;乳酸与Phascolarctobacterium呈负相关;丙氨酸与Desulfovibrionaceae呈负相关;异丁酸与Oscillospiraceae_UCG-002呈正相关;5-氨基戊酸与Lactobacillales、Megasphaera呈正相关;戊酸与Clostridium_sensu_stricto_1、Oscillospiraceae_UCG-002、Romboutsia、Megasphaera、unclassified_o__Lactobacillales、Oscillospiraceae_UCG-002呈正相关;丁酸与unclassified_o__Lactobacillales、Megasphaera、Oscillospiraceae_UCG-002呈正相关;L-脯氨酸与Veillonella呈正相关;尸胺与Eggerthella、Escherichia-Shigella、Dorea呈正相关;H2与Subdoligranulum呈正相关,与Lactobacillus呈负相关;H2S与Lactobacillus呈负相关,与Escherichia-Shigella呈正相关。
苍术多糖组中乳酸与Lachnospiraceae呈负相关;丙酸与Monoglobus呈负相关;H2与Lactobacillus呈负相关,与Subdoligranulum、Klebsiella呈正相关;H2S与Subdoligranulum呈正相关;戊酸与Oscillospiraceae_UCG-005、Oscillospiraceae_UCG-002呈正相关;异丁酸与Oscillospiraceae_UCG-002、Bilophila呈正相关,异戊酸与Dorea、Escherichia-Shigella、Phascolarctobacterium、Bilophila、unclassified_f__Desulfovibrionaceae呈正相关;5-氨基戊酸与Phascolarctobacterium、Bilophila、unclassified_f__Desulfovibrionaceae呈正相关;L-酪氨酸与Megamonas呈负相关;木糖醇与Escherichia-Shigella、Parabacteroides呈正相关;尸胺与Dorea、Eggerthella呈正相关;DL-苯丙氨酸与Streptococcus、Veillonella呈正相关;缬氨酸与Intestinibacter呈正相关;异亮氨酸与Eubacterium_hallii_group、Intestinibacter、Ruminococcus呈正相关;甘氨酸与Monoglobus、Intestinibacter呈正相关;D-焦谷氨酸与Streptococcus呈正相关;鸟氨酸与Rombutzia、Oscillospiraceae_UCG-002呈负相关。
乌梅多糖组中甘氨酸与Anaerostipes、Lactobacillus、Ruminococcus呈正相关;谷氨酸与Bilophila呈负相关,与Lachnospiraceae_ND3007_group呈正相关;H2S与Enterococcus、Escherichia-Shigella、Parabacteroides呈正相关,与Anaerostipes、Lactobacillus、Blautia、Lachnospira、Faecalibacterium、Lachnoclostridium、Lachnospiraceae_UCG-001 呈负相关;丙酸与Agathobacter、Lachnospiraceae_UCG-001呈负相关;L-脯氨酸与Enterococcus、Escherichia-Shigella呈正相关,与Agathobacter、Faecalibacterium、Roseburia、Lachnoclostridium、Lachnospiraceae_UCG-001呈负相关;尸胺与Escherichia-Shigella呈正相关,与Lachnospiraceae_UCG-001呈负相关;异丁酸与Bilophila呈正相关;乙酸与Parabacteroides呈正相关,与Lachnospiraceae_UCG-001呈负相关;异戊酸与Bilophila、Phascolarctobacterium呈正相关;5-氨基戊酸与Bilophila、Phascolarctobacterium呈正相关;H2与Anaerostipes、Lachnospira呈负相关;缬氨酸与Lachnospiraceae呈负相关;苯丙氨酸与Lachnospiraceae、Sutterella呈负相关;焦谷氨酸与Lachnospira、Faecalibacterium、Roseburia、norank_f__Ruminococcaceae呈负相关,与Bifidobacterium呈正相关;L-酪氨酸与Parabacteroides呈正相关,与Faecalibacterium呈负相关;戊酸与Oscillospiraceae_UCG-002呈正相关;异亮氨酸与Sutterella呈负相关。
红枣多糖组中H2S与Dorea、Escherichia-Shigella呈正相关;戊酸与Romboutsia、Ruminococcus、Oscillospiraceae_UCG-002、Megasphaera、unclassified_o__Lactobacillales呈正相关;异丁酸与Oscillospiraceae_UCG-002呈正相关;异戊酸与Phascolarctobacterium、Bilophila呈正相关;尸胺与Dorea呈正相关;5-氨基戊酸与Desulfovibrionaceae、Phascolarctobacterium、Bilophila呈正相关;甘氨酸与Lactobacillus呈正相关;乳酸与Lachnospiraceae、Faecalibacterium、Lachnospira、Ruminococcus_torques_group呈负相关;谷氨酸与Sutterella呈负相关。
3 讨论
肠道菌群被称为“第二个人类基因组”,作为机体的一种内部环境因素,它能调节人体内的新陈代谢,起到多种作用[9]。正常生理状态下,这些微生物与人体共生,相互依赖且相互制约,保持动态平衡,以此维持人类身体健康。如果出现病理因素将这种平衡打破时,就会引起糖尿病等诸多疾病。多糖作为肠道菌群的碳源,能够促进有益菌群生长,同时多糖能够被肠道菌群碳水化合物活性酶分解后转化为次生代谢物或发酵产物被机体吸收,进而影响宿主细胞增殖和凋亡,调节免疫反应,改变宿主代谢[23]。肠道菌群对多糖的利用降解是多糖活性的基础,因此,以肠道菌群为媒介,探索多糖的作用机制是研究多糖功能的主要方向之一。
在本研究中,通过肠道菌群功能预测和代谢数据揭示了5 种植物多糖能够调节微生物组成,进一步影响产气情况、氨基酸代谢和SCFA代谢通路,与之前有关报道一致[24]。尽管许多研究分析了不同人群的肠道菌群与T2DM的关系[25],但糖尿病人和健康人肠道菌群差异方面的研究结果不一致。Larsen等[26]发现,T2DM患者中Firmicutes和梭菌类的比例显著降低;而巴基斯坦的一项基于60 人的数据显示,T2DM患者的Firmicutes、梭菌门和阴性菌门占主导地位[27]。同时有研究发现T2DM患者的Firmicutes和Actinobacteriota的相对丰度均有增加,而Bacteroidota相对丰度则有降低,条件致病菌和硫酸盐还原菌富集,双歧杆菌和拟杆菌等益生菌和丁酸盐产生菌减少[28]。Le等[29]发现,T2DM患者肠道内双歧杆菌数量明显低于健康人,而粪肠球菌数量高于健康人。另一方面,Doumatey等[30]报道T2DM患者的丰富度显著降低,β多样性指标的显著差异,而Ahmad[27]和Chavez-Carbajal[25]等观察到α多样性指数没有显著差异。在本研究中,α多样性分析T2DM患者菌群丰度与正常人相比无显著变化,5 种植物多糖干预T2DM患者菌群丰度也无显著差异;β多样性分析5 种植物多糖干预正常人和T2DM患者的菌群组成在一定程度上有所改变,同时提高了两组的Firmicutes丰度、降低了T2DM组Bacteroidota丰度,这些变化被认为与通过帮助宿主消化多糖或激活AMP激活的蛋白激酶加速能量吸收和体重增加有关[31]。黄芪多糖+T2DM组提高Faecalibacterium、Roseburia、Megamonas、Bifidobacterium、Bacteroides、Akkermansia丰度,降低Ruminococcus丰度。玄参多糖+T2DM组提高Faecalibacterium、Roseburia、Megamonas、Bacteroides丰度。红枣多糖+T2DM组提高Faecalibacterium、Roseburia、Megamonas、Bifidobacterium、Akkermansia的丰度,降低Ruminococcus丰度。乌梅多糖+T2DM组提高Faecalibacterium、Roseburia、Megamonas、Blautia菌的丰度。苍术+T2DM组提高Faecalibacterium、Roseburia、Megamonas、Bifidobacterium、Akkermansia的丰度。Bifidobacterium、Bacteroides、Faecalibacterium为肠道益生菌,Roseburia和Faecalibacterium是丁酸产生菌 。Roseburia可以改善葡萄糖耐受性[33]。Roseburia、Faecalibacterium、Akkermansia和Blautia与T2DM呈负相关,而Ruminococcu与T2DM呈正相关[9]。乳酸杆菌可能参与糖尿病发展中的慢性炎症,与葡萄糖、糖化血红蛋白呈显著正相关[28]。Akkermansia可能是一种潜在的治疗糖尿病的益生菌,由于其在黏蛋白降解过程中的特殊表现,已成为肠道与宿主细胞之间的黏膜界面上的关键生物,与炎症性肠病、肥胖、结肠炎、T2DM和其他代谢紊乱有关[21]。
肠道菌群能够通过代谢产生CO2、H2、CH4、H2S等气体介质对宿主健康产生影响。CO2和H2是微生物发酵碳水化合物过程中产生的主要气体,CH4则是由大肠中古生菌代谢CO2和H2产生。H2S和含硫微量气体是还原硫酸盐和亚硫酸盐的硫还原细菌发酵蛋白质产生的[34]。肠道细菌代谢产生气体的同时也会消耗气体,H2主要被产甲烷菌、产乙酸菌和硫酸盐还原菌所利用;H2和CO2被产乙酸细菌利用产生乙酸,还能够被产甲烷菌利用产生CH4。H2是碳水化合物发酵的主要气体标记物,用于诊断碳水化合物吸收不良或小肠细菌过度生长,H2S也是蛋白质发酵的一个潜在有用的生物标志物。H2S可以直接通过中枢神经调节肠道蠕动。一般认为,肠道微生物群产生的H2很容易通过饮食调节,CH4的生成则更强烈地依赖于微生物群组成[17]。相比较于NC组,T2DM患者肠道菌群产气体积减低,添加黄芪、苍术、玄参、红枣多糖能够提高肠道菌群的产气含量。乌梅多糖能够降低各组的H2S产量,研究表明利用膳食纤维干预肠道菌群降解H2S有助于调节宿主糖代谢、改善T2DM 。
肠道菌群的改变可以调节SCFA和氨基酸的含量,改善肠道内环境,预防和治疗糖尿病[36]。乙酸、丙酸和丁酸是肠道菌群利用碳水化合物发酵产生的主要代谢产物,是肠上皮细胞的重要能量来源,而属于支链SCFA的异丁酸和异戊酸主要由分支氨基酸和到达结肠时未被消化的蛋白质被肠道微生物发酵利用所产生[37]。乙酸和丙酸主要由Bacteroidota产生,而大量的丁酸来自Firmicutes 。乙酸是含量最多的SCFA,作为能量来源参与机体代谢,它能到达外周组织,尤其是脂肪和肌肉,用于胆固醇代谢和脂肪合成,影响人体食欲。肠道微生物产生的丁酸可以改善机体的胰岛素反应,进一步促进免疫调节,具有抗炎和抗癌作用。丙酸能够调节胆固醇的合成,但是丙酸异常可能会增加T2DM的风险,但是丙酸与糖尿病风险之间的因果关系仍需要进一步的研究[33]。拟杆菌属和双歧杆菌属能够产生乙酸和丁酸,乙酸和丁酸与对应的受体结合,并诱导下游的胰高血糖素样肽-1、胰高血糖素样肽-2、酪酪肽的分泌,通过对胰腺功能以及胰岛素释放的影响,最终发挥降低血糖的作用[39]。此外,本研究数据也与之前的研究相符合,SCFA与产气之间可能存在某种平衡[17]。5 种多糖发酵导致较多还原性丁酸的产生,也导致较多的还原剂H2的产生,增加了总体产气量。多糖体外发酵影响T2DM患者肠道菌群氨基酸通路,丙氨酸、精氨酸、异亮氨酸、脯氨酸、酪氨酸、缬氨酸和己糖水平与T2DM风险正相关,并且T2DM可能会改变患者体内的酪氨酸和丁酸水平,调节酪氨酸代谢和丁酸的产生可能是改善T2DM预防的一种潜在方法[40]。苯丙氨酸代谢与胰岛素抵抗有关,可能增加T2DM的风险[41]。在T2DM患者中,肠道菌群细胞膜对糖和支链氨基酸的转运更为活跃,但丁酸的合成减少,与促炎反应直接相关的氧化应激反应激增。植物多糖可以通过纠正肠道菌群失调恢复肠道微生物生态、促进产SCFA微生物的富集、提高SCFA水平 。黄芪多糖、苍术多糖和玄参多糖提高了T2DM组的乙酸、丁酸、丙酸水平。
4 结论
基于T2DM患者肠道菌群和植物多糖体外发酵模型,分析5 种植物多糖对微生物群落结构及其代谢图谱的影响。本研究结果可以筛选得到更具有糖尿病功能食品潜力的植物多糖。在气体成分方面,黄芪多糖、苍术多糖、玄参多糖和红枣多糖均能够提高T2DM组的总气体介质含量以及CO2和CH4含量,降低H2S含量,而乌梅多糖降低了总气体介质;在SCFA方面,黄芪多糖、苍术多糖、玄参多糖调节T2DM组总酸的含量更为显著;在代谢物质方面,5 种多糖均能够上调氨基酸等有益代谢物质;在肠道菌群方面,5 种多糖均能够调节肠道菌群结构,增加有益菌的丰度。综合结果来看,苍术多糖、玄参多糖和黄芪多糖更具有发展为糖尿病功能食品的可能性。参照最新的药食同源名录,发现黄芪在特定的范围和剂量内可作为药食两用,苍术和玄参也均在可用于保健食品的中药名单中,因此这3 种植物多糖在功能性食品开发方面具有广阔前景,但是否能够真正开发为功能食品,还需进一步进行动物实验及临床实验。本研究为植物多糖对慢性代谢类疾病产品的开发和利用提供了理论基础。

