浓香型大曲微生物菌群演替与吡嗪类物质合成的关系
陈莹琪,陈 杰,周耀进,李子健,唐世超,赵玉川,罗惠波,黄 丹,
(1.四川轻化工大学 酿酒生物技术及应用重点实验室,四川 自贡 643000;2.宜宾六尺巷酒业有限公司,四川 宜宾 644100)
浓香型大曲在发酵过程中微生物、微生物和代谢产物之间呈一种动态、有规律的演变过程[1],并通过微生物代谢产生多种代谢产物和风味物质[2-3],研究表明吡嗪类物质是促进白酒特定风味形成的决定性风味物质之一[4-5]。其中2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪有助于浓香型白酒的呈香[6-7],并具有扩张血管、改善血循环、护肝等功能[8]。虽然已从大曲中鉴定出多种吡嗪类化合物[9-10],但关于吡嗪类物质与浓香型大曲发酵过程中微生物群落的相关性仍不清楚,对大曲发酵过程中吡嗪类物质的合成机制尚不完全清楚。现有研究表明,大曲发酵过程中2,3,5,6-四甲基吡嗪[11-12]、2,5-二甲基吡嗪[13]、2-乙基-3,5/3,6-二甲基吡嗪14]的代谢产生由微生物完成。Jin Yao等[15]采用Illumina MiSeq和顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术研究了酱香型大曲中微生物群落和挥发性风味物质特征,发现酱香型大曲中的杆菌纲、放线菌纲等与吡嗪类物质密切相关,曲霉菌与吡嗪类物质呈负相关。Ren Qing等[16]研究了中国米酒中微生物与风味物质之间的相关性,表明吡嗪类化合物与曲霉菌、枝孢霉属、乳球菌属、毕赤酵母属等微生物之间总共建立了88 种相关性。但是目前极少有研究解析这些吡嗪类物质相关微生物与制曲过程中其他微生物的相关性。因此,解析大曲发酵过程中吡嗪类物质相关微生物,以及吡嗪类物质相关微生物与大曲发酵过程中其他微生物的相互作用模式,对于揭示大曲发酵过程中微生物合成吡嗪类物质的机制、调控大曲发酵过程中吡嗪类物质合成具有重要意义。
本研究利用高通量测序技术全面系统地解析浓香型大曲发酵过程微生物群落结构的变化,并通过HS-SPMEGC-MS测定大曲发酵过程中吡嗪类物质的种类、含量,解析制曲过程中吡嗪类物质合成的阶段性特征,以及吡嗪类物质与大曲微生物的相关性,揭示吡嗪类物质相关微生物与大曲发酵过程中其他微生物的共生网络,旨在为解析大曲发酵过程中的吡嗪类物质的合成机制提供参考。
1 材料与方法
1.1 材料与试剂
大曲取自宜宾某浓香型白酒厂。
E.Z.N.A.®Soil DNA Kit 美国Omega BioTek公司;2-辛醇(内标,色谱纯) 美国Sigma公司;其他试剂均为国产色谱纯或分析纯。
1.2 仪器与设备
Nano Drop 2000紫外-可见分光光度计 美国Thermo Scientific公司;DVB/CAR/PDMS固相微萃取头(2 cm,50/30 μm) 美国Supelco公司;7890 BGC-5977 AMS GC-MS联用仪、Db-5 ms色谱柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 样品采集
对发酵过程中1、3、5、7、9、11、13、15、18、22 d和28 d的大曲样品进行收集,每次从曲房的上层、中层、下层3 个不同的位点取3 个平行样品,总计33 个样品。取样后,将大曲粉碎均匀,每份取约200 g密封在无菌袋中,-80 ℃保藏。
1.3.2 吡嗪类物质的测定
1.3.2.1 萃取头的预处理
将新购置的萃取头在GC仪进样口250 ℃老化1 h。
1.3.2.2 样品HS-SPME
准确称取1 g大曲样,加入到20 mL的顶空瓶中,再加入2 g NaCl和50 μL内标(10 mg/L 2-辛醇溶液),使用50/30 μm DVB/CAR/PDMS萃取头在50 ℃预热10 min,然后磁力搅拌萃取吸附30 min,用于GC-MS分析。
1.3.2.3 GC-MS分析
将萃取头从顶空瓶中取出,迅速插入GC仪进样口在250 ℃解吸5 min,进行GC-MS检测分析[17]。
GC条件:Db-5 ms色谱柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气(纯度>99.999%),不分流,体积流量1 mL/min;进样口温度250 ℃;升温程序:起始温度40 ℃,保持5 min,以5 ℃/min速率升温至120 ℃,然后以10 ℃/min升温至240 ℃,保持5 min。后运行温度240 ℃,后运行时间5 min。
MS条件:接口温度280 ℃;连接杆温度150 ℃;电子电离源,电子能量70 eV,离子源温度230 ℃,质量扫描范围m/z35~450;ACQ方式Scan。
1.3.3 DNA提取和聚合酶链式反应(polymerase chain reaction,PCR)扩增基因组学高通量测序
称取2 g大曲样品,使用E.Z.N.A.®Soil DNA Kit 试剂盒从提取大曲中微生物DNA。使用引物338f/806r(5’-ACTCCTACGGGAGGCAGCAGAG-3’/5’-GGACTACHVGGTWTCTAAT-3’)和ITS1f/2043R(5’-CTTGGTCATTAGGAAGA-3’/5’-GCTGCGTTCTTCATC GATGC-3’)扩增细菌16S rRNA基因的V3~V4区和真菌rRNA基因的内部转录间隔(ITS1)区域[18-19]。
1.4 原始序列数据处理
使用基础分析软件Qiime 1.9.1版本处理原始数据,主要是进行序列拼接,序列归类,去除序列中接头、标签及引物序列,去除低质量序列[20]。然后用Uchime软件去除嵌合体序列[21]。使用Uparse分析软件进行可操作分类单元(operational taxonomic unit,OTU)聚合[22]。使用RDP Classifier 2.11进行序列分类注释。Usearch 7.0进行OTU统计。Mothur 1.30.2进行α多样性分析。使用Qiime 1.9.1可以生成各分类学水平丰度表和β多样性距离计算。在P<0.05时接受统计学意义差异。使用R语言stats包3.5.0在微生物属和吡嗪类物质中计算出Spearman相关系数(r>0.6)以检测微生物群与吡嗪类物质之间的关联,使用Cytoscape 3.4.0可视化相关矩阵。
2 结果与分析
2.1 浓香型大曲发酵过程中吡嗪类物质的变化
在大曲发酵过程中,通过HS-SPME-GC-MS共检测到9 种吡嗪类物质,含量如图1a所示。在检测到的9 种吡嗪类物质中,具有主要贡献作用的是2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪和2,6-二甲基吡嗪,这与韩素娜等[23]的研究类似。在大曲发酵1~5 d时,吡嗪类物质总含量极低,随着发酵的进行,吡嗪类物质总含量存在2 个快速增长阶段:7~9、18~22 d,分别增加到3.8、2.1 倍。其中2,3,5,6-四甲基吡嗪在发酵7~9 d增加到3.6 倍,2,3,5-三甲基吡嗪在发酵7~9 d增加到3.7 倍。在18 d,吡嗪类物质含量大幅降低,这可能是因为在15~18 d时大曲发酵温度相对较高,吡嗪类物质具有挥发性而造成了散逸;再有就是微生物将其作为底物而被转化[6,24]。与大曲发酵前相比,大曲发酵结束后2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪、2,5-二甲基吡嗪、2-甲基吡嗪、2,3-二甲基吡嗪等吡嗪类物质含量均明显增加。

图1 大曲发酵过程中吡嗪类物质含量变化(a)和Heatmap图(b)Fig.1 Changes in contents of pyrazine metabolites during fermentation of Daqu (a),and their heatmap (b)
风味Heatmap图可以直观地反映大曲发酵过程中9 种吡嗪类物质的变化和差异(图1b)。对大曲发酵过程中吡嗪类物质进行聚类分析,发现可以分为两个阶段:1~5、7~28 d。其中,在1~5 d阶段,3~5 d的吡嗪类物质可以聚为一个小类;在7~28 d阶段,7~9、13~15、22~28 d的吡嗪类物质可以分别聚为一个小类,并且7~15 d和18~28 d又可以单独聚为一类。说明在7~28 d阶段,吡嗪类物质组成和含量相对较为相似,与1~5 d阶段相比有一定差异。这可能是因为在制曲过程中,发酵不同阶段大曲微生物菌群结构不同,大曲微生物所处的发酵温度有差异[6,25],从而影响了吡嗪类物质的合成和积累,因此产生的吡嗪类物质的含量与数量较1~5 d阶段多。
2.2 浓香型大曲发酵过程中优势微生物的群落演替
大曲发酵过程中优势真菌属(平均相对丰度>1%)的变化情况如图2a所示。大曲发酵过程中各阶段的优势真菌差异较大。在大曲发酵1~5 d时,优势真菌群落主要是奥默柯达属(Kodamaea)、伊萨酵母属(Issatchenkia)、念珠菌属(Candida)、曲霉属(Aspergillus)等,相对丰度分别为76.04%~31.20%、41.84%~9.83%、34.34%~4.03%、7.64%~1.77%。此外,双足囊菌属(Dipodascus)、地丝菌属(Geotrichum)等也占据一定比例,这些微生物也是大曲发酵前期的优势微生物。随着发酵进程的推移,以嗜热子囊菌属(Thermoascus)、嗜热丝孢菌属(Thermomyces)为代表的嗜热真菌属逐渐占据微生物群落丰度的优势地位。大曲发酵7~13 d,嗜热子囊菌属、伊萨酵母属、假丝酵母属(Candida)等为优势真菌属,嗜热子囊菌属占优势地位,在发酵中期11 d,嗜热子囊菌属在群落中的占比高达98.25%;在发酵的后期15~28 d,嗜热子囊菌属、嗜热丝孢菌属占有绝对优势,可以占群落相对丰度的99%以上。
大曲发酵过程中优势细菌属(平均相对丰度>1%)的变化情况如图2b所示。在大曲发酵的整个阶段芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)相对丰度均占据优势地位。在1~5 d阶段,芽孢杆菌属在细菌中的占比逐渐升高,相对丰度从30.96%升为49.25%;而魏斯氏菌属在细菌中的占比逐渐降低,相对丰度从43.11%降至15.51%。大曲发酵5 d后,芽孢杆菌属的丰度呈波动上升后稳定的趋势,且在细菌中占有绝对优势;而魏斯氏菌属则呈波动下降后稳定的趋势。在大曲发酵前期,乳酸杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、小球菌属(Pediococcus)也属于优势物种,乳酸杆菌属相对丰度为13.02%~6.16%,假单胞菌属为15.54%~2.84%、小球菌属为7.78%~1.45%。此外,在大曲发酵前期葡萄球菌属(Staphylococcus)、泛生菌属(Pantoea)、考萨考氏菌属(Kosakonia)、醋酸杆菌属(Acetobacter)等也占有一定比例,均为大曲发酵前期的优势细菌。与真菌不同的是,细菌发酵中后期存在多种优势细菌,如高温放线菌属则在大曲发酵后期占优势;在大曲发酵5 d后含量逐渐上升,后期呈波动下降趋势,在9 d达到最高20.78%,之后阶段在17.86%~9.96%之间波动,此外糖多孢菌属(Saccharopolyspora)、不动杆菌属(Acinetobacter)也占据一定的比例,这些微生物为大曲发酵后期的优势细菌。

图2 大曲发酵过程中优势真菌(a)和细菌(b)在属水平的相对丰度图Fig.2 Relative abundance of dominant fungi (a) and bacteria (b) at the genus level during Daqu fermentation
2.3 浓香型大曲发酵过程中微生物群落的组成比较
为了解大曲发酵过程中的微生物群落结构变化,基于ANOSIM指数对大曲发酵过程中的各个阶段进行主成分分析(principal component analysis,PCA)[26],比较大曲不同发酵阶段微生物群落结构的差异和距离。如图3所示,PCA表明,制曲过程微生物群落演替可分为两个阶段:第1阶段为大曲发酵的1~5 d(A阶段)、第2阶段为大曲发酵的7~28 d(B阶段),将大曲发酵过程分为两个阶段对其微生物群落结构和它们与吡嗪类物质相关性进行研究。
真菌群落在A阶段和B阶段距离较远(图3a),说明在发酵A阶段和发酵B阶段的真菌群落结构差异较大,这与大曲微生物群落组成和吡嗪类物质分析一致;B阶段中的点比A阶段分布更广,表明真菌群落在发酵B阶段变化可能高于发酵A阶段。与真菌群落不同的是,细菌群落在A阶段和B阶段出现了大部分的重叠(图3b),说明它们之间的差异并不明显。

图3 大曲发酵过程真菌(a)和细菌(b)的PCAFig.3 PCA plots of fungal (a) and bacterial community compositions (b)during Daqu fermentation
为进一步了解大曲发酵过程中微生物群落结构,通过线性判别分析Effect Size(linear discriminant analysis effect size,LEfSe)比较每个阶段主要差异微生物,以识别出差异丰富的特征,这些特征也与生物学上有类别一致的意义[27]。LEfSe多重分析表明(图4),有显著差异的真菌属共有38 种(线性判别分析(linear discriminant analysis,LDA)值>2,P<0.05)(图4a),包括A阶段奥默柯达属(Kodamaea)、念珠菌属(Candida)、伊萨酵母属(Issatchenkia)等33 个真菌属;B阶段由嗜热子囊菌属(Thermoascus)、嗜热丝孢菌属(Thermomyces)、链格孢属(Alternaria)等5 个真菌类群表现出明显的属间差异。
与真菌不同的是,细菌有显著差异的属共有36 种(LDA>2,P<0.05)(图4b),且差异细菌属大多在B阶段。在A阶段的差异细菌属共12 种,包括考萨考氏菌属(Kosakonia)、泛菌属(Pantoea)、嗜甲基菌属(Methylophilus)等;在B阶段,共有24 种差异细菌属,包括高温放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)、不动杆菌(Acinetobacter)等。

图4 大曲发酵过程真菌(a)和细菌(b)属的LEfeSeFig.4 LEfeSe analysis of fungal (a) and bacterial (b) genera during Daqu fermentation
2.4 浓香型大曲发酵过程微生物群落与吡嗪类物质的相关性分析
2.4.1 差异微生物与吡嗪类物质的相关性Heatmap和共生网络图分析
选取大曲发酵过程中差异微生物(属)与吡嗪类物质进行相关性分析,将相关性系数作Heatmap图。由图5a可知,2-乙烯基-6-甲基吡嗪、2-乙基-6-甲基吡嗪、2,3-二甲基吡嗪、2,6-二甲基吡嗪、2,3,5,6-四甲基吡嗪与多种差异真菌(属)都呈正相关;而2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2-乙基-3,5,6-三甲基吡嗪、2-甲基吡嗪则与多种差异真菌(属)呈负相关。与吡嗪类物质具有相关性的38 种差异真菌(属)中(Spearman相关系数|ρ|>0.6),仅13 种真菌表现出与吡嗪类物质具有显著相关性(P<0.005),如图5c所示,2-乙烯基-6-甲基吡嗪与刺孢壳属(Chaetomella)呈非常显著正相关,2,5-二甲基吡嗪仅与刺孢壳属呈正相关;2,6-二甲基吡嗪和2,3,5,6-四甲基吡嗪则仅与枝孢霉属(Cladosporium)呈正相关;2,3-二甲基吡嗪则与多数真菌(枝孢霉属、横梗霉属(Lichtheimia)、小尖霉属(Microtrichum)等)呈显著正相关;2-乙基-6-甲基吡嗪与刺孢壳属、横梗霉属等呈显著正相关。然而,2-乙基-6-甲基吡嗪与嗜热丝孢菌属呈显著负相关,2-乙基-3,5,6-三甲基吡嗪与刺孢壳属、镰刀菌属(Fusarium)呈显著负相关。
由图5b可知,2-乙烯基-6-甲基吡嗪、2,6-二甲基吡嗪、2-乙基-6-甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、2-甲基吡嗪、2,5-二甲基吡嗪等与多数的差异细菌(属)呈负相关,2-乙基-3,5,6-三甲基吡嗪则表现出和大部分差异细菌(属)呈正相关。共36 种细菌(属)表现出与吡嗪类物质之间的关联性(|ρ|>0.6),但仅有8 种细菌与吡嗪类物质具有显著相关性(P<0.005),如图5d所示,2,3,5-三甲基吡嗪与球形芽孢杆菌属(Lysinibacillus)、涅瓦菌属(Nevskia)、未分类肠杆菌属(unclassified_o_Enterobacterales)显著正相关,2-乙烯基-6-甲基吡嗪与Pelomonas呈非常显著正相关,2-甲基吡嗪与unclassified_f__Candidatus_Hepatincola呈正相关。除此之外,2-乙基-3,5,6-三甲基吡嗪与泛菌属具有显著负相关,2-乙基-6-甲基吡嗪与诺卡菌属、未分类乳杆菌属(unclassified_o_Lactobacillales)呈显著负相关,与泛菌属则表现出正相关。同时,2,6-二甲基吡嗪与诺卡菌属(Nocardia)、未分类乳杆菌属呈负相关。

图5 大曲差异真菌属(a、c)、细菌(b、d)属与吡嗪类物质的Spearman相关性Heatmap及可视化相关性网络图Fig.5 Spearman correlation heatmaps of differential fungal genera (a) and bacterial genera (b) versus pyrazine metabolites,and visual correlation network diagrams of differential fungal genera (c) and bacterial genera (d)versus pyrazine metabolites
2.4.2 浓香型大曲发酵过程微生物与吡嗪类物质相关微生物的相关性网络分析
利用Cytoscape软件基于Spearman系数构建浓香型大曲发酵过程微生物与吡嗪类物质相关微生物的相关性网络图(|ρ|>0.6,P<0.005)。可以发现大曲发酵过程中微生物群落成员与吡嗪类物质相关微生物之间的互利或竞争的相互作用模式,处于互利共生关系的微生物呈正相关[28],而处于竞争关系的微生物呈负相关[29]从而推断不同微生物群之间可能存在“合作”或“竞争”关系[30]。结果显示,真菌属相关性网络(图6a)由88 个节点、443 条边连接而成。节点间以正相关(89.84%)为主,只有少数是负相关(10.16%),枝孢霉属与13.93%的真菌属具有相关性,其中与大多数真菌属呈正相关,而仅与嗜热子囊菌属(Thermoascus)和未分类散囊菌目(unclassified_o_Eurotiales)两种真菌属呈负相关;除此之外,刺孢壳属(Chaetomella)、伊萨酵母属(Issatchenkia)、镰刀菌属(Fusarium)、毕赤醇母属(Pichia)分别与6.29%、8.31%、6.74%、5.62%的真菌属具有相关性,且与其中大多数的真菌呈正相关,与极少数的真菌呈负相关。相反的是,嗜热真菌属(Thermomyces)与7.86%的真菌属具有相关性,但却与大多数的真菌属呈负相关,表明嗜热真菌属与大多数属之间存在共排斥关系。值得注意的是,小尖霉属(Wallemia)仅与Wickerhamomyces这一种真菌属具有相关性,呈正相关。
细菌属相关性网络(图6b)由88 个节点、161 条边连接而成。节点间以正相关达67.70%。泛菌属(Pantoea)与20.49%的细菌属具有相关性,其中与大多数细菌属呈负相关,而仅与魏斯氏菌属(Weissella)、链球菌属(Streptococcus)呈正相关;与之相反的是,诺卡菌属(Nocardia)、unclassified_f__Candidatus_Hepatincola、赖氨酸芽孢杆菌属(Lysinibacillus)分别与19.87%、11.80%、10.56%的细菌属具有相关性,且与其中大多数的细菌呈正相关,与极少数细菌呈负相关。涅瓦河菌属(Nevskia)、Pelomonas分别与8.07%、4.35%的细菌属具有相关性,且表现为共合作关系。
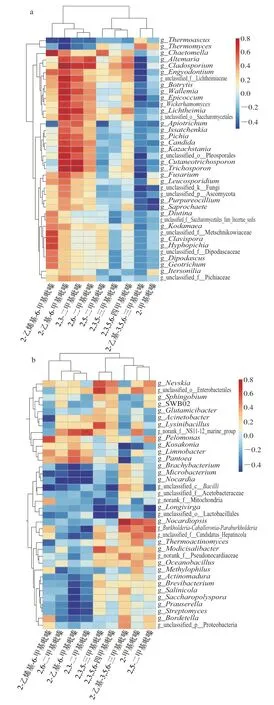

图6 大曲真菌属(a)、细菌(b)属与吡嗪类物质相关微生物的相关性网络图Fig.6 Correlation network maps of fungal (a) and bacterial genera (b)versus microorganisms related to pyrazine synthesis in Nongxiangxing Daqu
3 结论
利用HS-SPME-GC-MS测定浓香型大曲中吡嗪类物质的含量,总共检测到9 种吡嗪类物质,对吡嗪类物质进行聚类分析,发现在制曲过程中吡嗪类物质的积累存在阶段性特征,即在1~5 d和7~28 d阶段吡嗪类物质的数量和种类存在显著差异,这可能和制曲过程不同阶段微生物菌群演替有关。利用高通量测序鉴定大曲发酵过程中优势微生物群落组成,发现优势真菌群落主要由奥默柯达属、伊萨酵母属、假丝酵母属、曲霉属等组成;优势细菌群落主要由芽孢杆菌属、魏斯氏菌属、高温放线菌属等组成。通过PCA将大曲发酵过程分为A(1~5 d)、B(7~28 d)两个阶段;通过LEfSe分析筛选出两个发酵阶段的差异微生物,在A阶段主要的差异真菌为奥默柯达属、念珠菌属等,B阶段主要的差异真菌为嗜热子囊菌属、嗜热丝孢菌属;在A阶段主要的差异细菌为考萨考氏菌属、泛菌属、嗜甲基菌属;B阶段主要的差异细菌为高温放线菌属、糖多孢菌属、不动杆菌等。利用差异微生物(属)与吡嗪类物质进行相关性分析,得出了与吡嗪类物质相关性系数|ρ|>0.6、P<0.05的属,发现2,6-二甲基吡嗪、2,3,5,6-四甲基吡嗪都与枝孢霉属呈正相关,这与Ren Qing等[16]发现在中国米酒中吡嗪类物质的合成与枝孢霉属密切相关的结论一致。2,3-二甲基吡嗪与枝孢霉属、横梗霉属、小尖霉属、伊萨酵母属等多种真菌属呈显著正相关;2,3,5-三甲基吡嗪与球形芽孢杆菌属、涅瓦菌属、未分类肠杆菌属都具有显著正相关,这其中球形芽孢杆菌属、未分类肠杆菌属、未分类乳杆菌属属于杆菌纲,诺卡菌属属于放线菌纲,这与Yao Jin等[15]发现杆菌纲、放线菌纲与吡嗪类物质密切相关的结论一致。通过Spearman系数构建这些吡嗪类物质代谢相关微生物与制曲过程中其他微生物之间的网络图,发现吡嗪代谢相关微生物与制曲过程中其他大曲微生物多呈正相关。仅嗜热真菌属等少数微生物表现出负相关。不过吡嗪类物质相关微生物与大曲微生物组通过何种方式相互影响,有待后续研究阐明。本研究结果为找寻大曲发酵过程中的功能微生物,提升大曲发酵品质提供理论支持。

