SLE 伴颅内动脉瘤致右眼睑下垂一例
曹思曼 文军 宋广梅 崔艳杰 乔洁 周毅 朱丽花
SLE 是临床上常见的自身免疫性疾病,常见于育龄期女性,以血清中可以检测到多种自身抗体为特征[1]。SLE 常伴有肾脏、胃肠道等器官和血液系统、中枢系统等系统损伤。SLE 伴颅内动脉瘤较为少见,多为无症状性动脉瘤,常见于疾病控制欠佳的患者。本文报道一例初发SLE 的患者在治疗过程中出现颅内动脉瘤,并压迫右侧动眼神经引起右眼睑下垂,经规范的药物联合介入手术治疗后迅速改善,该患者动脉瘤的出现可能与SLE 相关,旨在为临床SLE 的诊治提供依据,现报告如下。
病例资料
一、病史及主诉
患者女,47 岁。因颜面浮肿20 余日,右眼睑下垂8 d 于2022 年1 月21 日入院。患者于2021年12 月27 日无明显诱因下出现颜面浮肿,就诊于当地医院,当时查血常规示血红蛋白86 g/L,白细胞3.14×109/L,血小板145×109/L,抗核抗体(ANA)滴度> 1∶500,抗双链DNA(dsDNA)抗 体(+), 补 体3(C3)0.31 g/L,C4 0.03 g/L,直接抗人球蛋白实验(+),尿微量蛋白(MTP)483.8 mg/24 h,2000 年 版SLE 疾 病 活 动 度 评 分(SLEDAI- 2000)12 分;诊断为“SLE,狼疮血液系统损害,狼疮肾炎”,2022 年1 月8 日接受甲泼尼龙40 mg/d 静脉滴注治疗,1 月10 日接受环磷酰胺0.6 g/d 治疗(累积剂量1.4 g),1 月13 日患者突发头痛、恶心,1 月15 日患者出现右侧眼睑下垂,右侧额部沉重感,无言语障碍、口角歪斜,无视物模糊、视力下降,无四肢乏力。完善头颅CT 未见异常,头颅MRI 提示“右侧顶叶小斑片状异常信号影,脱髓鞘?炎症病变? 动脉瘤可能性大”,进一步完善脑血管造影:提示右侧颈内动脉海绵窦段动脉瘤(14.43 mm×11.34 mm),朝内、朝下生长,瘤颈窄,为求进一步诊治,遂转至我院。患者此次发病以来,精神、食欲、睡眠差,大小便正常,体重无明显变化。患者的既往史、月经史、家族史均无异常。
二、体格检查
入院体格检查:体温36.3℃,脉搏67 次/分,呼 吸16 次/ 分, 血 压131/92 mmHg(1 mmHg =0.133 kPa)。患者神志清晰、查体合作,全身浅表淋巴结未触及肿大,全身无皮疹,无皮下结节,无溃疡及瘢痕,右侧眼睑见散在淤斑,双眼睑水肿、右眼睑下垂(图1A),结膜未见充血、水肿、出血点、滤泡,眼球无突出或凹陷,右眼球向右外下斜视,双眼巩膜无黄染,右眼瞳孔直径约5 mm,直接、间接对光反射迟钝,左眼瞳孔直径约3 mm,直接、间接对光反射灵敏。双肺呼吸音清,未闻及干、湿性啰音及胸膜摩擦音。心律整齐,心音正常,心脏各瓣膜听诊区未闻及杂音。肝、脾肋下未扪及,四肢关节无活动异常,肌力、肌张力正常,巴宾斯基征、戈登征、奥本海姆征、查多克征及霍夫曼征均阴性,双下肢无水肿。
三、实验室检查
血常规示血红蛋白84.6 g/L,红细胞4.01×109/L,白细胞7×109/L,中性粒细胞绝对值4.04×109/L,淋巴细胞1.28×109/L,血小板193.3×109/L。ESR 3 mm/h。血清肌酐52.1 μmol/L,白蛋白25.5 g/L(参考值范围35.0~52.0 g/L)。C3 469.6 mg/L(参考值范围800.0~1800.0 mg/L),C4 93.5 mg/L(参考值范围100.0~400.0 mg/L),IgG 7.0 g/L(参考值范围8.0~16.0 g/L),IgA 1.46 g/L,IgM 0.82 g/L,RF 8.01 IU/mL,抗人球蛋白试验(-);ANA(+)、滴度1∶320、均质型;抗dsDNA 抗体(+);抗干燥综合征A 抗体(SSA)(+)/ SSB(-),抗Ro-52 抗体(+),抗Sm 抗体(-);组蛋白(-);抗心磷脂IgA 抗体1.5 IU/mL,抗心磷脂IgM 抗体0.5 IU/mL,抗心磷脂IgG 抗体3.0 IU/mL,抗β2 糖蛋白抗体2.7 IU/mL,抗中性粒细胞抗体胞浆型(-),抗中性粒细胞抗体核周型(-);尿潜血试验(+),粪便潜血试验(-)。
四、诊治过程
根据欧洲抗风湿病联盟/美国风湿病学会2019年发布的SLE 分类标准,结合患者症状、体征、实验室检查结果,诊断为SLE、SLE 血液系统损伤、狼疮肾炎、神经精神性SLE。SLEDAI-2000 评分20 分,治疗方案为口服甲泼尼龙40 mg/d,口服硫酸羟氯喹200 mg 每日2 次,考虑患者在外院使用过环磷酰胺且累积剂量达1.4 g,因此仅予0.6 g环磷酰胺静脉滴注诱导缓解治疗,同时予兰索拉唑、阿法骨化醇、碳酸钙D3支持治疗。1 月22日晚患者开始出现头痛、呕吐及眼球向内、向上活动受限,予眼科会诊,完善光学相干断层成像(OCT)提示,双眼浆液性视网膜剥离,荧光素血管造影(FFA)提示右眼黄斑上方可见渗漏点。同时行头颅MRI 示右侧海绵窦区见一结节状异常信号灶(图2),呈现不均匀性血管流空影,最大直径达23 mm,考虑患者颅内动脉瘤较大且已经压迫动眼神经引起相应症状,随时有破裂风险,经疑难病例讨论后,在积极规范治疗SLE 的同时转神经外科进行手术治疗。
1 月28 日患者转入神经外科完善全脑血管造影,术中见右侧颈内动脉海绵窦段巨大动脉瘤(14.43 mm×11.34 mm)(图2),但瘤颈细小,载瘤动脉段欠平直,管径不均匀,瘤颈距眼动脉很近,离海绵窦段前曲也很近,选择行载瘤动脉段覆膜支架植入术(图3),患者于术后次日出院(图1B),围术期及出院后继续服用甲泼尼龙40 mg/d,硫酸羟氯喹200 mg 每日2 次治疗。最后诊断:①SLE、SLE 血液系统损伤、狼疮肾炎、神经精神性SLE;②右侧颈内动脉海绵窦段动脉瘤;③右侧动眼神经麻痹;④双眼浆液性视网膜脱离。

图2 一例SLE 伴颅内动脉瘤致右眼睑下垂患者的头颅MRI 结果
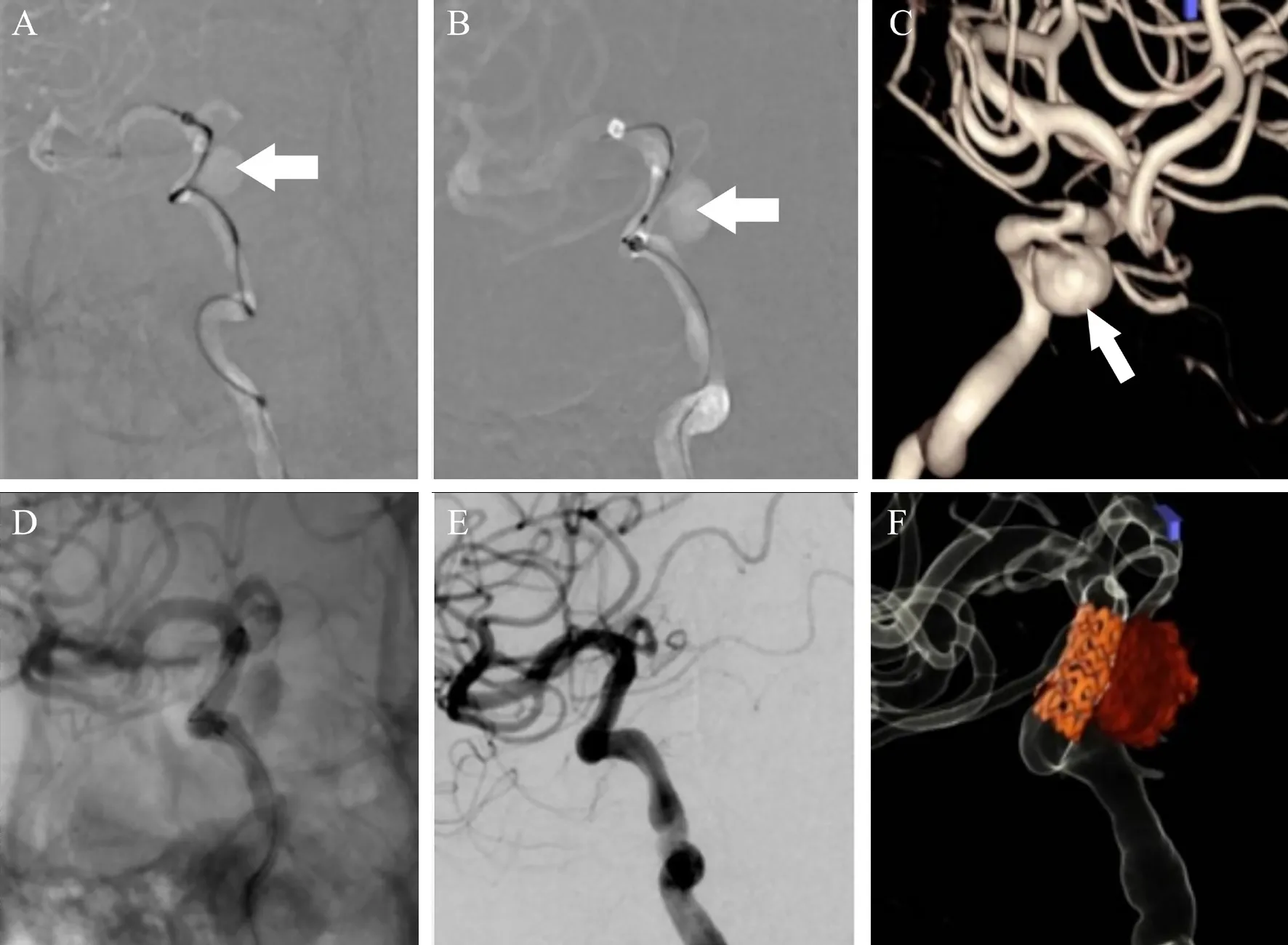
图3 一例SLE 伴颅内动脉瘤致右眼睑下垂患者的DSA 术中及支架植入术后结果
2 月17 日患者返院复查:眼球运动良好,右眼睑下垂较前明显恢复(图1C),双眼瞳孔对光反射灵敏。血常规示血红蛋白112 g/L,红细胞5.07×109/L,白细胞9.91×109/L,淋巴细胞2.52×109/L,血小板269×109/L。C3 835.55 mg/L,C4 183.29 mg/L,IgG 10.63 g/L,IgA 2.05 g/L,IgM 1.15 g/L。患者SLE 病情明显好转,右眼睑下垂明显好转。
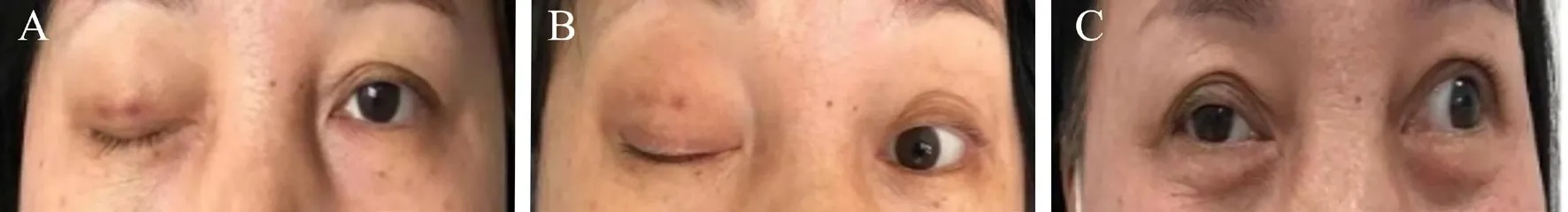
图1 一例SLE 伴颅内动脉瘤致右眼睑下垂患者的手术前后对比图
讨 论
SLE 是一种累及全身多个器官系统的自身免疫性疾病[2-3]。颅内动脉瘤是SLE 罕见的中枢神经系统并发症,据报道其发病率低于4%,患者多伴有高疾病活动性[4-5]。部分患者在颅内动脉瘤的形成过程中无任何症状,难以被发现。部分症状性颅内动脉瘤的常见表现有头晕、眼痛、眼睑下垂、视力障碍、复视和癫痫等,瘤体较大的动脉瘤还可引起头痛、恶心和呕吐等类颅内高压症状,此类患者动脉瘤的破裂风险大大增加。
SLE 患者因脑动脉瘤导致蛛网膜下腔出血(SAH)的发生率高于一般人群,动脉瘤大多起病隐匿,其形成机制尚未明确,可能与局灶性血管或动脉炎症使动脉管腔变窄,影响脑部血流状态,产生动脉粥样硬化样症状,导致缺血和血流动力学改变有关[6-10]。动脉瘤一旦破裂,其总病死率高达35%,且大多数患者无法恢复发病前的行为能力,甚至出现认知功能障碍[11]。研究表明,瘤体的位置、形状、≥5 mm 的动脉瘤以及蛛网膜下腔出血家族史是动脉瘤破裂的独立危险因素,这些结果有助于确定动脉瘤的治疗选择[12]。
颅内动脉瘤多发生在前交通动脉、大脑中动脉、颈内动脉和后交通动脉。颈内动脉海绵窦段动脉瘤(CCAA)仅占颅内动脉瘤的3%~5%,临床确诊时多为巨大动脉瘤,可导致颅神经压迫症状[13]。大多数CCAA 为良性病变,通常无症状,有症状的CCAA 患者常表现为眼部受累,如眼肌麻痹、复视、眼球运动障碍等,这类患者早期开展手术干预治疗十分必要[14]。本例患者诊断SLE前无任何动脉瘤形成的危险因素,如高血压、糖尿病、吸烟、饮酒、动脉瘤家族史等,在诊断SLE后、治疗过程中出现头晕、眼睑下垂及眼球运动障碍,血管造影提示CCAA,由此推测该段血管动脉瘤的形成可能因SLE 处于疾病活动期,炎症细胞浸润导致血管壁功能障碍,引起血流动力学改变,且症状与CCAA 压迫动眼神经有关。由于患者起病急,因瘤体较大产生压迫症状,需要快速诱导缓解并解除压迫,因此笔者选择在规范激素及环磷酰胺的药物治疗下联合手术干预,使患者症状得到迅速改善,出院后3 周复诊患者右眼可睁开,眼球运动恢复。我国SLE 伴颅内动脉瘤的病例罕见,笔者搜索国内外文献,查阅到3 例类似患者,马杰等(2004 年)和李劲松等(2001 年)认为,患者颅内动脉瘤形成甚至瘤体破裂可能与SLE 介导的血管壁炎症导致管壁薄弱有关;Zhang等[10]认为颅内动脉瘤的形成可能与SLE 所致的血管炎以及长期应用激素相关。
本例患者以SLE 诊断初期出现颅内动脉瘤并压迫右侧动眼神经引起右眼睑下垂为主要临床特点,结合患者既往体健及无类似家族史,认为颅内动脉瘤的发生可能与SLE 处于疾病活动期相关。因此在临床治疗过程中,无论对于初诊还是复发且处于疾病活动期的SLE 患者,当其出现头晕、头痛、呕吐或神经压迫症状时要警惕颅内动脉瘤的可能性;一经确诊,应在积极、规范的药物治疗基础上及时予手术干预,从而避免患者出现动脉瘤破裂或颈动脉海绵窦瘘等严重并发症。

