葛根素通过Wnt/β-catenin 信号通路对牙髓干细胞的增殖及成骨向分化的作用机制研究*
杨盼盼 马鹏涛 郑蕾
骨折、代谢性疾病、骨质疏松或肿瘤后的骨再生/修复一直为再生医学所面临的挑战,其中成人干细胞尤其是间充质干细胞(mesenchymalstemcells,MSCs)被认为 是骨再 生的良 好来源[1]。hDPSC通常可于第三磨牙中分离出来[2],具有分化为成骨、成软骨和神经细胞系等能力,具有较强的多向分化潜能、自我更新力、成骨活性及较低的免疫原性和伦理争议,有望成为治疗骨再生/修复的一种理想选择[3-5]。葛根素是一种从葛根中提取的异黄酮单体,因其具有抗氧化、抗癌、抗炎、促进骨形成等多种药理作用而受到医学界的广泛关注[6]。研究发现,葛根素可抑制破骨细胞形成,刺激骨形成,缓解骨质疏松症,诱导骨髓MSCs 向成骨细胞分化[7,8],且其机制可能与Wnt 信号通路有关[9],Wnt 通路激活与人骨髓MSCs 增殖和成骨分化关系密切[10,11],但葛根素是否可以影响其成骨向分化尚未见报道。故本试验拟在细胞水平上探讨葛根素对hDPSC 成骨向分化的影响及其作用发挥机制,旨在为葛根素药物开发提供一定的理论基础。
1.材料与方法
1.1 材料
1.1.1 实验材料 选择17名临床健康捐赠者(年龄平均值25.3岁,男性6名,女性11名)的第三磨牙20颗。捐赠者纳入标准:(1)年龄≥15岁;(2)拔除第三磨牙者或进行正畸治疗的正畸患者;(3)牙髓完整。排除标准:(1)牙髓牙周病患者;(2)恶性肿瘤患者。本研究经过医院医学伦理委员会批准(批号:ZZETYY20190517),实验材料提供者知情同意并签署知情同意书。
1.1.2 药品、主要试剂和仪器 葛根素(纯度≥98%)购自西安天丰生物科技股份有限公司;DMEM 培养液、胎牛血清均购自美国Gibco 公司;ALP检测试剂盒(上海碧云天生物技术有限公司);Wnt1、糖原合 成酶激 酶3β(glycogen synthase kinase3β,GSK-3β)、Cyclin D1、RUNX2、OCN 抗体购自美国Abcam 公司;β-catenin 抗体购自美国CST公司;磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase3β,p-GSK-3β)抗体购自上海圣克鲁斯生物技术有限公司;茜素红染色试剂盒(上海拜力生物科技有限公司);RM2016型石蜡切片机(上海徕卡仪器有限公司);JB-P5型组织包埋机(武汉俊杰电子有限公司)。
1.2 方法
1.2.1 hDPSCs 体外分离及培养 完全培养液配制:DMEM 培养基中添加1%青霉素-链霉素、10%胎牛血清;细胞分离及培养:第三磨牙使用PBS溶液洗涤2~3次,超净工作台内分离牙髓组织。37℃下,于Ⅰ型胶原酶和Ⅱ型分散酶混合液(1 mg/mL)中消化1 h,弃液离心收集细胞,使用完全培养液重悬细胞,恒温细胞培养箱中常规培养。观察细胞状态,细胞密度增长约80%,进行细胞传代。
1.2.2 细胞鉴定 取hDPSCs细胞接种于6孔板内(1×105个/mL),待细胞汇合至80%左右,弃去完全培养液,PBS洗涤2~3遍,并将细胞分为3组:空白对照组、成骨分化组、成脂分化组。分别使用完全培养液、DMEM+10 mM β-甘油磷酸钠+10 nM地塞米松+50 μg/mL抗坏血酸、完全培养液+1 μM地塞米松+10 μM胰岛素+0.5 μM IBMX+200 μM吲哚美辛进行干预。细胞成骨化鉴定主要步骤为:PBS清洗细胞,多聚甲醛固定后,2%茜素红溶液将细胞染色,约15 min后弃液清洗,观察细胞矿化结节的形成。细胞成脂化鉴定主要步骤为:PBS清洗细胞,多聚甲醛常规固定细胞,使用油红O染液染色,60%异丙醇漂洗,复染10 s后清洗细胞,观察细胞脂滴形成状况。
1.2.3 CCK8法检测葛根素对hDPSCs细胞增殖的影响 取对数生长期hDPSCs,细胞消化重悬,调整细胞密度为1×105个/mL接种于96板孔中。配制葛根素培养液(葛根素浓度分别为0、0.01、0.1、1、10 μmol/L),各组使用对应药物进行干预,设置5个复孔。培养结束后,加入CCK-8溶液10 μL,继续孵育3 h,酶标仪450 nm波长处检测OD值,制作标准曲线,检测各组细胞活性。实验重复3次。
1.2.4 ALP 活性检测 取对数生长期hDPSCs(1×105个/孔)接种于12孔板。分别设为阴性对照组、阳性对照组和实验组,阴性对照组为完全培养液,阳性对照组使用成骨分化培养液进行干预,实验组使用葛根素培养液(成骨分化培养液+1 μmol/L 葛根素)进行干预。培养7 d 后,各组1孔细胞PBS 洗涤,柠檬酸盐溶液固定30 s,后FRV碱性溶液、萘酚AS-BI 碱性溶液和亚硝酸钠溶液避光染色15 min。为计算ALP 活性,剩余孔细胞PBS 洗涤2次,后于2 mM 氯化镁和0.1% TritonX-100 的缓冲液(pH 值=7.6)裂解,收集细胞,离心收集上清。于96 孔板内加入缓冲液(含1%Triton X-100、2 mM 氯化镁和8 mM p-NPP)100 μL,后加上清液100 uL,37℃下孵育30 min,450 nm 处读取反应溶液中释放的对硝基苯酚的吸光度。BCA 法测定样品蛋白浓度,校正碱性磷酸酶活性。实验重复3次。
1.2.5 细胞矿化结节形成检测21 d后,PBS清洗各组细胞,多聚甲醛溶液固定,0.1%茜素红溶液(pH值=4.2)进行染色,观察各组细胞矿化结节形成情况。后每孔加入500 μL 10 mM磷酸钠和10%西吡氯铵洗脱液,摇床洗脱2 h,后移入各组洗脱液于96孔板内,每组各5孔,每孔各100 μL,570 nm处测定各孔吸光度值进行半定量。
1.2.6 免疫荧光染色检测β-catenin表达 细胞培养7 d弃液,多聚甲醛固定30 min,0.25% Triton X-100进行通透,加入山羊血清封闭。加入β-catenin一抗,4℃下孵育过夜。PBS洗涤3次,FITC标记的二抗避光孵育1 h,后DAPI染核5 min,洗涤后滴加抗荧光猝灭剂封片,于荧光倒置显微镜下观察β-catenin的表达和定位。
1.2.7 Western blot检测Wnt/β-catenin通路相关蛋白表达 各组细胞培养7 d后,收集细胞并加入预冷的RIPA裂解液裂解,提取细胞蛋白,检测各组蛋白浓度。样品(50 μg)于10% SDS-PAGE凝胶电泳(浓缩胶80 V 20 min,分离胶120 V 65 min),转膜(200 mA 2 h),TBST洗涤PVDF膜,37℃5%脱脂奶粉封闭2 h,Wnt1、β-catenin、GSK-3、CyclinD1、RUNX2、OCN一抗内4℃孵育过夜。加入稀释二抗室温孵育2 h,滴加ECL显影曝光。分析蛋白条带灰度值,以目的蛋白与GAPDH灰度值比值表示蛋白的相对表达量。
1.3 统计学分析 运用SPSS 23.0 统计学软件分析数据,计量数据以()表示,采用单因素方差分析(One-way ANOVA)进行多组间比较,LSD-t 检验进行两组间比较,P<0.05 为差异有统计学意义。
2.结果
2.1 hDPSCs 的鉴定 空白对照组细胞未经诱导培养液培养,进行成骨化及成脂化染色时,未见明显矿化结节及脂质堆积;成骨化诱导培养后,结果显示,细胞内可见大小不一的橙红色矿化结节(茜素红染色);成脂化诱导培养后,结果显示,细胞中可见明显细小脂泡堆积(油红O 染色)。见图1。
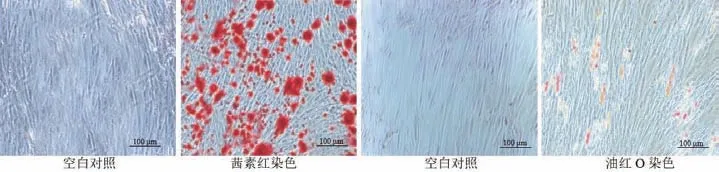
图1 hDPSC成骨化及成脂化鉴定(×200)
2.2 葛根素对hDPSCs增殖的影响 经含不同浓度葛根素的完全培养液培养hDPSCs 3 d后,CCK8检测结果显示,与不含葛根素组细胞比较,0.01 μmol/L、0.1 μmol/L、1 μmol/L、10 μmol/L葛根素作用下的细胞吸光度值均升高(P<0.05);与0.01 μmol/L 葛根素组细胞比较,0.1 μmol/L、1 μmol/L、10 μmol/L葛根素作用下的细胞吸光度值均显著升高(P<0.05);与0.1 μmol/L 葛根素组细胞比较,10 μmol/L葛根素作用下的细胞吸光度值略高,差异无统计学意义(P>0.05);与1 μmol/L葛根素组细胞比较,10 μmol/L葛根素作用下的细胞吸光度值降低(P<0.05)。见表1。
表1 不同浓度葛根素作用下细胞增殖情况(,n=5)
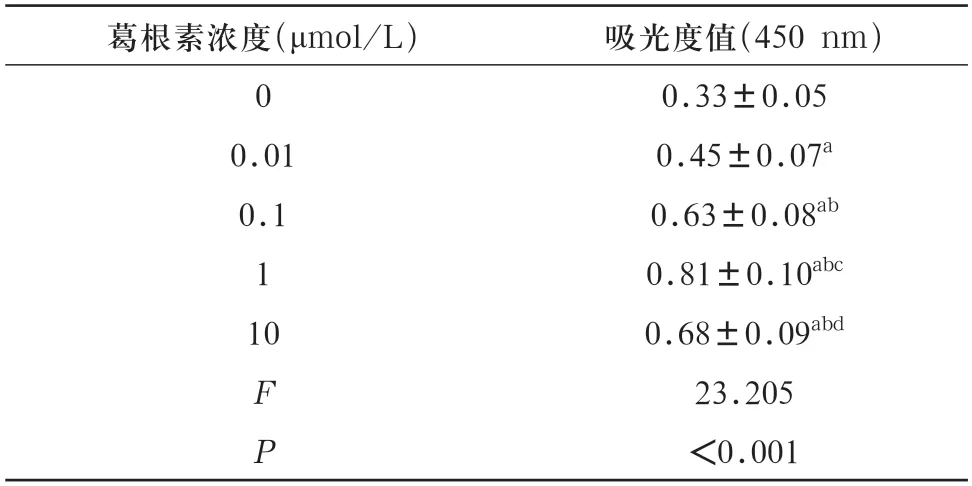
表1 不同浓度葛根素作用下细胞增殖情况(,n=5)
注:与不含葛根素组比,aP<0.05;与0.01 μmol/L葛根素组比,bP<0.05;与0.1 μmol/L葛根素组比,cP<0.05;与1 μmol/L葛根素组比较,dP<0.05
2.3 葛根素对hDPSCs 矿化沉积的影响 茜素红染色结果显示,与阴性对照组比较,阳性对照组及实验组细胞均见有橙红色矿化沉积,实验组具有较明显的矿化沉积。与阴性对照组比,阳性对照组和实验组矿化结节量显著升高(P<0.05);与阳性对照组比较,实验组矿化结节量显著较高(P<0.05)。见图2,表2。
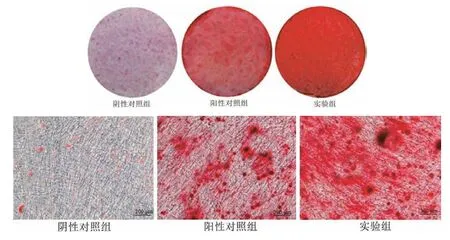
图2 茜素红染色结果(×100)
表2 各组细胞矿化结节定量分析(,n=3)

表2 各组细胞矿化结节定量分析(,n=3)
注:与阴性对照组比较,aP<0.05;与对照组比较,bP<0.05
2.4 葛根素对hDPSCs ALP 活性的影响ALP染色结果显示阴性对照组、阳性对照组及实验组细胞蓝染程度逐渐增强;量化结果显示,与阴性对照组比较,阳性对照组和实验组细胞ALP 活性升高(P<0.05),且实验组细胞ALP 活性最高(P<0.05)。见图3,表3。
表3 各组细胞ALP活性定量分析(,n=3)
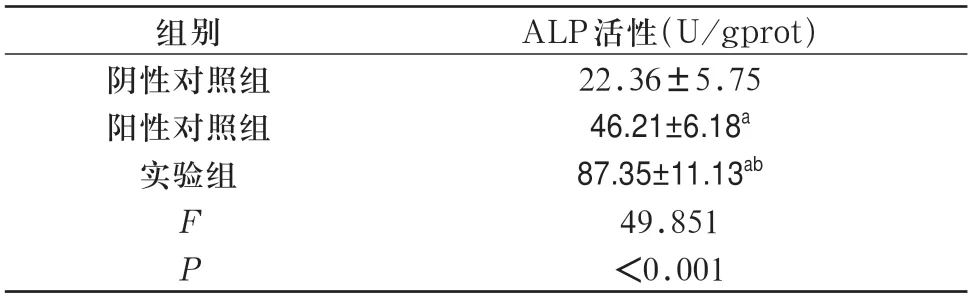
表3 各组细胞ALP活性定量分析(,n=3)
注:与阴性对照组比较,aP<0.05;与对照组比较,bP<0.05

图3 ALP染色结果(×100)
2.5 各组hDPSCs中β-catenin的表达定位 免疫荧光染色结果显示,阴性对照组中β-catenin 微弱表达于细胞的细胞质中,阳性对照组细胞中,β-catenin 明显表达于细胞质;实验组细胞内,β-catenin 具有于细胞质中强烈表达,并具有明显入核趋势。见图4。
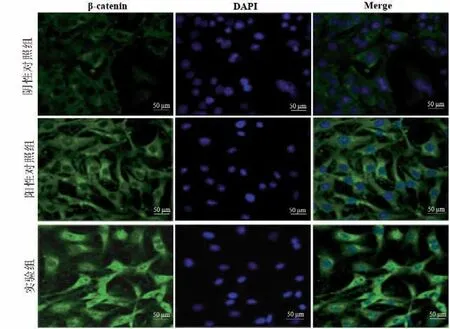
图4 β-catenin免疫荧光染色结果(×400)
2.6 Wnt/β-catenin通路相关蛋白的表达 Western blot结果显示,与阴性对照组比较,阳性对照组与葛根素(1 μmol/L)实验组hDPSCs 中Wnt1、β-catenin、CyclinD1、RUNX2、OCN蛋白表达水平显著升高(P<0.05),GSK-3β、p-GSK-3β蛋白表达水平降低(P<0.05);与阳性对照组比较,实验组hDPSCs中Wnt1、β-catenin、CyclinD1、RUNX2、OCN蛋白表达水平升高(P<0.05),p-GSK-3β蛋白表达水平降低(P<0.05)。见表4,图5。

图5 Wnt/β-catenin通路相关蛋白表达情况
表4 Wnt/β-catenin通路相关蛋白表达水平(,n=4)
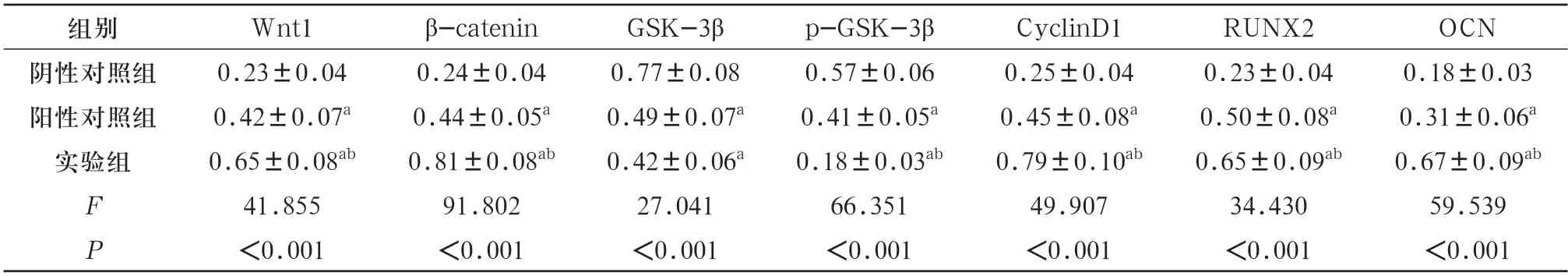
表4 Wnt/β-catenin通路相关蛋白表达水平(,n=4)
注:与阴性对照组比较,aP<0.05;与对照组比较,bP<0.05
3.讨论
DPSCs 一般情况下保持未分化的间充质细胞状态,当牙髓-牙本质复合体受到病理性损害时,其可迅速增殖、迁移、并分化为成牙本质细胞形成修复性牙本质隔离外界刺激并修复受损组织[12]。本实验利用组合酶消化法体外分离细胞,并通过成骨化及成脂化诱导鉴定,确认所获得细胞为具有分化功能的hDPSCs。CCK8结果显示,各作用浓度下,葛根素均可显著提高hDPSCs 活性,且最优作用浓度为1 μmol/L,提示葛根素在一定浓度范围内可呈浓度依赖性促进hDPSCs增殖。
ALP是一种广泛存在于哺乳动物中的磷酸酶,常被用作早期成骨分化的指标;茜素红与钙反应生成深红色,常被用作晚期成骨分化的指标[13]。Jiang X 等[14]发现,葛根素可促进骨细胞矿化结节沉积,提高骨细胞活力并促进细胞成骨向分化;Zhou Y 等[15]研究结果显示,葛根素可促进骨移植大鼠的骨髓干细胞分化和骨形成,并增加了骨量。本研究结果中,葛根素作用后,hDPSCs 增殖加快,ALP 活性升高,矿化结节沉积增加,提示葛根素的促DPSCs 增殖及促成骨向分化潜能。Wnt 可通过与细胞表面受体复合物结合,抑制GSK-3β 介导的β-catenin 磷酸化,启动β-catenin 细胞内积累,促使β-catenin 转入细胞核,β-catenin 与T 细胞因子/淋巴增强子结合以激活Wnt/β-catenin 转录因子,促进下游靶基因的表达[16],经典Wnt/β-catenin 信号级联的激活对骨形成和再生具有重要意义[17]。Wnt/β-catenin 信号通路激活主要依赖于细胞质β-catenin 向细胞核的转运,β-catenin核表达增加是该轴激活的重要标志[18,19]。Yao Y等[20]研究发现,葛根素可激活Wnt/β-catenin信号通路,提高β-catenin 和cyclin D1 的蛋白表达水平。本研究中显示,阴性对照组β-catenin 可微弱表达于细胞质中,而葛根素组细胞中β-catenin 可在细胞核内高度表达,提示葛根素可诱导hDPSCs中Wnt/β-catenin 通路激活,研究表明,该通路激活可促进MSCs 增殖及成骨向分化[21]。在没有细胞外Wnt 配体的情况下,β-catenin 被招募到一种降解复合物中,包括GSK-3β,正常细胞中β-catenin 含量很低,而当Wnt 配体存在时,GSK-3β 被磷酸化并产生无活性的p-GSK-3β,降解复合物被解聚,β-catenin 在细胞质中积累并移位至细胞核,激活下游靶基因[22],其中Cyclin D1在细胞增殖中发挥重要作用,Wnt/β-catenin 途径激活可上调细胞Cyclin D1 表达,从而诱导细胞增殖[23],RUNX2 为Wnt/β-catenin 途径转录因子,可促进OCN、ALP 等下游靶基因的表达进而促进成骨分化。本研究中,葛根素可显著促进Wnt1、β-catenin、Cyclin D1、RUNX2 及OCN 蛋白表达水平,显著抑制GSK-3β 及其磷酸化水平,表明葛根素可能通过Wnt/β-catenin 轴的激活刺激hDPSCs的增殖及成骨向分化。
综上所述,葛根素可在一定程度上促进hDPSCs 增殖,提高其成骨向分化能力,其机制可能与激活Wnt/β-catenin 轴,提高hDPSCs 中ALP 活性及矿化沉积并促进CyclinD1、RUNX2、OCN 表达有关。另本研究结果提示,葛根素对于hDPSCs的促增殖及促成骨向分化能力,对于骨再生/修复的作用具有一定的远景意义。

