原发性肺肠型腺癌11例临床病理分析
梁 洁,时姗姗,吴 妍
肺腺癌是肺癌常见的病理组织学类型(占50%),病理学亚型多样,包括腺泡型、乳头状型和微乳头型等[1]。2011年肺腺癌国际多学科分类将肠型腺癌作为一类新的、独立的浸润性肺腺癌病理亚型。肺肠型腺癌具有结直肠腺癌的部分病理形态学和免疫表型,肠型分化成分占整个肿瘤的50%以上[2],至少表达1种肠型分化免疫组化标志物。目前,肺肠型腺癌报道较少。本文探讨肺肠型腺癌的临床病理特征、免疫表型、诊断与鉴别诊断,旨在提高对该病的认识水平。
1 材料与方法
1.1 临床资料收集2017年3月~2023年3月南京医科大学第一附属医院病理科存档的18 631例肺癌手术标本筛选出肺肠型腺癌11例,经两位高年资病理医师复核、确诊。收集患者的病史、临床资料、发病部位和治疗等信息,并进行随访。
1.2 方法
1.2.1免疫组化 标本均经10%中性福尔马林固定,石蜡包埋,行HE和免疫组化EnVision法染色。抗体CK7、CK20、CDX-2、Villin、TTF-1和Napsin A,均购自福州迈新公司,设阴、阳性对照。将每张切片在400倍显微镜下随机选取5个视野计数阳性细胞数和观察细胞质(细胞核)着色强度,对染色强度和阳性细胞数进行综合评分判断阴、阳性。Villin定位于胞质或胞膜,CK7、CK20、Napsin A定位于胞质,CDX-2、TTF-1定位于胞核。
1.2.2基因突变检测 (1)DNA提取:标本均经10%中性福尔马林固定,石蜡包埋,选取肿瘤成分>50%的蜡块,切片3~5 μm厚。采用FFPE样本DNA/RAN核酸提取试剂盒,从石蜡组织中提取DNA/RAN。(2)多重荧光PCR法:采用ARMS法对提取的DNA/RAN进行EGFR、ALK、ROS1、KRAS和BRAF基因突变检测,具体操作步骤按试剂盒说明书进行,每例实验均设阴、阳性对照。(3)基因突变检测结果均按试剂盒说明书进行判读。
2 结果
2.1 临床特征本组11例中男性6例,女性5例;患者年龄39~79岁,平均62岁。3例男性患者有20年以上吸烟史,余8例无特殊病史。发病部位:2例肿瘤发生于右下肺,4例发生于右上肺,5例发生于左下肺。7例以体检发现肺部占位就诊,1例因阑尾炎在外院就诊时发现肺部结节,3例以无明显诱因出现咳嗽、咳痰或胸部胀痛就诊。
2.2 病理检查
2.2.1眼观 送检标本均为灰白色肿物,呈结节状或分叶状,肿物最大径1.0~4.5 cm(平均2.3 cm),均无包膜,界欠清,切面灰白或灰黄色,质稍硬,部分伴坏死、出血。
2.2.2镜检 肿瘤组织呈腺管样、乳头样或筛状结构,少数可呈实性结构,部分肿瘤组织管腔内可见坏死。肿瘤细胞呈高柱状,假复层排列,胞质丰富嗜酸性,核大深染,核质比增大(图1)。本组原发性肺肠型腺癌的肠型分化均>50%,11例中有1例发生支气管旁淋巴结转移并见脉管内侵犯,1例可见癌组织累及肺膜。
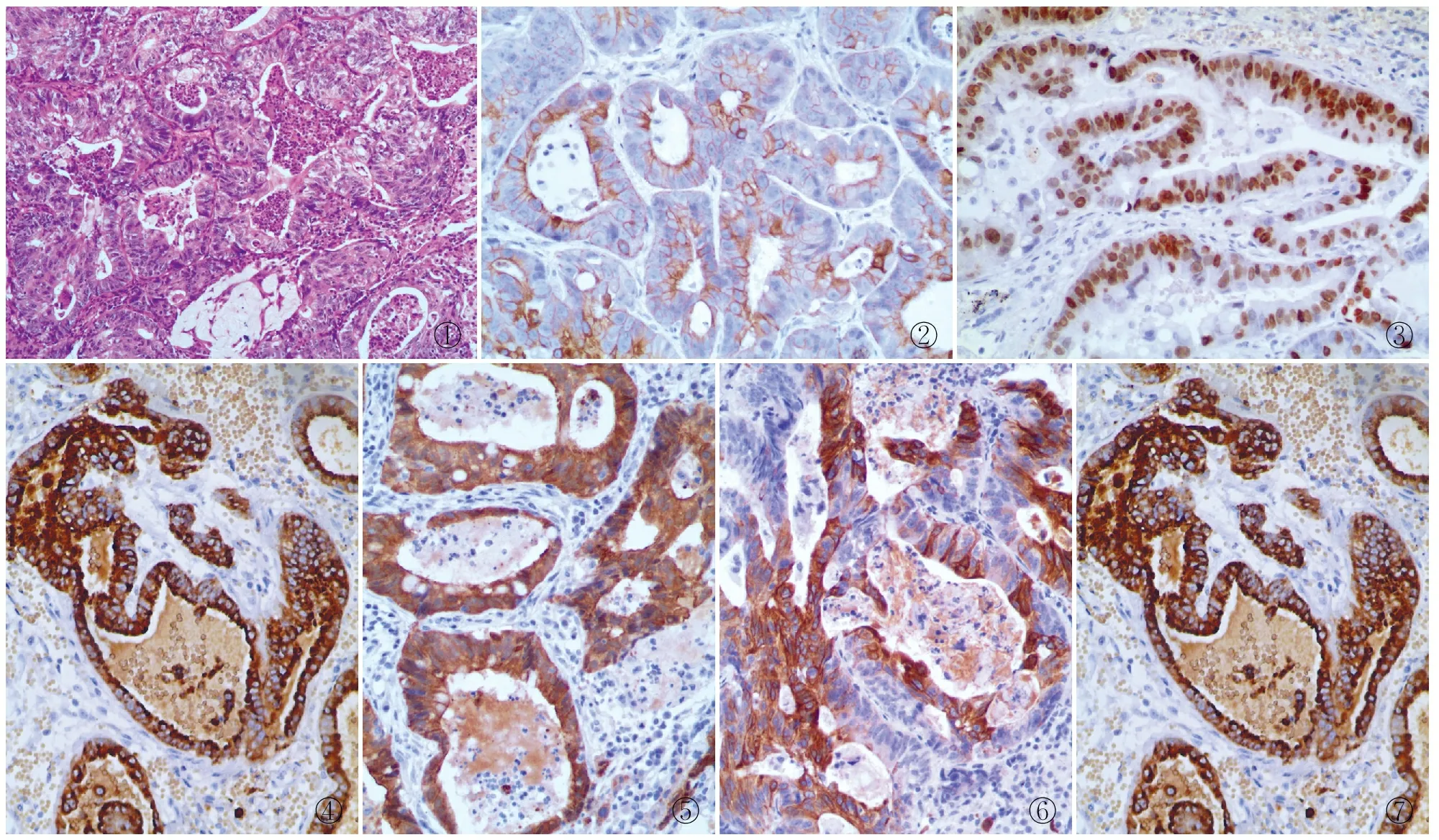
图1 肿瘤组织呈不规则腺管状、筛状排列,腺腔内见粉尘样坏死;肿瘤细胞呈高柱状、假复层排列,胞质丰富嗜酸性,核仁可见 图2 肿瘤细胞CK7呈阳性,EnVision法 图3 肿瘤细胞TTF-1呈阳性,EnVision法 图4 肿瘤细胞Napsin A呈阳性,EnVision法 图5 肿瘤细胞Villin呈阳性,EnVision法 图6 肿瘤细胞CK20呈阳性,EnVision法 图7 肿瘤细胞CDX-2呈阳性,EnVision法
2.2.3免疫表型 本组肺肠型腺癌中肿瘤组织中CK7(8/11)(图2)、TTF-1(1/11)(图3)、Napsin A(2/11)(图4)、Villin(7/11)(图5)、CK20(8/11)(图6)、CDX-2(10/11)(图7)。
2.3 基因检测本组检测显示KRAS基因突变5例,突变率为45.5%(5/11),其中有2例G12C(图8)、2例G12V、1例G12D突变;ALK融合基因突变1例(图9),突变率为9.0%(1/11);未发现EGFR基因突变和ROS1融合基因。

图8 KRAS基因G12C突变,ARMS法

图9 ALK融合基因突变,ARMS法
2.4 治疗与随访本组11例患者均行根治性手术切除,随访2~72个月;其中1例患者死亡,生存期为15个月;1例术后肝脏转移;1例术后骨转移,接受全身化疗病情稳定;其他患者均未发生胃肠道肿瘤病变。
3 讨论
1991年肺肠型腺癌由Tsao等[3]首次报道,组织学形态和结直肠腺癌非常相似。WHO(2004版)肺肿瘤分类中未见有此分类,随着医学检测和治疗手段的迅速发展,肺腺癌的诊断从单纯的形态学已转化为多学科协作诊治。2011年国际肺癌研究协会(IASLC)、美国胸科学会(ATS)和欧洲呼吸学会(ERS)联合公布肺腺癌国际多科学分类,将肠型腺癌列为原发性浸润性肺腺癌的独立变异病理类型。原发性肺肠型腺癌与结直肠腺癌在病理形态表现和免疫表型有部分重叠,与转移性结直肠腺癌相比,肺肠型腺癌有组织学异质性,表现为混合其他的常见组织学类型,免疫表型至少表达1种肠型分化的标志物,如CDX-2、CK20和Villin均阳性[4-5]。
原发性肺肠型腺癌临床较少见,文献报道该病多见于中老年人,女性多发[6],患者有咳嗽、咳痰、痰中带血、胸痛和气短等,肿瘤多位于右肺[7-8]。本组患者5例位于左肺,6例位于右肺,发病部位无明显差异。患者大多无明显临床表现,仅在体检或其他手术时偶然发现,仅少部分患者有咳嗽或胸痛症状,以上特征与文献报道略有不同。由于本组病例较少,还需积累更多病例进一步分析。
肺是结直肠腺癌常见的转移部位,肺肠型腺癌和转移性结直肠腺癌仅依靠组织学形态难以鉴别,两者在组织学形态和免疫表型均有相似性。肺肠型腺癌可合并其他肺腺癌组织学亚型成分,而肺转移性结直肠腺癌组织学形态单一,除腺管状排列外,无其他组织学亚型。本组11例肺肠型腺癌肿瘤组织呈规则或不规则腺管状、乳头状和筛状排列,肿瘤细胞高柱状、假复层排列,胞质丰富嗜酸性,核卵圆形,核仁可见,局部可见刷状缘形成,部分可见管腔内粉尘样坏死和明显的核碎片。患者的肠型分化比例均>50%,无实性结构为主的形态学表现。肿瘤具有异质性,可同时混合其他类型肺腺癌的组织学形态,当存在其他组织学形态时,病理报告应作出描述。免疫组化检测有助于肺肠型腺癌和肺转移性结直肠腺癌的鉴别诊断,肺腺癌常表达CK7、TTF-1和Napsin A,不表达CDX-2、CK20、MUC2和Villin,肺转移性结直肠腺癌则与之相反,肺肠型腺癌除表达肺特异性标志物外,同时至少表达1种结直肠腺癌标志物。文献报道,大多数肺肠型腺癌表达CK7,也有少数不表达[9]。Hatanaka等[10]报道1例无吸烟史的51岁女性患者,胸部X片发现异常阴影,行肺叶切除,肿瘤组织呈不规则复杂腺管状排列,伴中央坏死,肿瘤细胞呈高柱状,胞质嗜酸性,核呈椭圆形,边缘呈刷状。免疫表型:肿瘤细胞不表达CK7、TTF-1、Napsin A和MUC5AC,部分表达MUC2,强表达CK20、CDX-2,提示转移性结直肠腺癌,但患者术后通过胃肠镜、CT等检查未发现原发或转移性肿瘤,随访4年未见复发或转移,最终诊断为原发性肺肠型腺癌[10]。本组2例患者与文献报道一致,肿瘤细胞不表达CK7、TTF-1和Napsin A,但表达CK20、CDX-2、Villin。本组还有1例肿瘤细胞不表达CK7、TTF-1、Napsin A和Villin,但表达CK20、CDX-2。因此,诊断肺肠型腺癌前,需先排除消化道肿瘤的转移。此外,也有学者报道在非肠型原发性肺腺癌中可以检测CDX-2的表达,CDX-2不能作为鉴别肺源性和转移性肿瘤的唯一标准[11]。因此,上述免疫组化标志物不具有诊断和鉴别诊断的特异性,只能作为辅助诊断工具,需对患者的临床病史、影像学和病理组织学进行综合判断。
目前,大多学者认为肺肠型腺癌与其他原发肺腺癌不同,其KRAS基因突变频率较高,常见的突变位点有KRAS G12V、KRAS G12D、KRAS G12C和KRAS G13D,而EGFR和ALK多为野生型[12-13]。本组有5例检出KRAS突变,1例ALK融合基因突变,其中突变位点:2例KRAS G12C、2例KRAS G12V、1例KRAS G12D,同时伴ALK融合基因突变,与文献报道相似。KRAS突变并不具有特异性,其也可见于肺黏液癌,特别是G12D和G12V突变中,G12V在结直肠腺癌中也较常见[14-16]。因此,KRAS作为高频突变基因对肺肠型腺癌的预后和治疗需进行更深入的分析。
综上所述,原发性肺肠型腺癌是一种少见的组织学亚型,临床发病率较低,治疗以手术切除为主,术后辅助放、化疗。由于肺肠型腺癌和肺转移性结直肠腺癌相似,尚无特异性的鉴别指标,需结合临床病史、影像学等,在除外结直肠腺癌转移后才可做出诊断。目前,肺肠型腺癌仍有许多问题亟待解决,如肿瘤的生物学特性、疾病机制、预后和治疗等,随着精准医学、分子检测的高速发展,进行大样本研究将提高对肺肠型腺癌的认识和改善患者预后。

