CO2 浓度升高及增温下谷子土壤酶活性及其温度敏感性*
梁 蒙,路冰冰,吴阳,王雪松,郑粉莉,3,刘国彬,3,薛萐,3**
(1. 西北农林科技大学林学院 杨凌 712100;2. 西北农林科技大学水土保持研究所/黄土高原土壤侵蚀与旱地农业国家重点实验室 杨凌 712100;3. 中国科学院水利部水土保持研究所 杨凌 712100)
由于人类活动等因素的影响,大气CO2浓度大幅度增加,并导致全球气候变暖,1880 年以来全球平均气温升高0.85 ℃[1]。到2017 年,全球大气中CO2浓度增加到403 μmol·mol-1[2],预测到2100 年CO2浓度将达524~935 μmol·mol-1,温度将升高1.1~4.8 ℃[1]。CO2浓度和温度升高对土壤生态系统产生了一系列复杂的影响[3-5]。土壤酶是土壤生态系统的重要组成部分[6],其来源于土壤微生物和动植物活体分泌,在促进土壤有机物分解[7]、碳氮磷养分循环[8]等方面发挥重要作用。由于土壤酶在土壤生态系统中的驱动作用以及其对环境变化极高的敏感性[9],土壤酶的温度敏感性(Q10)可以反映其对温度变化的敏感程度,通过研究土壤酶活性及其Q10特征可以反映土壤养分代谢功能和稳定性。
土壤酶活性受植物、土壤养分、季节变化及土壤水热条件等因素的调控,其中与土壤有机碳含量的相关性较高[10-11]。一些研究显示气候变化对土壤酶活性也有一定影响,其结果有促进[12-15]、减弱[16]和无显著影响[13]。CO2浓度升高使输入到土壤中的碳水化合物增加,提高了土壤C 循环相关酶的活性[12]。而C4 植物光合作用受CO2浓度的影响较小,根系向土壤输入的有机物有限,因此对β-葡糖苷酶(βG)的影响不显著,但使β-N-乙酰葡糖苷酶(NAG)活性显著增加[13]。增温通过影响有机物质的矿化、微生物群落结构等间接影响土壤酶的活性。在一定温度范围内,增温对参与土壤有机碳分解的胞外酶具有促进作用[14],βG 和纤维素酶(CBH)的活性在增温下均显著增加[15];增温也可通过降低土壤细菌与真菌比值,导致βG 和NAG 活性减弱[16]。总之,由于酶的种类、微生物群落以及供试土壤等差异较大,CO2浓度升高和增温对土壤胞外酶活性的影响暂无统一定论。关于土壤酶活性温度敏感性的影响因素已有一些研究,如Q10对温度[17-20]、纬度[21]以及季节变化[18,22]的响应。研究认为,较低温度下和高纬度地区的土壤酶表现出更高的温度敏感性[17,21],这是土壤酶对寒冷环境的适应,便于在低温环境下维持养分循环[17]。在不同生态系统中,增温对微生物群落的影响不同,因此不同地区土壤酶活性Q10对增温的响应不同[19-20]。例如,美国Whitehall 森林土壤中增温对酶活性的温度敏感性没有影响,但更温暖的温度可通过微生物群落变化来诱导热适应,并导致胞外酶Q10降低[19];而在北方森林中,变暖通过控制微生物生物量影响土壤中酶的类型和数量,使土壤酶的Q10表现出抗性或弹性[20]。这些研究已经探究了变暖对Q10的影响,然而对于CO2浓度升高、干旱以及多因子交互作用对土壤酶活性温度敏感性的研究还较为薄弱。
随着全球气候变暖,增温、CO2浓度、干旱和极端气候事件等直接影响着粮食生产。谷子(Setaria italica)是主要的粮食作物之一,广泛栽培于黄河中上游,是重要的杂粮作物。因此,本研究模拟CO2浓度升高、增温和轻度干旱条件,以谷子灌浆期的土壤为研究对象,通过分析3 个因素交互作用对不同温度下4 种土壤碳氮循环相关酶的活性和Q10特征的影响,揭示多因子全球变化背景下农作物土壤的碳氮代谢功能及其稳定性,为预测多因子气候变化对粮食生产以及未来气候变化下的土壤生态系统功能稳定性提供科学依据。
1 材料与方法
1.1 试验设计
采用盆栽土培的方法进行栽培种植,将供试土壤过5 mm 筛,风干后混合均匀并装盆。盆栽器皿为圆柱形,内径21 cm,深度27 cm,每盆装填深度为20 cm。供试作物为谷子,品种为‘晋谷21’。供试土壤取自陕西杨凌区农田表层0~20 cm 的土壤,土壤质地为壤土,pH 为8.3,有机质为31.03 g·kg-1,全氮为1.51 g·kg-1,全磷为0.97 g·kg-1,速效磷为26.59 mg·kg-1,土壤容重为1.26 g·cm-3,田间持水量为26% (质量含水量)。
谷子播种时间为2019 年4 月中旬,选择大小一致的种子播种于塑料盆中,每盆播5~7 穴,每穴1~2粒种子,共计18 盆。在室外培养至三叶期时定植3 株,继续培育至拔节期,盆栽土壤定时定量补充水分,土壤水分保持为60%田间持水量。待谷子进入拔节期后,于2019 年6 月5 日转移至人工模拟气候室。将盆栽随机分成3 组,分别放入3 个人工气候室。试验气候条件的设定依据参考IPPC[1]和WDCGG[2]的预测数据以及国家气象科学数据中心(武功站)发布的资料[23],水分条件设定参考袁蕊等[24]研究。1 号气候室为CO2浓度升高处理(CO2浓度为700 μmol·mol-1、日均温度为22 ℃),2 号气候室为CO2浓度和温度升高组合处理(CO2浓度为700 μmol·mol-1、日均温度为26 ℃),3 号气候室为对照(CO2浓度为400 μmol·mol-1、日均温度为22 ℃)。此外,同一气候室的盆栽再随机分为两组,设置轻度干旱(50%田间持水量)和充分供水(70%田间持水量)两种水分条件,共6 个处理(表1),每个处理3 个重复。每天采用称重法控制盆栽的土壤含水量,同时调换盆栽位置,避免局部光照、温度、湿度的影响,直至灌浆期采集土壤样品。

表1 各试验处理的CO2 浓度、气温和土壤含水量Table 1 CO2 concentration,air temperature and soil water content of each treatment
1.2 样品采集
在谷子灌浆期(播种后约100~110 d),采集不同处理下的盆栽土壤样品。将土体完整从盆中取出,剔除凋落物和根系残体,混合均匀后过2 mm 筛,一部分土样风干过筛后用于土壤有机碳、土壤全氮、全磷及pH 等指标的测定,一部分新鲜土样密封保存于4 ℃冰箱中,用于土壤酶活性的测定。每个处理3 个重复。
1.3 土壤基本理化性质测定
土壤pH 采用pH 计测定(土水比1∶2.5);土壤含水率采用烘干法测定;土壤有机碳(SOC)采用H2SO4-K2Cr2O7氧化法测定;土壤全氮(TN)采用凯氏定氮法测定;土壤全磷(TP)采用H2SO4-HClO4消煮后于紫外分光光度计测定;速效磷(AP)采用NaHCO3浸提,钼睇钪比色法测定;微生物生物量碳、氮、磷(MBC、MBN、MBP)采用氯仿熏蒸提取法测定[25]。土壤基本理化性质如表2 所示。
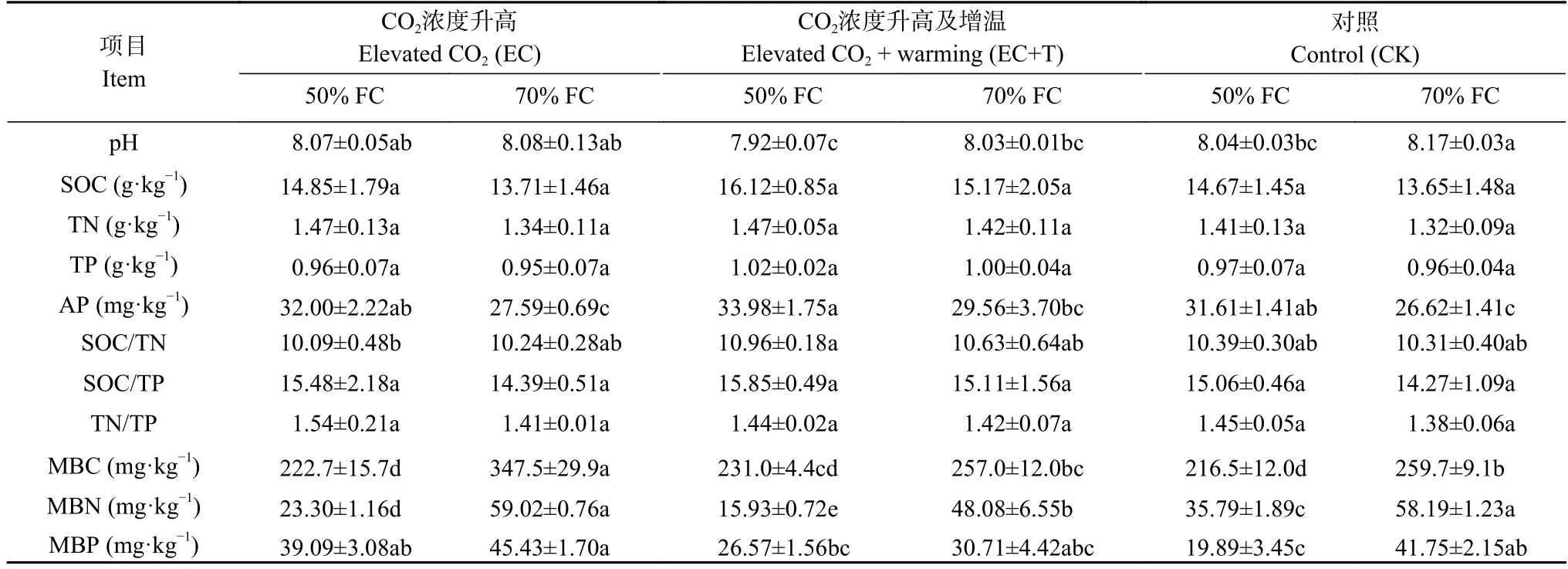
表2 谷子灌浆期土壤基本理化性质Table 2 Basic physical and chemical properties of soil at grain filling stage of millet
1.4 土壤胞外酶活性及其温度敏感性测定
对采集的18 个样品进行土壤酶活性及其温度敏感性的测定。土壤酶活性分析采用微孔板荧光法[26],具体测定方法参考赵子文等[27]的研究。酶标板加样后于5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃和35 ℃共7 个温度梯度的恒温培养箱中培养相应时间后测定,各土壤酶对应的底物及培养时间如表3 所示。土壤酶活性的温度敏感性(Q10)计算公式为:

表3 测定土壤酶活性的底物及培养时间Table 3 Substrates and incubation time for determination of soil enzyme activity
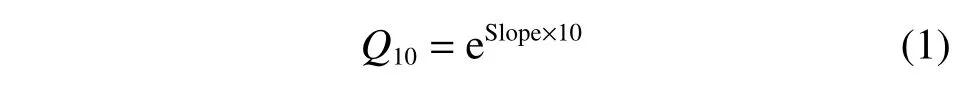
式中:Slope 为酶活性进行对数转换后与培养温度拟合线性回归方程的斜率[22]。
1.5 数据分析
采用Microsoft Office Excel 2019 进行数据整理,采用SPSS 26.0 进行统计分析,用单因素(One-way ANOVA)法进行方差分析,不同处理间的差异性检验通过Duncan 法进行多重比较(P<0.05),利用Canoco 5.0 软件进行冗余分析,用Origin 2018 绘图,图中各数据为平均值±标准差。
2 结果与分析
2.1 土壤酶活性对CO2 浓度升高和增温的响应
CK 在充分供水处理下(CK+70% FC),谷子灌浆期土壤中βG、NAG、CBH 和βX 的酶活性随着培养温度升高大体呈先升高后降低的趋势,均在25 ℃酶活性最高,10 ℃最低,即谷子灌浆期土壤酶的最适温度为25 ℃ (图1)。在最适温度下,4 种土壤酶的活性在不同处理下差异显著,总体为CK>EC+T>EC (图2)。在70% FC 条件下,EC 使土壤βG 酶活性显著降低(P<0.05),但对NAG、CBH、βX 酶活性的抑制作用不显著;相比于仅EC,EC+T 使4 种土壤酶的活性有所增加,尤其对βG 的影响显著(P<0.05)。然而,在50% FC 条件下,EC+T 对土壤酶活性的影响与EC 相比无显著差异,即增温对土壤酶活性的相对促进作用受到水分影响。与充分供水条件下CK 相比,仅轻度干旱(50% FC)显著抑制CBH 的活性(P<0.05),但对βG、NAG 和βX 无显著影响。EC 对土壤酶活性的抑制作用在轻度干旱时加剧,βG、NAG、CBH 和βX 的活性均显著降低(P<0.05)。EC+T 对4 种土壤酶的影响在两种水分条件下不同,在50% FC 条件下,酶活性显著降低(P<0.05),在70% FC 时均无明显差异,即CO2浓度升高和增温两者交互作用对4 种土壤酶活性的影响不显著,而CO2浓度升高、增温及干旱三者对其有显著的交互作用。此外,CO2浓度和温度显著影响土壤βG、NAG、CBH 和βX 的最适温度(P<0.05,图2)。EC 使βG、NAG、CBH 和βX 的活性随着培养温度升高先增加再略有降低而后继续升高,在35 ℃酶活性最高。EC+T 对4 种土壤酶活性的影响因水分条件而异,在50% FC 下,谷子灌浆期土壤酶活性在35 ℃时最高;在70% FC 条件下与CK 无异,在25 ℃时酶活性最高。

图1 充分供水条件下培养温度对土壤酶活性的影响Fig.1 Effects of incubation temperature on soil enzyme activities under the sufficient water supply condition
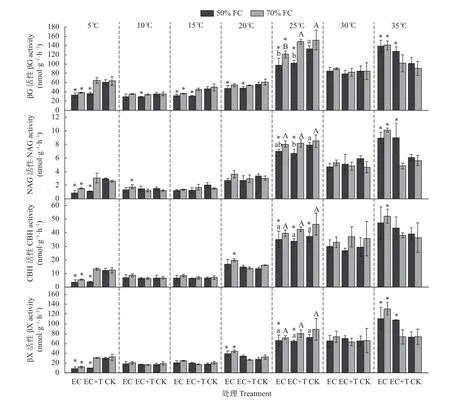
图2 不同培养温度下CO2 浓度升高、增温和土壤水分对谷子灌浆期土壤酶活性的影响Fig.2 Effects of elevated CO2,warming and soil water on soil enzyme activity at grain filling stage of millet at different incubation temperatures
2.2 土壤酶活性的温度敏感性(Q10)对CO2 浓度升高和增温的响应
CO2浓度升高和增温对4 种酶活性的Q10有显著影响,谷子灌浆期土壤酶活性的Q10在不同条件下表现为EC>EC+T>CK(图3)。在70%FC条件下,EC对4种土壤酶活性Q10均有显著抑制作用(P<0.05),使βG、NAG、CBH 和βX 的Q10分别增大24.6%、23.1%、20.7%和38.0%;相比于EC 处理,EC+T 使Q10显著减小(P<0.05),即增温对Q10具有相对促进作用。但在50% FC 条件下,EC 和EC+T 均导致Q10显著增大(P<0.05),且两者的影响无显著差异。同时,EC 对Q10的影响在轻度干旱条件下抑制作用更大,尤其是在NAG 的Q10中表现显著(P<0.05),使Q10(NAG)增大了43.1%。此外,4 种土壤酶活性Q10对EC+T的响应受土壤水分条件的影响,与充分供水条件下CK 相比,在70% FC 时,EC+T 对土壤酶活性的Q10几乎没有影响;但在50% FC 条件下,EC+T 使4 种土壤酶的Q10分别增大25.2%、30.2%、26.7%和41.4%(P<0.05)。在CO2浓度和温度为正常值时,轻度干旱对Q10没有显著影响。

图3 CO2 浓度升高和增温对不同土壤水分条件下谷子灌浆期土壤酶活性温度敏感性(Q10)的影响Fig.3 Effects of elevated CO2 and warming on the temperature sensitivity (Q10) of soil enzyme activities at grain filling stage of millet under different soil water conditons
多因素方差分析结果显示(表4),CO2浓度对不同酶活性Q10均具有显著或极显著影响(P<0.05 或P<0.01);温度对土壤酶活性的Q10均具有显著影响(P<0.05);水分对土壤酶活性的Q10均无显著影响。CO2×T 以及T×FC 对Q10无显著影响;而CO2×FC 对4 种土壤酶活性的Q10均有显著影响(P<0.05),其中对土壤βG 和βX 有极显著影响(P<0.01)。此外,CO2×T×FC 对4 种土壤酶活性的Q10也具有显著影响(P<0.05),其中对土壤βG、NAG 和βX 的影响达到极显著水平(P<0.01)。
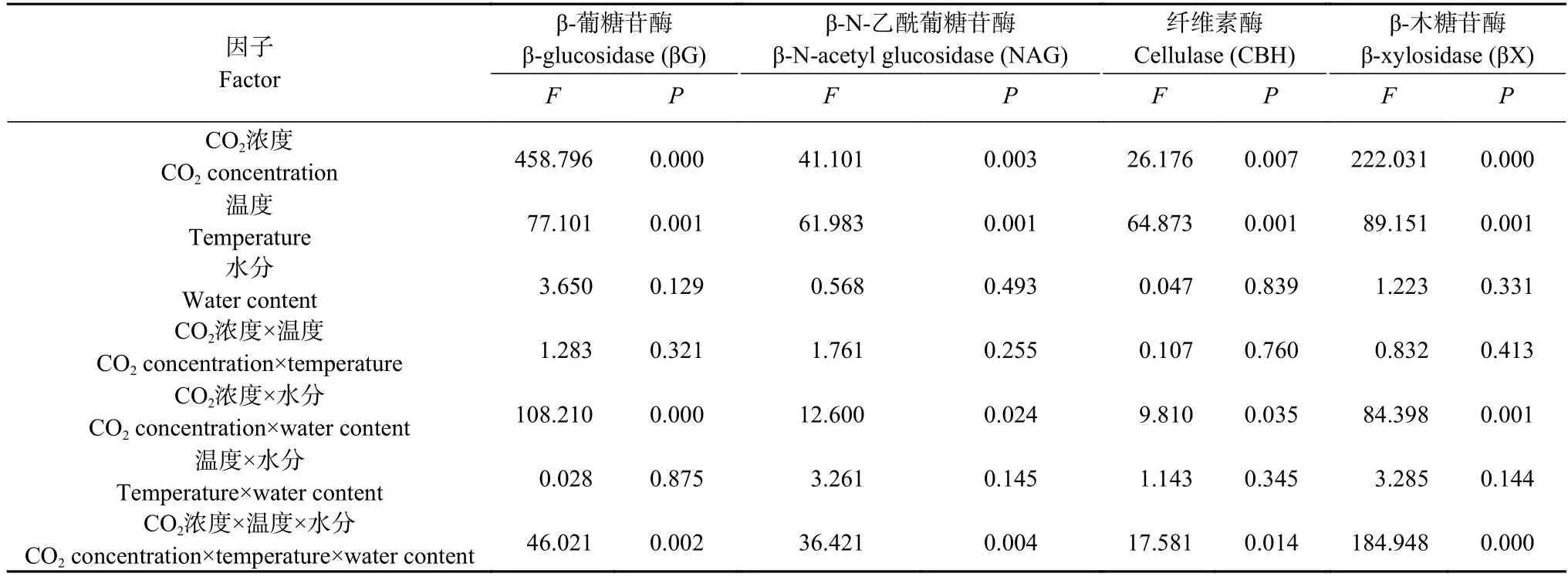
表4 CO2、温度和土壤水分及其交互作用对土壤酶活性温度敏感性(Q10)影响的多因素方差分析Table 4 Multivariate analysis of variance for the effects of CO2,temperature,moisture and their interaction on temperature sensitivities (Q10) of soil enzyme activities
2.3 土壤酶活性的温度敏感性(Q10)的影响因素
冗余分析表明(图4),环境变量对土壤酶活性Q10变化的总解释率为 87.4%。其中,RDA1 和RDA2 的解释率分别为84.9%和2.5%。Q10与环境因子尤其是MBC、MBN 以及MBP 之间的相关性较 强。βG、NAG、CBH和βX酶活性的Q10均与MBN显著负相关,与MBC、MBP显著正相关。另外,Q10与TP、TN、SOC、AP、N∶P 及C∶P 等理化因子呈正相关,但均未达到显著水平。
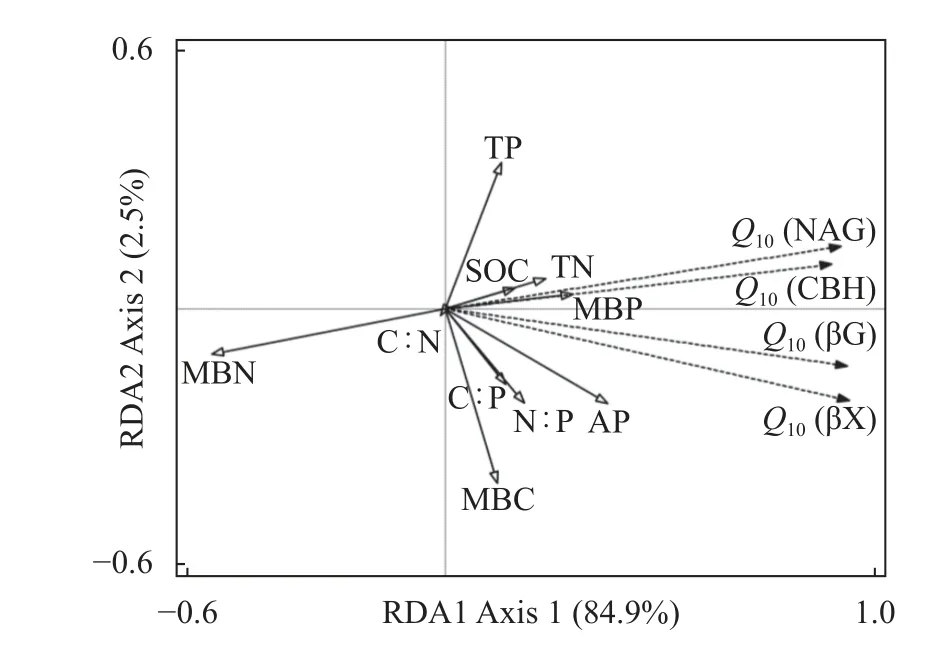
图4 土壤酶活性的温度敏感性(Q10)和环境因子的冗余分析Fig.4 Redundancy analysis of temperature sensitivity (Q10) of soil enzyme activity with environmental factors
3 讨论
3.1 CO2 浓度升高和增温对土壤胞外酶活性的影响
本研究表明,在25 ℃下,CO2浓度升高对土壤NAG、CBH 和βX 的活性没有显著影响,而显著降低βG 酶活性,此结果与前人的研究结论基本一致[13]。土壤胞外酶活性受温度、CO2浓度、土壤pH、含水量、微生物生物量和生态系统类型等多因素影响[28-29]。CO2浓度升高通过调控植物生长、光合作用影响土壤微生物获取养分,从而使土壤酶的产生和代谢受到影响[30-31]。本研究中,CO2浓度升高下土壤NAG、CBH 和βX 的活性没有明显的变化。一方面,CO2浓度升高增加了土壤中微生物量碳、氮、磷含量(表2),但较高的CO2条件下植物获取无机营养超过微生物,土壤微生物的养分限制加剧,因此微生物活性普遍降低,高微生物生物量对酶活性的影响被抵消或限制[32-33]。另一方面,本研究的供试作物谷子是一种C4 植物,CO2浓度升高对其光合作用影响较小,根系向土壤输入的有机物有限[13],土壤SOC 含量几乎不受影响(表2),因此土壤酶活性变化不明显。CO2浓度升高+增温使4 种土壤酶的活性相比于仅CO2浓度升高有所增加,增温的积极作用对CO2浓度升高导致的酶活性降低进行了补偿。这与McDaniel 等[16]的研究结果不同,其研究结果显示,温度升高影响了微生物的群落结构,进而导致βG 和NAG 的活性降低。温度是土壤酶活性最重要的驱动因素之一[34],增温使酶与底物碰撞和分解的速率加快,可直接对酶活性产生影响[35];也可通过影响有机物质的矿化、微生物群落及加快凋落物的分解速率等间接提高土壤酶活性[5,36]。本研究中谷子土壤更受增温对土壤有机物质的影响,增温下谷子土壤有机质含量增加,短期增温提高了土壤酶活性,尤其对参与SOC 分解的βG、CBH 和βX 活性的促进作用更明显[14]。4 种土壤酶的活性在充分供水条件下大于轻度干旱,并且在CBH 中表现显著。水分对土壤酶活性有很强的正向影响,较高的含水量可使土壤酶与底物更好地结合,从而促进了酶的作用[37]。而干旱胁迫会影响植物生长和根茎沉积,植物根际环境变化限制了酶和底物扩散以及相互作用,影响底物的有效性,导致土壤酶的活性降低[33,37]。同时,土壤微生物可通过自身生理代谢的变化来抵御干旱胁迫,维持土壤酶活性的稳定性。因此,轻度干旱对βG、NAG 和βX 活性的影响并不显著。
本研究还发现CO2浓度升高和干旱对土壤酶活性有显著的交互作用,CO2浓度升高对土壤酶活性的抑制作用在轻度干旱下被加强。同样,Xue 等[33]的研究也表明,CO2×干旱显著影响土壤酶活性。干旱胁迫可直接影响土壤微生物活动及其群落的功能结构[38],因此,与仅CO2浓度升高相比,CO2浓度升高×干旱对土壤胞外酶活性的影响更强烈。与CK 相比,在70% FC 条件下,CO2浓度升高×增温的交互作用对4 种土壤酶活性的影响不显著,增温减轻或抵消了CO2浓度升高对土壤酶活性的负面影响,从而减少了CO2浓度升高对植物光合作用和土壤微生物获取养分的影响,进而维持了微生物的活性以及酶的产生和代谢。但在50% FC 条件下,较低的含水量影响酶与底物结合[37],土壤干旱抑制了增温对酶活性的积极影响。此外,谷子灌浆期土壤酶的最适温度为25 ℃,而CO2浓度升高和CO2浓度升高×增温×干旱三者的交互作用使土壤胞外酶活性在35 ℃时达到最大值。研究认为,较暖气候下的土壤通常比气候较冷的土壤表现出更高的最适温度[39],CO2浓度、温度升高和干旱可能通过影响土壤的水热条件从而对土壤酶的最适温度产生了影响。
3.2 CO2 浓度升高和增温对土壤酶活性Q10 的影响
土壤酶对温度变化的敏感程度通常用Q10表示,可反映温度变化后酶活性的变化规律。与催化底物相结合的位置称为酶活性位点[40],土壤酶活性的Q10主要由酶活性位点的可及性决定[34]。不同酶的温度敏感性范围很广,但通常情况下Q10小于2,且大多数酶的Q10都接近1.5[41]。本研究中,测得βG、NAG、CBH 和βX4种土壤酶的Q10分别为1.32、1.62、1.81 和1.57 (图3),与其他研究结果一致。在CO2浓度升高、增温以及干旱的作用下,Q10有所增大,不同种类酶的Q10对CO2浓度升高和增温的响应幅度不同。
CO2浓度升高使土壤胞外酶活性的Q10显著增大,相比于仅CO2浓度升高,增温4 ℃使Q10明显减小。CO2浓度升高和增温影响土壤微生物的代谢活性及群落结构[29,42],不同微生物群落产生的同工酶与土壤颗粒和酚类化合物相互作用,可影响酶的动力学和温度敏感性[43],Q10的变化可能是由于微生物产生的同功酶的温度敏感性不同于它们在酶库中替代的同功酶[44]。已有研究表明,土壤酶在较低温度下的温度敏感性更大[17,45],这是由于温暖条件下的土壤酶有更大的抗热变性能力[39],我们的研究结果与此结论相互印证。然而,Jing 等[46]却提出了不同的观点,认为增温对土壤胞外酶活性Q10的影响不显著,其原因之一是试验增温对气温日变化或季节变化的影响太小;另一个原因可能是土壤湿度的限制。本研究还发现,在CO2浓度和温度为正常值时,水分对土壤胞外酶活性Q10的影响不显著。土壤微生物通过生理代谢的变化,如降低微生物矿化、增加微生物合成或提高碳利用效率来缓解干旱的负面影响[33],从而维持了土壤酶的稳定性。研究显示,随着土壤湿度的增加,扩散限制缓解,现有的功能酶库能够更好地与底物相互作用,导致干旱处理下土壤酶活性对土壤水分的敏感性高于湿润条件[37]。尽管我们的试验中不同水分处理下土壤酶活性的Q10没有显著差异,但βG 和CBH 在充分供水时的敏感性略小于轻度干旱,一定程度上体现了高土壤含水量的积极作用。
本研究表明,CO2浓度升高和轻度干旱对Q10有明显的交互作用。CO2浓度升高和干旱都可使土壤中微生物的活动和群落功能结构受到影响[29,38],从而影响土壤酶的产生和代谢,因此CO2×干旱对土壤酶活性Q10的影响也更剧烈。在充分供水条件下,CO2浓度升高×增温两者交互作用对Q10无显著影响,增温抵消了CO2浓度升高对Q10的影响,即CO2浓度升高和增温两者拮抗。增温使土壤环境温度与土壤酶的最适温度(25 ℃)接近,可能为土壤酶提供了更加适宜的气候和土壤条件,使土壤酶的活性和功能更稳定;增温也可通过微生物群落的变化来诱导热适应[19],因此温度敏感性更低。然而,CO2浓度升高×增温×干旱三者对Q10有显著的交互作用,即增温对Q10的减小作用可能受到土壤水分的限制,Suseela 等[47]关于土壤呼吸温度敏感性的研究也有类似的结论。
CO2浓度、温度和水分对Q10有显著的交互作用,气候变化带来的大气CO2浓度上升、温度升高以及干旱等一系列变化就可能会影响到土壤生态系统功能和稳定性。此外,前人研究表明土壤酶活性的Q10对纬度[21]、季节变化[18,22]以及海拔[48]有显著响应。本研究还发现,除CO2浓度和温度外,Q10还受到土壤微生物量、土壤养分等多个环境因素的影响。因此,在利用土壤酶活性及其温度敏感性的特征研究土壤动态时,需要综合考虑多因子及其交互作用的影响,从而更准确地评估土壤生态系统的稳定性。
4 结论
本研究表明,CO2浓度升高和增温显著影响土壤酶活性及其温度敏感性,尤其是CO2浓度升高抑制了土壤酶活性,同时增加了土壤酶的温度敏感性;
CO2浓度、温度和水分三者对土壤酶活性温度敏感性的交互作用显著,那么气候变化带来的CO2浓度升高、变暖以及干旱就有可能对土壤生态系统稳定性产生深刻且复杂的影响。土壤酶活性降低及温度敏感性增大会削弱土壤碳氮循环相关酶的代谢功能及稳定性,从而减弱土壤物质循环及土壤生态系统的功能稳定性。本研究补充了全球气候变暖背景下多因子交互作用对土壤酶活性温度敏感性的影响,但由于影响土壤酶温度敏感性的生物和理化因素的复杂性,研究仅分析了增温的相对作用,还需要进一步的研究以确定这些因素导致土壤环境或微生物数量、活动和群落组成变化的机制,更准确地揭示未来多因子气候变化下土壤生态系统功能稳定性及其驱动机制。

