重症高甘油三酯血症性急性胰腺炎发生的危险因素分析*
王鵷臻,顾晓静,吴 佳,黄李雅
(宁夏医科大学总医院消化内科,银川 750004)
急性胰腺炎(acute pancreatitis,AP)是消化系统常见的疾病之一,病死率较高,近年来,随着我国人民生活水平的提高,人们的饮食结构也随之改变,高脂血症已跃升为引起AP的第二大常见病因,高甘油三酯血症性急性胰腺炎(hypertriglyceridemia pancreatitis,HTGP)的发生与血清甘油三酯水平升高密切相关[1]。与胆源性胰腺炎相比,HTGP患者趋向年轻化,体重指数(BMI)更高,更易合并代谢综合征,且HTGP患者重症化倾向更明显,死亡率高,预后差[2]。因此,本研究对重症HTGP发生的危险因素进行分析,旨在提高临床医师对该病的早期识别,为临床诊疗提供参考。
1 资料与方法
1.1 一般资料
回顾性分析本院2016-2021年收治的HTGP患者300例临床资料,根据患者病情程度分为轻症急性胰腺炎(MAP),中度重症急性胰腺炎(MSAP)和重症急性胰腺炎(SAP)。本研究经医院伦理委员会审核批准(KYLL-2022-0021)。AP诊断标准符合中国胰腺炎诊治指南的标准(2019年版);HTGP诊断标准为血甘油三酯>11.30 mmol/L,或血甘油三酯在5.56~11.30 mmol/L且血清呈乳糜状。排除其他因素引起的AP,如胆源性、酒精性、自身免疫性、药物性等。
1.2 方法
收集患者的临床病历资料。(1)一般资料:性别、年龄、BMI等;(2)既往史、合并症、个人史、药物服用史,入院时急性生理与慢性健康评分Ⅱ(APACHE Ⅱ评分)及急性胰腺炎床旁严重度指数(BISAP)评分;(3)入院24 h实验室检查结果:血pH、白细胞计数、中性粒细胞相对值、中性粒细胞绝对值、血小板计数、红细胞压积、D-二聚体、凝血酶原时间(PT)、凝血酶原国际标准比值(INR)、空腹血糖、血钙、血钾、尿酸、血尿素、血肌酐、血清白蛋白、乳酸脱氢酶(LDH)、淀粉酶、脂肪酶、总胆固醇、甘油三酯、C-反应蛋白(CRP)、降钙素原(PCT)等指标。
1.3 统计学处理

2 结 果
2.1 单因素分析
HTGP患者300例中男248例,女52例,年龄19~70岁,平均(36.8±8.7)岁。重症组57例,非重症组243例(轻症组199例、中度重症组44例),两组性别、年龄、BMI比较差异无统计学意义(P>0.05)。重症组呼吸频率明显高于非重症组(P<0.05),但心率比较差异无统计学意义(P>0.05)。入院时重症组APACHEⅡ评分、BISAP评分明显高于非重症组(P<0.01),两组吸烟史、饮酒史、药物服用史、合并脂肪肝、糖尿病比例差异均无统计学意义(P>0.05),见表1、2。
表1 重症HTGP危险因素单因素分析[n(%)]
白细胞计数、中性粒细胞绝对值、中性粒细胞相对值、D-二聚体、PT、INR、空腹血糖、血钙、血尿素、血肌酐、血清白蛋白、LDH、血淀粉酶、CRP为重症HTGP发生的影响因素(P<0.05),见表2。

表2 重症HTGP危险因素单因素分析

续表2 重症HTGP危险因素单因素分析
2.2 多因素分析
中性粒细胞相对值、D-二聚体升高和空腹高血糖为重症HTGP发生的独立危险因素(P<0.05),见表3。

表3 重症HTGP危险因素logistic回归分析
2.3 评估重症HTGP的效能分析
中性粒细胞相对值的AUC为0.670,最佳截点为81.45%,约登指数为0.324,灵敏度为85.7%,特异度为46.6%;D-二聚体AUC为0.721,最佳截点为0.725 μg/mL,约登指数为0.349,灵敏度为57.1%,特异度为77.7%;空腹血糖AUC为0.716,最佳截点为9.525 mmol/L,约登指数为0.347,灵敏度为75%,特异度为59.7%,见图1。
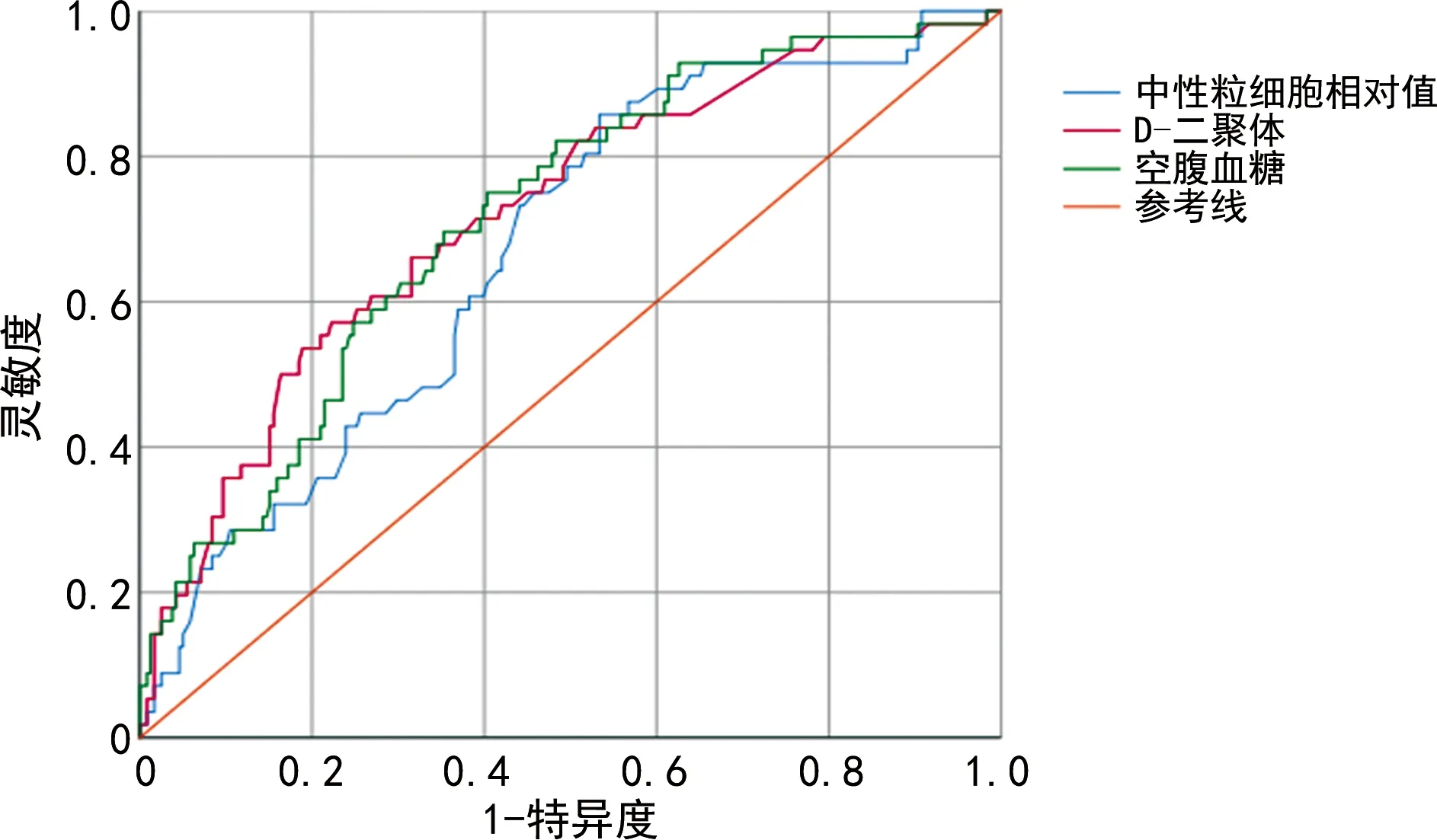
图1 中性粒细胞相对值、D-二聚体、空腹血糖的ROC曲线
3 讨 论
近年来,我国HTGP发病率呈上升趋势[3-4],其发病机制与胰腺微循环障碍、游离脂肪酸假说、蛋白激酶C活化、炎性反应等相关[5]。目前,尽管在HTGP诊断和治疗方面已经取得了进展,但仍有不少患者发展为重症,住院时间长、花费大、易合并多器官功能障碍综合征(MODS),需要重症监护和侵入性干预,因此,尽早对HTGP病情分层对于患者的治疗和预后评估至关重要。
重症HTGP患者胰腺的微循环障碍出现在疾病的早期,同时也易合并凝血功能和纤溶系统的异常[6]。其机制主要是高甘油三酯可以激活血小板,释放TXA2,导致微血管的收缩和血小板的聚集加剧,并诱导血小板变形、释放、分泌,导致全身凝血机制障碍,进一步加重胰腺微循环缺血[7]。重症HTGP时,由于血管通透性增加,血流减少,造成胰腺腺泡之间的血管栓塞甚至梗阻,血管内血栓形成及白细胞内皮细胞相互作用,通过组织因子途径激活凝血酶,启动外源性凝血途径,受损的内皮细胞等促进血小板活化因子的释放,诱导血小板聚集,激活凝血酶,启动内源性凝血途径的过度激活,继而凝血因子大量消耗,纤溶亢进[8]。本研究显示,D-二聚体、INR和PT变化均与HTGP病情严重程度有关,且随着病情的进展,重症HTGP患者的内源性及外源性凝血功能均出现异常,多因素分析结果显示D-二聚体升高是重症HTGP的独立危险因素,因此,调节凝血功能是HTGP治疗方面的重要环节。
近年来,对HTGP病理生理学研究发现,胰腺局部首先发生炎症并且激发机体全身炎性反应发生发展,进而造成循环、肺等器官衰竭,其中炎症是造成器官损伤最重要的因素[9]。本研究发现,白细胞计数、中性粒细胞绝对值、中性粒细胞相对值在两组间差异明显,且中性粒细胞相对值为重症HTGP发生的独立危险因素,其评估重症HTGP的灵敏度为85.7%,提示中性粒细胞比例与HTGP患者病情的严重程度密切相关。HTGP早期中性粒细胞数量和活性增加[10],大量中性粒细胞黏附到胰腺内皮细胞上,致使胰腺毛细血管后微静脉循环淤滞,进而导致胰腺微循环出现障碍,且活化的中性粒细胞产生大量的氧自由基和蛋白水解酶,蛋白水解酶可直接损害胰腺及其周围组织,激活炎性细胞因子级联而导致SIRS发生,加重胰腺炎病情,造成多器官功能障碍,甚至导致患者死亡[11-12]。由此可见,炎症在HTGP中的作用明显,尤其是中性粒细胞相对值对重症HTGP的发生有着较高的预测价值,且临床操作便捷,时效性强,能准确便捷的为临床医生提供参考。
多项研究显示,胰腺炎时,胰腺组织水肿、缺血、坏死、胰腺微循环障碍、胰岛素的分泌与释放减少[13],机体产生强烈的应激反应,激活交感神经系统,促进胰高血糖素水平的升高,并加速机体内糖原的分解,导致血糖升高,SAP甚至可以毁损胰腺的胰岛功能,使血糖升高更明显,进而出现酮症酸中毒[14]。重症HTGP发生时胰酶异常激活,机体炎症细胞释放如肿瘤坏死因子α(TNF-α)、干扰素(IFN)、白细胞介素6(IL-6)等大量炎症介质,机体急性应激处于高血糖状态,高血糖有较强的促炎作用,使机体炎性反应加强和内皮损伤加剧,很多研究发现,高血糖是AP发生器官衰竭的危险因素[15],监测与控制血糖水平应作为治疗重症HTGP患者的重点。与多数研究结果一致,本研究显示重症组HTGP患者空腹血糖升高更明显,表明发病时高血糖更易使HTGP病情趋向重症,持久的空腹血糖高于10 mmol/L反映胰腺坏死,提示预后不良,因此,及时检测血糖水平及合理控制血糖水平对HTGP患者病情转归有重要意义。
大量临床资料表明,低钙血症与AP的病情轻重存在一定相关性,AP患者发生低钙血症常提示出现胰腺坏死,胰腺坏死常预示AP出现重症倾向[16]。SAP时,大量胰脂肪酶分泌入血液及腹腔中,胰脂肪酶分解脂肪形成脂肪酸,后者与钙结合成脂肪酸钙沉积使钙大量消耗。本研究中,重症HTGP患者血钙水平降低更明显(P<0.01),且血钙预测HTGP严重程度AUC为0.777,具有一定的准确度。因此,入院时血钙可能是HTGP严重程度的一个潜在的预测因素,监测血钙水平对于疗效评价及预后判断具有重要临床意义。
综上所述,重症HTGP病情凶险,病死率高,深入认识其发病机制,指导临床医师制订更合理的治疗方法和干预措施,探索影响该病发生的危险因素,对疾病的病情评估、及时调整治疗方案有着积极的意义。

