棉铃虫载脂蛋白受体基因克隆及转录分析
刘香亚, 杨蕊弘, 张 晶, 彭英传, 肖海军, 张万娜*
(1.江西农业大学, 南昌 330045; 2.北京林业大学, 北京 100083)
昆虫的生殖与营养状况息息相关[1],卵巢作为雌虫繁衍的生殖器官,其发育调控关系昆虫的种群密度,解析卵巢发育过程中营养的积累过程,有助于探索针对害虫生殖进行防控的策略来控制害虫种群繁殖。昆虫卵母细胞内需要积累充足糖原、脂质和蛋白质,为胚胎发育提供能量和营养[2]。关于昆虫卵母细胞中蛋白质的积累研究已较为明确[3],雌性脂肪体内合成的卵黄原蛋白(vitellogenin, Vg)分泌到血淋巴后,通过卵黄原蛋白受体(vitellogenin receptor, VgR)介导的内吞作用,被发育的卵母细胞摄取[4-5]。然而脂质如何在卵母细胞中积累,尤其是脂类运输所依赖受体的转运过程尚不清楚。脂质占昆虫卵干重的30%~40%[6-7],昆虫利用脂肪酸合成甘油三酯(triacylglycerol, TAG),为昆虫胚胎发育提供主要的能量来源[8],但卵母细胞自身合成脂肪酸的能力非常有限,因此昆虫卵母细胞中积累的大部分脂质必须从其他组织摄取。在昆虫卵黄发生过程中,脂肪体中的脂类和卵黄蛋白前体依赖载脂蛋白(lipophorin, Lp)转运至卵巢组织[9],在部分昆虫中,Lp也同脂肪体合成的其他卵黄蛋白一起被卵巢吸收[10-12]。然而Lp完成脂质等物质的运输后,需要细胞表面的载脂蛋白受体(lipophorin receptor, LpR)通过内吞作用介导细胞对脂蛋白的摄取和代谢[9]。由此可见,LpR在脂类物质的转运途径中发挥重要作用。
LpR 是一种跨细胞膜的糖蛋白,属于低密度脂蛋白受体(low density lipoprotein receptor, LDLR)超家族,具有LDLR家族的保守结构域[5]:配体结合域(ligand binding domain, LBD)、表皮生长因子前体同源结构域(EGF-precursor homology domain)、O-糖链结构域(O-sugar linked domain)、跨膜结构域(transmembrane domain, TM)及胞质结构域(cytoplasmic domain)。最早从飞蝗Locustamigratoria中克隆获得昆虫的LpR基因,功能分析发现LpR充当 Lp 以内吞的形式进入细胞的受体蛋白[13]。随后在其他昆虫中陆续鉴定出LpR基因[14-16]。Lee等[17]在大蜡螟Galleriamellonella中发现20-羟基蜕皮酮(20E)和胆固醇均能诱导LpR的表达。Ciudad等[18]分别从德国小蠊Blattellagermanica的脂肪体和卵巢中鉴定出了L亚型和 S亚型的LpR,进一步分析表明不同亚型在卵黄发生期的表达模式存在差异,干扰LpR表达后卵母细胞中脂蛋白的含量显著降低。此外,Parra-Peralbo等在黑腹果蝇Drosophilamelanogaster中也鉴定到两种LpR基因,并发现其能够介导卵母细胞对中性脂质的摄取[19]。Lu 等[20]敲除褐飞虱Nilaparvatalugens的LpR基因导致褐飞虱体内TAG含量降低,卵巢发育受阻以及生殖力下降。Qiao等[21]对豌豆蚜AcyrthosiphonpisumLpR进行RNA干扰,导致其成虫生殖力显著下降。上述研究表明LpR对雌虫卵巢成熟至关重要。
棉铃虫Helicoverpaarmigera(Hübner)是我国重要的农业害虫,其雌成虫需要通过补充营养促使自身性成熟[22]。棉铃虫VgR调控卵母细胞对Vg的摄取,对卵子成熟和卵巢发育至关重要[23],幼虫面临饥饿胁迫会降低体内脂质和蛋白质的含量[24]。本文通过RT-PCR 和RACE技术克隆获得棉铃虫HaLpR基因,分析其序列特征,进一步通过qRT-PCR检测其在棉铃虫雌成虫卵巢发育期间的表达情况,分析了饥饿胁迫对载脂蛋白受体基因表达的影响。本研究有助于阐明载脂蛋白受体参与棉铃虫卵巢发育过程中的脂类转运及应对饥饿胁迫时的作用。
1 材料与方法
1.1 供试虫源
棉铃虫种群于2018年9月采自河北廊坊中国农业科学院廊坊中试基地。幼虫置于人工气候箱用人工饲料饲养[25]。培养条件为温度(27±2)℃,相对湿度(70±5)%,光周期 L∥D=14 h∥10 h。待其化蛹后,将雌雄蛹分开后分别置于养虫笼(长40 cm、宽26 cm、高21 cm)中饲养。成虫羽化后,饲喂10%蜂蜜水。
1.2 棉铃虫不同发育阶段和组织的样品准备
为了研究HaLpR在棉铃虫不同发育阶段的表达情况,分别收集卵约200粒、1龄幼虫50头、2龄幼虫10头、3龄幼虫5头、4龄幼虫3头、5龄幼虫3头、6 龄幼虫3头、蛹3头以及雌雄成虫各3头,设为1个生物学重复。另外,分别取羽化后1、2、3,4、5、7、8、9 d的雌成虫各2头,用于研究HaLpR在棉铃虫雌虫发育阶段的表达模式。取6头2日龄棉铃虫雌成虫,置于冰上解剖,分别收集头、表皮、马氏管、血淋巴、中肠、脂肪体和卵巢组织,用于分析HaLpR在棉铃虫雌虫不同组织的表达情况,除血淋巴外的各组织均用预冷的无菌水清洗,滤纸吸干多余水分,上述所有样品经液氮冷冻后迅速置于-80℃超低温冰箱保存。试验包含4个生物学重复。
选取刚羽化的棉铃虫雌成虫各20头,分别饲喂10%蜂蜜水和清水,设置为对照组和试验组,饲喂24、48、72 h后每个处理随机选取6头成虫,在冰上解剖收集其脂肪体和卵巢,用无菌水洗净,滤纸吸干多余水分,经过液氮冷冻后置于-80℃冰箱保存,用于分析饥饿处理后HaLpR基因的表达差异,试验包含4个生物学重复。
1.3 总RNA提取和cDNA合成
将棉铃虫样品置于预冷的研钵内,加入液氮研磨成粉末后迅速转移到1.5 mL的RNAase离心管中,然后采用TRIzol法提取总RNA,并使用超微量分光光度计和1%琼脂糖凝胶电泳检测RNA的纯度及完整性。取2 μg总RNA,使用PrimeScript RT Reagent Kit with gDNA Eraser(北京天根生物有限公司)合成第一链cDNA,保存于-20℃冰箱备用。RACE扩增所需cDNA模板使用SMARTer®RACE 5′/3′ Kit(宝日医生物技术有限公司)合成。
1.4 棉铃虫HaLpR基因的克隆
根据本实验室所测的棉铃虫转录组结果,搜索棉铃虫转录组数据获得载脂蛋白受体的基因片段,利用Premier 5.0软件设计特异性引物进行验证,然后设计5′ RACE和3′ RACE 引物(表1)通过Advantage®2 PCR Kit(宝日医生物技术有限公司)分别扩增获得3′端和5′端序列,具体操作按照试剂盒说明书进行。将PCR扩增片段切胶回收后,使用连接酶将其与pGM-T克隆载体(北京全式金生物技术有限公司)连接,转至大肠杆菌感受态细胞DH5α中,经过热激、复性、涂板及37℃过夜培养,挑选阳性菌落进行测序。然后将所得序列片段拼接得到cDNA全长序列。设计特异引物HaLpR-F 和HaLpR-R验证开放阅读框,PCR反应体系为cDNA模板1 μL,10 μmol/L上、下游引物各1 μL,PCR Master Mix 12.5 μL,ddH2O 9.5 μL。扩增条件:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,35个循环;72℃延伸5 min。

表1 本试验使用的引物序列
1.5 棉铃虫HaLpR序列分析及系统发育树的构建
利用ORF finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)查找完整的开放阅读框,并利用ExPASy网站translate tool(https:∥web.expasy.org/translate/)对HaLpR基因的ORF序列进行翻译,采用SignalP 4.1 软件(http:∥www.cbs.dtu.dk/services/SignalP-4.1/)和TMHMM-2.0(https:∥services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测信号肽和跨膜区,利用SMART软件(http:∥smart.embl-heidelberg.de/)进行结构域分析。根据翻译得到的氨基酸序列,运用NCBI的BLASTP工具搜索其他昆虫的LpR序列,根据搜索到的其他昆虫中同源性高的LpR氨基酸序列,利用ClustalX和Genedoc软件进行多重比较,使用MEGA 11软件采用邻位相接法(neighbor joining, NJ)构建系统发育树,进行1 000次重复构建。用于结构域分析及进化树构建的昆虫载脂蛋白基因及登录号见表2。
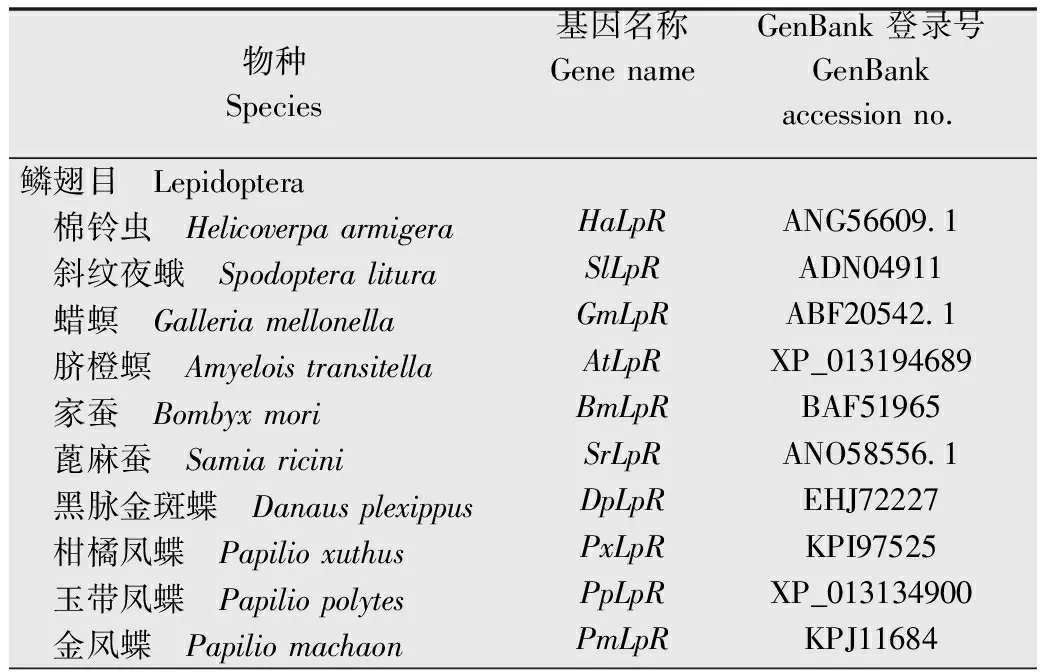
表2 构建进化树所使用的不同种类昆虫载脂蛋白受体基因及登录号
1.6 利用实时荧光定量qRT-PCR技术对HaLpR进行表达量分析
根据获得的棉铃虫HaLpR的cDNA序列,设计一对荧光定量引物q-HaLpR-F/R,以棉铃虫β-actin基因为内参基因(表1),进行扩增效率验证后,利用qRT-PCR检测HaLpR在棉铃虫不同发育阶段和不同组织的表达量。qRT-PCR采用SYBR Green 法,25 μL反应体系:2×qPCR Master Mix 12.5 μL,cDNA模板2 μL,10 μmol/L上、下游引物各1 μL,ddH2O 8.5 μL。反应在Bio-rad CFX96荧光定量PCR仪中进行,反应程序为:95℃预变性1 min;95℃变性5 s,60℃退火30 s,循环40次;熔解曲线95℃ 15 s,60℃ 15 s,95℃ 15 s。qRT-PCR结果用 2-△△Ct法进行分析[26]。
1.7 数据统计与分析
不同发育阶段和不同组织间的基因表达量差异显著性采用单因素方差分析(One-way ANOVA),并采用Fisher’s LSD检验进行多重比较(α=0.05)。对照组和饥饿处理组的基因表达量采用配对t-test法进行差异显著性分析。数据分析使用SPSS 17.0软件。
2 结果与分析
2.1 棉铃虫载脂蛋白受体基因基本特征
棉铃虫LpR基因命名为HaLpR(基因登录号KU355886.1),序列全长 3 117 bp,包含25 bp的5′非编码区和449 bp的3′非编码区,开放阅读框为2 643 bp,编码880个氨基酸。预测其蛋白质分子量为98.67 kD,等电点为5.01,预测其编码的蛋白质在N-末端含有1个信号肽,剪切位点位于第31和第32残基。氨基酸结构域分析发现HaLpR基因编码的蛋白包含典型的低密度脂蛋白受体结构域:8个富含半胱氨酸的配体结合域、3个表皮生长因子结构域、5个低密度脂蛋白受体YWTD结构域、1个跨膜域(795-817位氨基酸)以及一个网格蛋白包被的凹陷内化基序FDNPVY(832-837位氨基酸)。
2.2 棉铃虫载脂蛋白受体HaLpR序列相似性及系统进化树
棉铃虫HaLpR与其他昆虫LpR基因编码的氨基酸序列比对表明,LpR 氨基酸序列在不同物种间的保守性较高,都包含低密度脂蛋白受体配体结合域(LDLa)、表皮生长因子结构域(EGF)、低密度脂蛋白受体YWTD 结构域(LY)等结构域(图1)。棉铃虫的HaLpR与斜纹夜蛾Spodopteralitura的LpR氨基酸序列相似性为94.4%,与螟蛾科Pyralidae脐橙螟Amyeloistransitella和大蜡螟LpR的氨基酸序列相似度分别为88.7%和87.5%,与蚕蛾科Bombycidae家蚕、蓖麻蚕SamiariciniLpR的相似度分别为85.2%和87.8%,与黑脉金斑蝶Danausplexippus、玉带凤蝶Papiliopolytes、金凤蝶P.machaon和柑橘凤蝶P.xuthus等鳞翅目蝶类昆虫LpR的相似度在83.1%~85.5%之间,与其他非鳞翅目昆虫的氨基酸序列的相似性在59.5%~72.4%之间(图1)。

图1 棉铃虫及其他昆虫LpR氨基酸序列的结构分析与比较
进化树显示,棉铃虫HaLpR与斜纹夜蛾的LpR亲缘关系最近,与脐橙瞑、大蜡螟、家蚕、蓖麻蚕等昆虫LpR的亲缘关系较近,而与黑脉金斑蝶、玉带凤蝶及柑橘凤蝶等昆虫的亲缘关系较远。总体趋势是亲缘关系越近,同源性越高,与氨基酸序列比对结果一致(图2)。
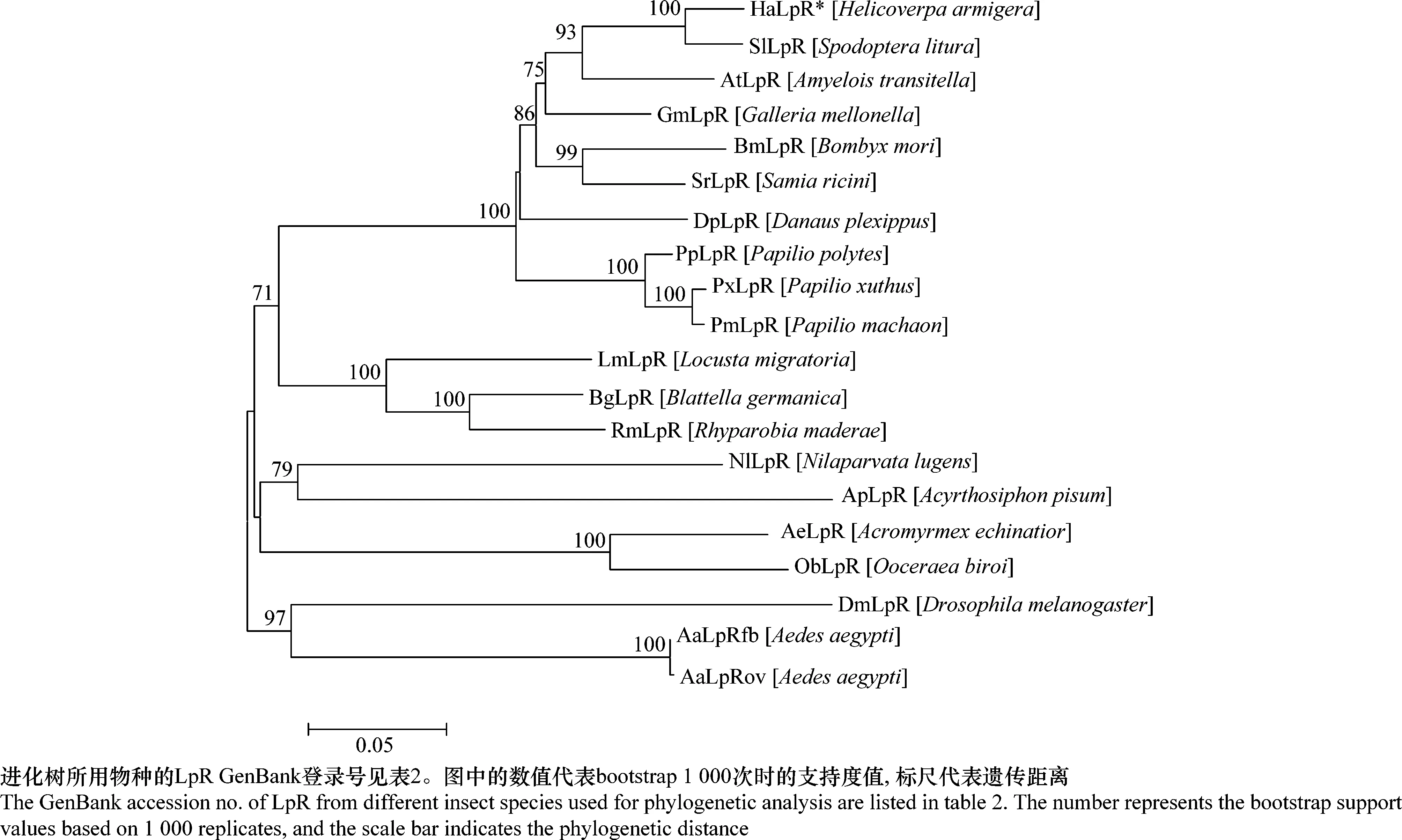
图2 不同昆虫物种LpR氨基酸序列的系统进化关系分析
2.3 HaLpR在棉铃虫不同发育时期和组织的表达
HaLpR在卵和雌成虫体内高表达,在幼虫和雄成虫体内表达量较低(图3a)。HaLpR在雌成虫各个日龄均有表达,表达量在雌成虫羽化后第3天到达高峰,随后逐渐降低,在羽化后第9天降到最低水平(图3b)。HaLpR在脂肪体和卵巢中高表达,在血淋巴中次之,而在中肠、表皮、马氏管和头部等组织中表达量较低(图3c)。
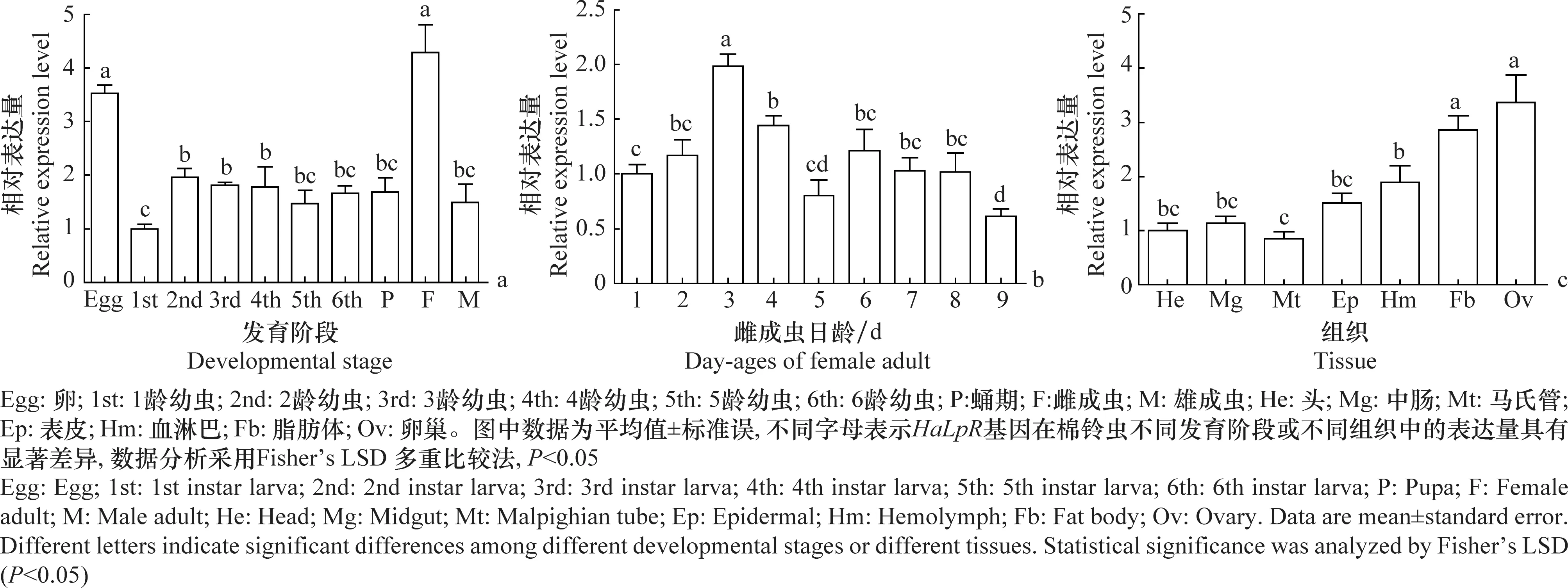
图3 HaLpR 在棉铃虫不同发育阶段(a)、雌虫不同日龄(b)及雌虫不同组织(c)的表达情况
2.4 饥饿处理对HaLpR表达的影响
棉铃虫雌成虫经饥饿处理后,卵巢和脂肪体中HaLpR基因的表达量都受到抑制。与饲喂10%蜂蜜水的对照组相比,饲喂清水的饥饿处理组卵巢中HaLpR的表达量整体呈现下降的趋势,24 h和48 h的表达量分别是对照组的115.3%和66.9%,而到72 h时其表达量显著低于对照组,仅为对照组表达量的41.9%(t=3.7,df=3,P=0.03)(图4a)。另一方面,饥饿处理降低HaLpR在脂肪体中的表达,在饥饿处理 24 h,其表达量是对照组的82.18%,差异不显著(t=1.16,df=3,P=0.33),在饥饿48 h和72 h后,其表达量分别是对照组的37.5%和24.8%,显著低于对照组(48 h:t=4.7,df=3,P=0.018;72 h:t=4.7,df=3,P=0.018)(图4b)。
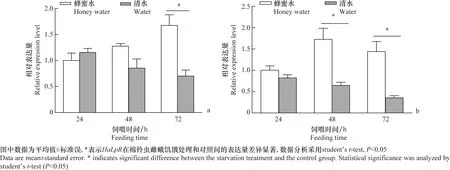
图4 饥饿对棉铃虫雌成虫卵巢(a)和脂肪体(b)组织中HaLpR 基因表达量的影响
3 结论与讨论
迁飞昆虫羽化时卵巢并未发育成熟,雌成虫通常需要补充包括糖、蛋白、脂肪等营养物质促进其卵巢发育及胚胎成熟[27]。昆虫卵母细胞中积累的蛋白质在脂肪体内合成后通过受体介导的内吞作用转运至卵母细胞,大量研究表明VgR是将 Vg 输送到生长中的卵母细胞的关键因子,对昆虫卵巢成熟起着重要的促进作用[3-5],除此之外,昆虫卵母细胞发育也需要积累脂类物质,而载脂蛋白受体LpR能与相应的载脂蛋白结合,以内吞作用介导细胞对脂质的摄取与代谢[8-9]。本研究通过RT-PCR与RACE技术克隆得到棉铃虫HaLpR的全长序列,发现其具有该基因家族的典型结构域(图1),通过对多种昆虫LpR氨基酸序列结构对比发现,不同物种在低密度脂蛋白受体配体结合域富含半胱氨酸的重复序列存在差异(图1),然而已有研究表明配体结合域LDLa的第6-8重复域在与配体结合时不发挥作用[28],因此我们推测不同昆虫的受体与配体结合力无差异。
HaLpR基因时空表达谱分析表明,HaLpR在棉铃虫雌成虫中高表达,推测LpR可能与棉铃虫雌虫的生殖行为相关,该推测与德国小蠊和褐飞虱的研究结果一致[18-20]。而豌豆蚜ApLpR在成虫体内的表达量低于幼虫,但在胚胎时期表达量显著高于其他龄期[21],同样的,HaLpR也在棉铃虫卵内高表达,这可能与脂质作为胚胎发育期的重要营养消耗物质相关。另外组织表达谱分析发现棉铃虫HaLpR在2日龄雌虫的脂肪体和卵巢内高表达,从侧面证实昆虫的LpR可能参与脂肪体和卵巢组织的脂质运输和摄取。类似表达模式在其他昆虫中也有报道,例如褐飞虱的NlLpR在脂肪体和卵巢内高表达,而在头部、表皮和中肠的表达量相对较低[20]。飞蝗的LmLpR-S在卵巢的表达量显著高于其他组织,而飞蝗中的另一个LpR亚型LmLpR-L除了在卵巢内高表达外,还在翅芽中高表达[29]。豌豆蚜的ApLpR在腹部角质层中高表达,并且通过RNAi 抑制ApLpR的表达会降低豌豆蚜表皮羟基化合物和内部碳氢化合物的含量,进而增加对干燥的敏感性[21]。另外,家蚕中的LpR-4亚型在其脑部及脑神经细胞中特异性地表达[16],果蝇的LpR-S亚型在幼虫的脑神经高表达,并与星形胶质细胞衍生的载脂蛋白相互作用,介导神经胶质细胞脂质穿梭[30]。由于基因的阶段性或者组织特异性表达往往与其在组织或者阶段的生命活动相关,这表明LpR除了参与成虫卵巢发育相关的脂质转运外,还参与了表皮层及神经细胞的脂质运输。
昆虫的繁殖力与成虫期的营养息息相关,饥饿处理显著降低成虫期有营养需求的昆虫的产卵量[31-33],卵母细胞内积累的脂类是维持胚胎发育的主要能量来源,在致倦库蚊Culexquinquefasciatus中发现卵母细胞发育所需的能量90%以上来自于脂类[34],果蝇中95%的脂类主要依靠血淋巴内的载脂蛋白转运[35]。甜菜夜蛾Spodopteraexigua经饥饿处理后体内脂肪含量显著降低[36],本研究通过实时荧光量PCR检测发现棉铃虫经饥饿处理后HaLpR基因无论在脂肪体还是卵巢组织内表达量都显著降低,这说明饥饿处理抑制了HaLpR的表达,我们推测饥饿处理导致昆虫产卵量降低可能跟载脂蛋白受体基因表达受到抑制有关。Lu等利用RNAi技术发现干扰NlLpR基因后褐飞虱体内的甘油三酯含量和Vg含量都显著降低,进而导致褐飞虱的产卵量和孵化率显著降低[20]。此外,沉默鱼虱Lepeophtheirussalmonis的LsLpR,其后代数量下降为对照组的25%[37]。然而在德国小蠊中,干扰LpR显著降低雌虫脂肪体内的脂质含量,但LpR干扰组和对照组的生殖力无明显差异[18]。然而在棉铃虫中,饥饿处理降低了雌虫的生殖力,但饥饿24、48、72 h后棉铃虫雌虫体内脂肪含量无显著变化(数据未发表),由于载脂蛋白与组织细胞之间的相互作用可能需要多种组分的参与,棉铃虫HaLpR对卵巢发育的具体影响仍需要RNAi或者基因编辑技术进一步研究。

