Harelish负向调控棉铃虫性信息素生物合成机制的初步研究
姚双艳, 张 耀, 杨 越, 舍泽龙, 王 焕, 卞会敏,吴雪明, 魏纪珍, 安世恒
(小麦玉米作物学国家重点实验室, 河南省害虫绿色防控国际联合实验室, 河南农业大学植物保护学院, 郑州 450002)
棉铃虫Helicoverpaarmigera属鳞翅目Lepidoptera夜蛾科Noctuidae,是重要的农业害虫,为害棉花、小麦、烟草、花生等多种作物,在世界范围内广泛分布[1-3]。长期以来,化学防治是防治棉铃虫的重要手段之一,可以在短时间内迅速且有效地控制棉铃虫种群数量,进而确保农作物产量[1]。但化学防治中产生的诸多问题,尤其是棉铃虫抗药性的快速发展,迫使研究者寻求更安全更有效的防治方法。随着转苏云金芽胞杆菌Bacillusthuringiensis(Bt)杀虫蛋白棉花的大面积种植,棉铃虫的为害再次得到了很好的控制[4]。但随着我国农业产业结构的调整,非转Bt作物上棉铃虫为害更加猖獗[5]。同时,在转Bt基因作物持续的高压选择下,棉铃虫对Bt蛋白的抗性也逐渐凸显[4]。因此,从多维度研究和探索棉铃虫的防治方法势在必行。
棉铃虫除寄主广、迁移能力强、环境适应能力强等特点外,巨大的繁殖潜能也是其暴发成灾、连年猖獗的重要原因。性信息素是昆虫交配繁殖的关键化学信号[6]。在蛾类中,主要是由雌蛾释放性信息素吸引雄蛾前来交配[7]。因此,干扰雌蛾的性信息素生物合成可以有效影响雌雄蛾的交配,进而降低后代种群数目,最终达到防治害虫的目的。所以,探索和开发影响棉铃虫性信息素生物合成的相关基因对其防治具有重要意义。
NF-κB是广泛存在于脊椎动物和无脊椎动物中,特异性结合免疫球蛋白,进而促进免疫相关基因表达的细胞核转录因子[8-9]。大量研究表明,NF-κB广泛参与多细胞动物的免疫应答、炎症反应、细胞凋亡和生长发育[9-10]。NF-κB家族主要包括Relish、Dorsal和Dif3个成员,这些基因在进化过程中高度保守[11]。由于获得性免疫系统的缺失,在长期的进化过程中无脊椎动物进化出一套复杂而高效的免疫体系[12]。在黑腹果蝇Drosophilamelanogaster中,Relish不仅通过免疫缺陷(immunodeficiency,IMD)信号通路介导抗革兰氏阴性菌的免疫过程[13];还可以通过靶向转化生长因子-β-活化激酶1(transforming growth factor-β-activating kinase 1,TAK1)调控c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)介导的免疫反应[14];在斜纹夜蛾Spodopteralitura中也证实了IMD通路下游的Relish参与调控大肠杆菌(革兰氏阴性菌)引起的斜纹夜蛾的免疫反应[15];在柞蚕Antheraeapernyi中,Relish通过调控自噬相关基因5(autophagy-related gene 5,ATG5)的活性进而调控其先天性免疫[11]。在甲壳动物三疣梭子蟹Portunustrituberculatus等和节肢动物中国明对虾Fenneropenaeuschinensis、罗氏沼虾Macrobrachiumrosenbergii等物种也证实Relish参与其免疫过程[16-19]。
目前对Relish的研究多集中于其在先天性免疫应答中的作用,在蛾类性信息素生物合成中的功能未见报道。本研究对Harelish在性信息素生物合成中的功能进行研究,分析了Harelish对棉铃虫性信息素生物合成关键酶钙调磷酸酶(CaN)活性和性信息素含量的影响,以期为通过性信息素生物合成通路进行防虫控虫提供重要信息。
1 材料与方法
1.1 供试昆虫饲养
棉铃虫卵购自河南省济源白云实业有限公司,在室内以人工饲料于人工气候箱[温度(26±1)℃,相对湿度(75±1)%,光周期L∥D=14 h∥10 h]中饲养多代[20-21]。
1.2 时空表达样品准备
不同组织样品准备:解剖羽化后48 h的棉铃虫雌蛾,分别取中肠(midgut,MG)、表皮(epidermis,EP)、脑(brain,Br)、触角(antennae,Ant)、脂肪体(fat body,FB)、肌肉(muscle,MS)和性信息素腺体(sex pheromone gland,PG)等组织,用TRIzol试剂(Invitrogen,美国)提取其RNA并反转录为cDNA,用于后续荧光定量检测。
不同时期样品准备:解剖分离不同时期,即羽化前72 h(标记为-72 h)、羽化前48 h(标记为-48 h)、羽化前24 h(标记为-24 h),新羽化(标记为0 h)、羽化后24 h(标记为24 h)、羽化后48 h(标记为48 h)和羽化后72 h(标记为72 h)的性信息素腺体,以解剖镊在显微镜下处理干净后,用TRIzol试剂提取其RNA并反转录为cDNA,用于后续荧光定量检测。
1.3 dsRNA体外合成和RNAi
按照T7 RNAi Transcription试剂盒(TR102)(诺唯赞,中国)说明书体外合成dsRNA。首先,以性信息素腺体cDNA和包含T7启动子的特异性引物(表1)进行PCR扩增,纯化PCR产物作为后续合成dsRNA的模板。取纯化PCR产物1 μg,加入NTP Mix 8 μL,10× Transcription Buffer 2 μL 和T7 Enzyme Mix 2 μL,以RNase-free H2O补足20 μL后放入PCR仪中37℃反应2 h,以合成dsRNA。琼脂糖凝胶电泳检测合成的dsRNA质量,然后用酚/氯仿对该产物进行抽提纯化,并用Nanodrop 2000紫外微量分光光度计(Thermo Fisher Scientific,美国)测定dsHarelish的浓度。以合成的增强绿色荧光蛋白基因(enhanced green fluorescent protein gene, EGFP)的dsRNA作为对照。

表1 本试验所用的引物
将新羽化的棉铃虫雌蛾头部剪除,并置于室温24 h。将体外合成的dsHarelish以10 μg/头的量注射入预处理的雌蛾体内,置于室温24 h后取其性信息素腺体,-20℃保存,用于后续荧光定量检测、GC-MS和酶活测定。以注射dsEGFP的雌蛾作为对照。每处理注射15头,3次重复。
1.4 荧光定量PCR检测
使用TRIzol试剂提取样品总RNA,并通过Nanodrop2000紫外微量分光光度计和琼脂糖凝胶电泳检测其浓度和质量。采用HiScript Ⅲ RT SuperMix试剂盒(诺唯赞,中国)合成cDNA,作为荧光定量PCR的模板。采用Actin(ACT)和Elongation factor 1 alpha(EF-1α)作为内参基因,在ABI 7500 PCR仪器上使用ChamQ Universal SYBR qPCR Master Mix(诺唯赞,中国)对Harelish的相对表达量进行实时荧光定量PCR检测。荧光定量PCR反应程序为:95℃预变性5 min;95℃变性15 s和60℃延伸20 s,循环40次。采用双内参法对Harelish基因的相对表达量进行量化[22]。
1.5 性信息素Z11-16∶Ald含量检测
处理组和对照组分别注射dsHarelish和dsEGFP后继续培养24 h,再依次按照10 pmol/头的量注射体外合成的具有活性的性信息素合成激活肽(pheromone biosynthetic activating neuropeptide,PBAN)溶液,并于28℃培养1 h,取性信息素腺体置于200 μL正己烷中。将萃取后的正己烷样品上机(安捷伦7890B),参照Yao等的方法设定检测程序[23],快速升温至60℃保持2 min,然后以5℃/min升温至230℃,在此期间性信息素组分全部洗脱;随后以20℃/min的速度将柱子(安捷伦HP-5MS)加热至245℃,并在此温度下保持15 min;最后将氢火焰离子检测器(FID检测器)保持在250℃,对样品组分进行检测。采用面积归一法对性信息素主要组分Z11-16∶Ald的含量进行量化。进行3个生物学重复,每个生物学重复的样品由15头性信息素腺体组成。
1.6 CaN酶活测定
断头处理的雌蛾按10 μg/头分别注射dsHarelish和dsEGFP,室温继续饲养24 h。解剖性信息素腺体,置于昆虫细胞培养液(Grace’s Insect Cell Culture Medium)中,用PBAN(10 pmol/L)孵育30 min后将性信息素腺体收集到1.5 mL的离心管中进行研磨和离心,上清分为两份置于冰上。取其中一份,以蛋白定量测定试剂盒(南京建成,中国)测定其蛋白浓度;另一份则按照钙调磷酸酶(CaN)检测试剂盒(南京建成,中国)说明书和Du等[6]的方法进行CaN活性检测。进行3个生物学重复,每个重复包含40头性信息素腺体样品。
1.7 数据处理
本研究中,所有试验均进行3次生物学重复,数据采用Microsoft Excel 2010整理,统计结果后使用GraphPad Prism 8.3.0绘制柱状图。不同时期和不同组织中Harelish的表达量差异采用Tukey’s test进行多重比较(α=0.05, DPS 7.05)。Harelish基因的RNAi效果及后续的性信息素含量和CaN活性检测均以IBM SPSS Statistics 23中的Student’st测验分析数据之间的差异显著性。
2 结果与分析
2.1 不同组织中Harelish表达量分析
实时荧光定量qRT-PCR检测结果显示,Harelish基因在棉铃虫雌蛾中肠、表皮、脑、触角、脂肪体、肌肉和性信息素腺体中均有表达,在触角中表达量最高,肌肉组织中表达量最低,在性信息素腺体中具有较高的表达量(图1)。

图1 棉铃虫雌蛾不同组织Harelish基因的表达量
2.2 不同发育时期Harelish表达量分析
对Harelish基因在棉铃虫性信息素腺体不同发育时期的相对表达量进行分析,结果显示Harelish在羽化前72 h和羽化前48 h具有较高的表达量,在羽化前24 h表达量最低,之后,随着性信息素腺体发育成熟以及羽化后性信息素的释放,Harelish的表达量不断升高,在羽化后24 h达到最高(图2)。

图2 不同发育时间性信息素腺体中Harelish基因的表达量
2.3 对Harelish的干扰效果
将体外合成的EGFP和Harelish的dsRNA注射入新羽化并断头的棉铃虫雌蛾体内,以qRT-PCR检测RNAi效果。结果显示,与注射dsEGFP的对照相比,注射dsHarelish显著降低Harelish的相对表达量约54%(图3)。

图3 RNAi诱导的Harelish基因在性信息素腺体中的干涉效果
2.4 Harelish对性信息素生物合成量的影响
确认体外合成的dsRNA具有良好的RNAi效果后,进一步以GC-MS检测Harelish转录水平的降低对棉铃虫性信息素Z11-16∶Ald含量的影响。结果显示,Harelish转录水平降低后,Z11-16∶Ald相对含量也显著上调约56%(图4)。
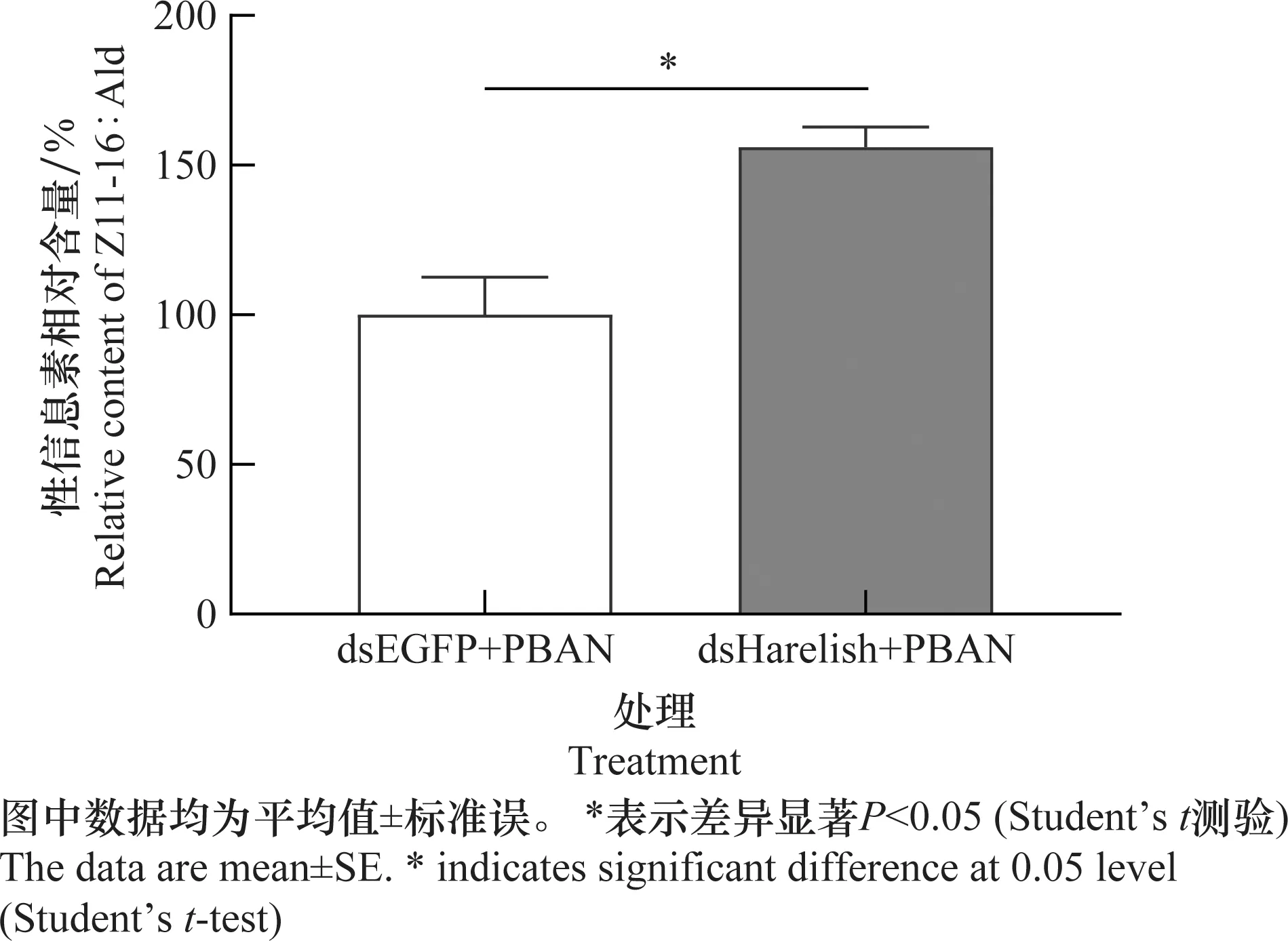
图4 RNAi诱导的Harelish基因沉默对性信息素生物合成的影响
2.5 Harelish对CaN活性的影响
对dsEGFP和dsHarelish处理后棉铃虫雌蛾性信息素腺体中的CaN活性进行检测。结果显示,与对照组相比,Harelish转录水平的降低可以引起CaN活性的显著上调(图5)。
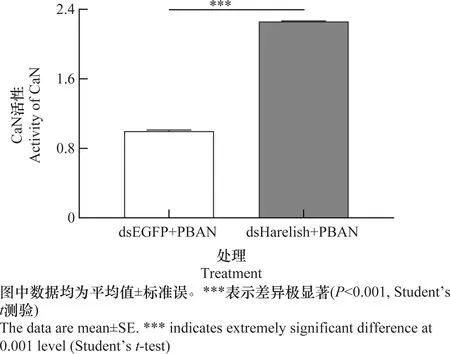
图5 RNAi诱导的Harelish基因沉默对CaN活性的影响
3 结论与讨论
通过分析Harelish基因在棉铃虫雌蛾不同组织中的表达量,发现其在棉铃虫雌蛾中肠、表皮、脑、触角、脂肪体、肌肉和性信息素腺体等7个组织中均有表达,但表达量有所差异。该结果与斜纹夜蛾、三疣梭子蟹、中国明对虾、罗氏沼虾等物种中的研究结果相似[16-19],均表明了该基因在不同组织中的普遍表达。Relish是NF-κB家族的重要成员,参与了斜纹夜蛾、黑腹果蝇、柞蚕等昆虫的IMD免疫信号通路[11, 13, 15]。脂肪体是昆虫重要的免疫组织,Harelish基因在脂肪体中具有较高表达量说明该基因参与了棉铃虫的免疫反应,该结果同家蚕Bombyxmori、斜纹夜蛾中的研究结果一致[15, 24]。尽管Harelish基因在各个组织或器官中均广泛存在,但目前关于该基因的研究则集中于其参与生物体的免疫过程,对该基因在其他组织中的功能鲜有研究。该基因在棉铃虫雌蛾性信息素腺体中具有较高的表达量,表明其在性信息素腺体中可能行使特定的生物学功能。
NF-κB家族是一种具有多种生理功能的转录因子,除参与机体的免疫反应和炎症反应外,还参与了细胞的分化、增殖和凋亡等有关基因的转录[25]。昆虫蛹期时其内部进行着剧烈的组织解离和组织发生的生理活动,这也和本研究中Harelish基因在蛹期具有较高的表达量相一致。随着成虫羽化后,其表达量逐渐升高,在24 h达到最高,48 h和72 h亦具有较高表达量。在家蚕、棉铃虫、亚洲玉米螟、黏虫Mythimnaseparata、斜纹夜蛾等鳞翅目蛾类中,雌蛾羽化后其性信息素开始合成和释放,但是性信息素释放的模式却不尽相同[6, 23, 25-26]。其中家蚕羽化后立即释放性信息素[26-27],斜纹夜蛾在羽化后第1个暗夜其性信息素释放达到高峰[27],棉铃虫和亚洲玉米螟在羽化后3 d均大量释放性信息素,在第2个暗夜其性信息素释放和交配率均达到高峰[6, 23]。Harelish基因在不同发育时期的表达模式与其性信息素释放模式相一致。同时,棉铃虫、家蚕和亚洲玉米螟性信息素合成相关基因PBANR、CaN、ACC、去饱和酶、FAR等均具有相似的表达模式[6, 23, 27]。最后,基于RNAi诱导的Harelish基因沉默对性信息素含量的影响,进一步证实了Harelish基因参与了棉铃虫性信息素生物合成。
在家蚕、棉铃虫、亚洲玉米螟等蛾类性信息素生物合成的研究中,PBANR、CaN、ACC、去饱和酶、FAR等基因转录水平下降引起雌蛾性信息素含量下降,即这些基因正向调控了蛾类性信息素的生物合成[6, 23, 27]。而在本研究中,Harelish基因转录水平降低时,其性信息素含量上升。该结果意味着Harelish基因负向调控了棉铃虫的性信息素生物合成,这也是鳞翅目蛾类性信息素生物合成中首次关于抑制因子的研究。
在棉铃虫中,其性信息素的生物合成通路已进行了明确而详尽的阐述。主要的通路为:CaN由相应的第二信使Ca2+激活后,通过激活下游信号乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC),进而调控了其性信息素的生物合成过程[6]。同时CaN也被证实参与了家蚕、美洲棉铃虫Helicoverpazea、黏虫、亚洲玉米螟等多种蛾类的性信息素生物合成[6, 23, 27]。本研究中,Harelish基因转录水平降低时,CaN活性升高。该结果与性信息素检测结果一致,即Harelish基因通过抑制性信息素生物合成关键酶CaN,进而抑制了棉铃虫性信息素的生物合成。但是Harelish基因如何调控CaN还需要进一步研究。

