棉铃虫5-HT1和5-HT2基因的克隆及表达模式分析
王惠鑫, 陈淑婷, 王 凯, 郜晓妍, 谢桂英, 陈文波, 赵新成
(河南省害虫绿色防控国际联合实验室, 河南农业大学植物保护学院, 郑州 450002)
5-羟色胺(5-hydroxytryptamine,5-HT)是生物体内一种重要的生物胺类,其作为神经递质控制和调节生物体的多种重要生理活动[1-3]。研究表明,5-HT参与调控果蝇Drosophila和双斑蟋蟀Gryllusbimaculatus的攻击行为、睡眠和昼夜节律[4-7],参与果蝇和意大利蜜蜂Apismellifera的取食、学习和记忆等生理功能[8-12]。5-HT主要通过作用于特异性的G蛋白偶联受体(G protein-coupled receptors,GPCRs)发挥相应的生理功能[3]。因此,昆虫5-HT受体被人们视为潜在的新型杀虫剂的作用靶标,尽管目前还没有针对5-HT受体杀虫剂的应用,但科研人员已对该类受体能否成为新型杀虫剂的靶标进行了探索。如利用遗传和药理学试验证明,5-HT受体非选择性拮抗剂metitepine可抑制果蝇5-HT2A,从而影响其取食活动[11]。Cai等[13]以捻转血矛线虫Haemonchuscontortus5-HT受体的配体PAPP为先导化合物进行结构优化来开发新型分子农药,共筛选出23个对黏虫Mythimnaseparata具有抑制生长或是杀虫活性的化合物。
目前在昆虫体内克隆鉴定到的5-HT受体并不多,且都属于GPCRs[3]。根据氨基酸同源性及其偶联介导的第二信号通路,昆虫5-HT受体主要包括5-HT1、5-HT2和5-HT7受体类型[3]。在大多数昆虫体内各鉴定到2种5-HT1(5-HT1A和5-HT1B)和2种5-HT2(5-HT2A和5-HT2B)亚型,及1种5-HT7受体型[3,14-16]。另在菜粉蝶Pierisrapae体内除鉴定到已知的5种5-HT受体外,还新鉴定到一种与脊椎动物没有同源性的新型5-HT8 受体[17]。对昆虫5-HT受体介导的生理功能研究表明,菜粉蝶5-HT1B和5-HT2B介导了血细胞的吞噬作用,可调控其免疫功能[18];果蝇5-HT1B参与调控对光的节律反应;埃及伊蚊Aedesaegypti5-HT2B参与成蚊脂质积累及生长发育[19];果蝇5-HT7受体在其正常求偶与交配行为中扮演了重要角色[20];果蝇和家蚕Bombyxmori5-HT1A参与调控运动能力[21-22]。尽管5-HT及其受体在昆虫生理活动中扮演了重要角色,但目前并没有作用于5-HT受体靶标的杀虫剂问世。鉴于5-HT系统在调控昆虫各种生理活动及行为方面的重要性,基于该类受体靶标的新型杀虫剂亟待研发。
棉铃虫Helicoverpaarmigera是世界上重要的农作物害虫之一,可为害多种作物。在我国,种植转 Bt棉及施用化学农药是主要的防控措施。然而,棉铃虫对传统化学农药抗药性增加及我国20多年种植单一类型Bt棉导致棉铃虫种群内抗性基因频率增加,使得近年来棉铃虫发生为害有增加的趋势[23]。因此,寻找新型作用靶标基因及开发新型靶标位点杀虫剂显得尤为紧迫。本研究基于转录组数据结合RT-PCR克隆获得了棉铃虫5-HT1和5-HT2基因,采用多序列比对及系统进化树构建对5-HT受体基因进行了分析,最后利用实时荧光定量PCR(real time quantitative PCR,RT-qPCR)对5-HT受体基因在棉铃虫幼虫及成虫不同组织的表达模式进行分析,旨在为探究棉铃虫5-HT受体功能及探索其作为新型杀虫剂靶标位点的潜能奠定基础。
1 材料与方法
1.1 供试昆虫
棉铃虫于2018年采自河南省新乡市郊区棉田,置于室内人工气候箱内饲养,培养条件为25~28℃,相对湿度70%~80%,光周期为L∥D=14 h∥10 h。幼虫人工饲料配方及饲养方法参照梁革梅等[24]的方法进行。幼虫化蛹后,将雌雄蛹分开置于养虫笼中,成虫羽化后,给予10%蔗糖水补充营养。
1.2 棉铃虫总RNA提取与cDNA合成
采用TRIzol(美国Invitrogen公司)法提取棉铃虫幼虫各个组织(头、肠、上表皮、脂肪体和马氏管)及雌雄成虫各个组织(脑、触角、腹部、翅和足)的RNA。用NanoDrop 2000超微量分光光度计(Thermo Fisher Scientific,MA,USA)检测RNA浓度,并利用1%琼脂糖凝胶电泳检测RNA质量。利用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa,大连,中国)反转录为cDNA,-20℃保存备用。
1.3 棉铃虫脑转录组测序和5-HT受体基因鉴定
浓度和纯度检验合格的棉铃虫成虫脑RNA(棉铃虫雌雄成虫各100头,使用镊子打开其头壳取出脑,提取脑RNA)送南京派森诺基因科技有限公司构建cDNA文库,由该公司采用Illumina HiSeqTM2500平台进行高通量测序获取原始reads,去冗余获得clean reads,进一步利用Trinity软件对获取的clean reads进行拼接。
在NCBI数据库中对已知鳞翅目昆虫的5-HT受体基因序列进行比对,构建本地数据库,利用tBLASTn筛选棉铃虫脑转录组中的5-HT1和5-HT2序列。对筛选到的序列进行人工校正。
1.4 基因克隆
根据棉铃虫脑转录组数据分析获得5-HT受体基因,利用Primer Premier 5.0软件设计引物(表1),并由生工生物工程(上海)股份有限公司合成。以成虫cDNA为模板进行RT-PCR反应。50 μL反应体系:2×Phanta Max Buffer 25 μL、ddH2O 17 μL、10 μmol/L上、下游引物各2 μL、dNTP Mix 1 μL、Phanta Max Super-Fidelity DNA Polymerase 1 μL、cDNA模板 2 μL。反应条件:95℃预变性3 min;95℃变性15 s,退火温度(表1)退火15 s,72℃延伸3 min,40个循环;72℃再延伸5 min。PCR扩增产物利用1.2%琼脂糖凝胶进行电泳检测,进行切胶回收与纯化,将回收产物连接到pMD-19T克隆载体上,转化至DH5α感受态细胞,并将经菌液PCR鉴定为阳性的克隆送至生工生物工程(上海)股份有限公司测序。

表1 本研究中所用引物
1.5 棉铃虫5-HT1和5-HT2基因序列分析与系统进化树构建
使用ORF finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)对棉铃虫5-HT1和5-HT2进行开放阅读框预测。利用TMHMM 2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/)对受体跨膜区域进行预测。使用ClustalX对棉铃虫5-HT受体和其他昆虫的5-HT受体进行序列比对。利用MEGA 7.0软件进行系统进化树的构建。进化树基于最大似然法原理,采用Bootstrap法进行1 000次循环检验。在系统进化树分析中以家蚕和果蝇的神经肽FMRF-amide受体作为外群。
1.6 实时荧光定量PCR
采用SYBR Green I实时荧光定量PCR在StepOne Plus实时荧光定量PCR仪(ABI,USA)上检测5-HT1和5-HT2在棉铃虫幼虫和成虫不同组织中的相对表达水平。取20头5龄棉铃虫幼虫,于Ringer’s溶液中解剖获得头、肠、上表皮、脂肪体和马氏管组织。取3日龄未交配雌雄成虫各30头,用镊子打开头壳取出脑,解剖剪截取触角、腹部、翅和足。均设3次生物学重复,获取组织液氮冷冻后保存于-80℃冰箱,RNA提取和cDNA合成参照1.2。RT-qPCR反应体系为25 μL:2×SYBR Premix ExTaq12.5 μL,cDNA模板2 μL,10 μmol/L上、下游引物各0.5 μL,ddH2O 9.5 μL。反应程序:95℃预变性3 min,95℃ 5 s,60℃ 30 s,40个循环。采用2-△△Ct法计算基因在不同组织间的相对表达量[25]。以棉铃虫β-actin基因(GenBank登录号:HM629442.1)作为内参对照。
1.7 数据统计与分析
棉铃虫5-HT1和5-HT2在幼虫和成虫不同组织的相对表达量在DPS 7.05统计软件中进行One-way ANOVA方差分析,多重比较采用Tukey’s HSD法,雌雄成虫相同组织基因相对表达量进行Studentt测验,差异显著性检验水平为α=0.05。
2 结果与分析
2.1 棉铃虫5-HT1和5-HT2基因的鉴定与序列验证
棉铃虫脑转录组测序后清除带接头和低质量序列共获得雌脑45 981 772条和雄脑45 003 444条clean reads,序列经过组装后获得37 174条 unigenes,平均长1 082 bp,N50和N90值分别为1 903 bp和413 bp。
在棉铃虫脑转录组(未发表数据)中共鉴定到2个5-HT1和2个5-HT2亚型受体基因。根据同源序列比对将其命名为5-HT1A、5-HT1B、5-HT2A和5-HT2B(GenBank登录号为ON921708~ON921711)。其开放阅读框全长分别为1 401,1 347,1 917 bp和1 899 bp,分别编码466,448,638和632个氨基酸,预测分子量分别为51.90,48.79,70.74 kD和69.92 kD,氨基酸序列都包含有7个跨膜区域,属于典型的G蛋白偶联受体。4个基因经PCR扩增后,电泳显示在约1 400 bp和1 900 bp位置各出现明亮的扩增条带,与预期扩增片段大小一致(图1),测序结果与转录组的序列相同。

图1 棉铃虫5-HT1和5-HT2基因扩增产物电泳图
2.2 氨基酸序列相似性及进化树分析
4种棉铃虫5-HT受体间氨基酸序列相似性较低,仅有约18%~48%。而同一类型受体与其他鳞翅目昆虫该类受体氨基酸序列相似性高于75%,与赤拟谷盗Triboliumcastaneum、意大利蜜蜂和果蝇的5-HT受体氨基酸序列相似性分别为50%、45%和35%左右。尽管与非鳞翅目5-HT受体氨基酸序列相似性较低,但是该类受体所具有的一些保守序列在同类受体氨基酸系列中具有高度保守性,如位于胞内第二loop环N端的三联D-R-Y模体,位于第6跨膜区的共有序列FxxxWxP及其紧邻的一对苯丙氨酸残基,一个位于第3跨膜区高度保守的天冬氨酸残基等,这些保守区域被认为可能参与了受体的激活及配体的结合[16,26-28](图2,图3)。

图2 棉铃虫与其他昆虫5-HT1亚型受体氨基酸序列比对

图3 棉铃虫与其他昆虫5-HT2亚型受体氨基酸序列比对
系统进化树分析结果表明,不同家族的5-HT受体各自聚为一支,形成了3个分支;而5-HT1和5-HT2家族可明显分别分成两个亚家族,每个亚家族分支中鳞翅目昆虫优先聚为一类,与果蝇,意大利蜜蜂和赤拟谷盗进化关系较远;棉铃虫5-HT受体与家蚕和烟草天蛾Manducasexta5-HT受体有较近的进化关系(图4)。
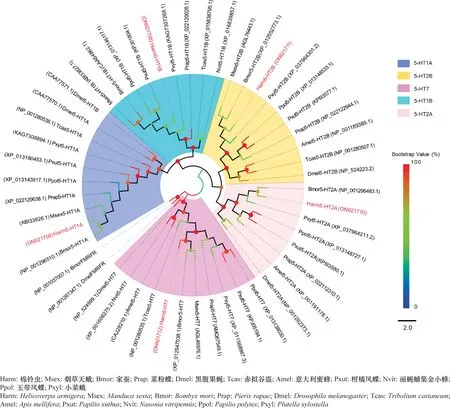
图4 基于棉铃虫5-HT受体氨基酸序列采用最大似然法构建的系统进化树
2.3 5-HT1和5-HT2基因在幼虫不同组织中的差异表达
5-HT1A在幼虫时期显著、特异性地在头部和上表皮组织高表达,而在肠道、脂肪体和马氏管组织中几乎不表达(图5a)。5-HT1B在棉铃虫幼虫头部高表达,其次是马氏管,前者比后者高2.2倍,而在肠道、脂肪体和上表皮组织低表达(图5b)。5-HT2A和5-HT2B在幼虫头部表达量显著高于其他组织(图5c,5d)。
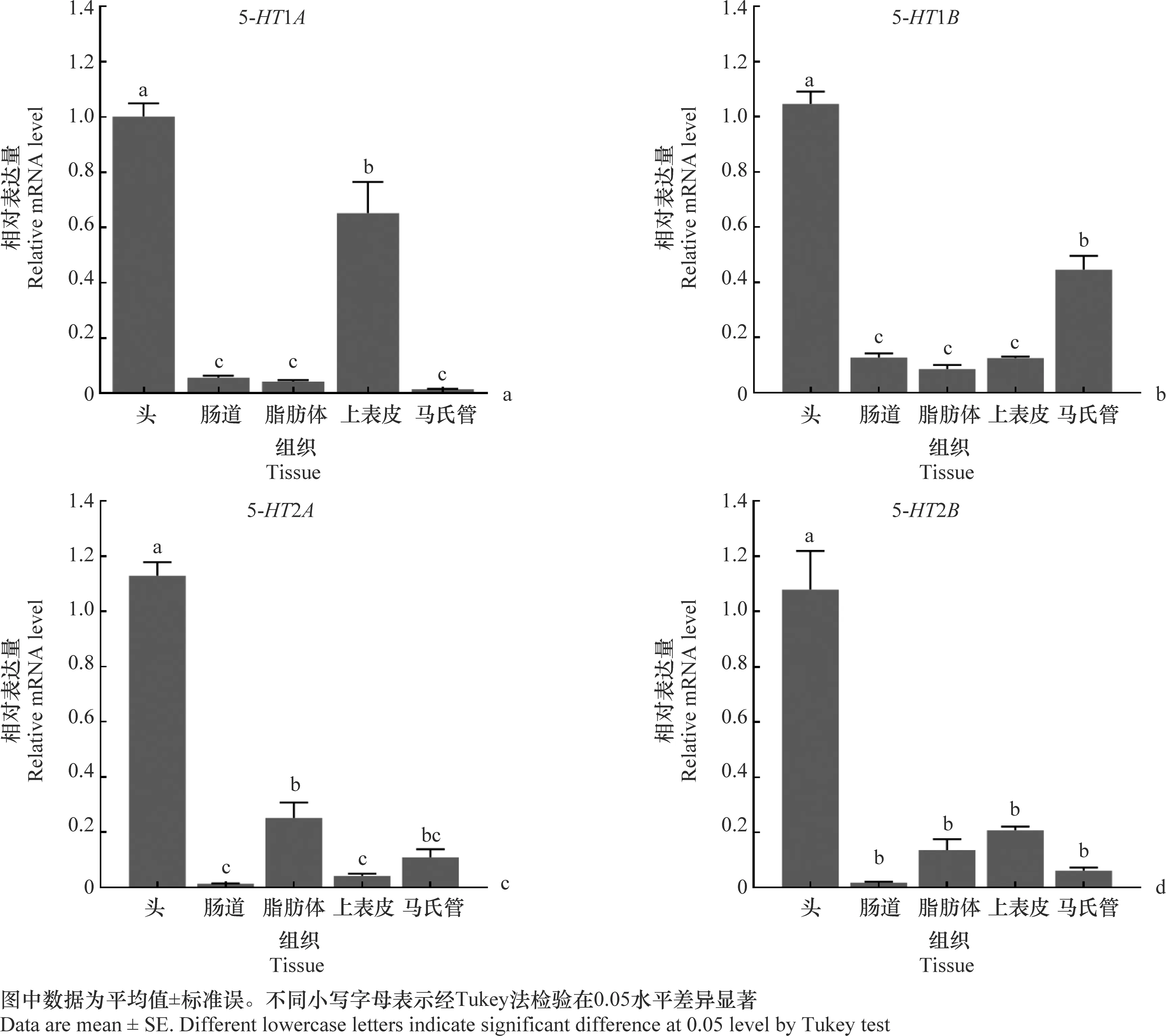
图5 5-HT1和5-HT2基因在棉铃虫幼虫不同组织的表达量
2.4 5-HT1和5-HT2基因在雌雄成虫不同组织的差异表达
5-HT1A在棉铃虫脑和触角高表达,且在雄虫脑表达水平显著高于雌虫脑,在雌虫触角和腹部的表达量显著高于在雄虫(图6a)。5-HT1B在雌雄成虫脑和雄虫腹部高表达,且在雄虫腹部和翅的表达量显著高于雌虫,而在雌虫触角的表达量显著高于雄虫(图6b)。5-HT2A在雌雄成虫触角显著高表达,在雌虫触角中的表达量是脑中表达量的4.4倍,在雄虫触角中的表达量是脑中表达量的5.8倍,且其在翅和足表达量具有性别差异(图6c)。5-HT2B在雌虫腹部显著高表达,是其在雄虫腹部表达量的6.8倍,而其在雄虫脑部表达量是雌虫脑部表达量的3.4倍(图6d)。

图6 5-HT1和5-HT2基因在棉铃虫成虫不同组织的表达量
3 结论与讨论
截至目前,在昆虫体内鉴定到的5-HT受体都属于GPCRs[3]。本研究中,通过转录组数据结合RT-PCR技术各鉴定克隆到2类棉铃虫5-HT受体基因,5-HT1和5-HT2(5-HT1A,5-HT1B,5-HT2A和5-HT2B),它们都具有7次跨膜结构域,属于典型的GPCRs。其保守氨基酸序列内同样具有生物胺受体保守的三联D-R-Y和FxxxWxP等特征序列,同源性比较结果显示,棉铃虫5-HT1和5-HT2氨基酸序列与家蚕和烟草天蛾亲缘关系更近。
大量行为试验表明,组织特异性表达的基因所行使的功能常与该组织发挥的生理功能相关。昆虫5-HT受体在脑及腹神经索高表达,进一步证实5-HT受体在昆虫中枢神经系统中起到重要的神经信号调节作用[3,28-29]。如5-HT1A受体在意大利蜜蜂脑内参与视觉信息处理的部位高表达,进一步通过行为试验证实5-HT1A受体参与调控意大利蜜蜂对光反应过程[30]。果蝇5-HT1A、5-HT2A和5-HT7受体在成虫头部表达,其主要参与果蝇的学习和记忆过程[31];在幼虫期,这些受体参与了嗅觉行为选择和嗅觉学习及记忆等[32]。对小菜蛾Plutellaxylostella和埃及伊蚊5-HT受体组织表达研究表明,5-HT受体基因在成虫期的表达量显著高于幼虫期,并且5-HT受体基因在雌雄成虫体内的表达量具有显著的性别差异,在雄成虫的表达量显著高于雌成虫[29,33]。
本研究发现, 5-HT1B和5-HT2B在棉铃虫成虫脑的表达量约是幼虫头部表达量的100倍,5-HT2A在成虫触角的表达量约是幼虫头部表达量的100倍,推测此3类受体主要在棉铃虫成虫期发挥重要生理功能。5-HT1A在成虫脑的表达量约是幼虫头部表达量的4倍,远远低于以上3类基因在成虫与幼虫间的表达差异。有研究表明5-HT1A参与调控家蚕成虫和幼虫的运动能力[22]。据此推测棉铃虫5-HT1A在成虫和幼虫期可能发挥类似的功能,因此其在成虫和幼虫期都需大量表达。4种棉铃虫5-HT受体基因都在幼虫期头部显著高表达,推测这4种5-HT受体在幼虫期可能主要参与中枢神经系统的调控。5-HT1A和5-HT1B分别在棉铃虫幼虫期的上皮组织和马氏管的表达量仅次于在头部表达量,推测这两种受体可能在表皮形成、幼虫运动及代谢物吸收和排泄等活动中发挥功能。5-HT1A、5-HT1B和5-HT2B在棉铃虫雌雄成虫的脑、触角或腹部表达具有性别差异,推测这些受体可能参与到特定的性行为中(嗅觉识别及生殖发育等)。5-HT1A和5-HT2B在棉铃虫雌成虫腹部表达量显著高于雄成虫,5-HT1B在雄成虫腹部表达量显著高于雌成虫,推测该类受体可能在雌雄生殖系统中发挥重要作用。Ling等[19]发现5-HT2B参与埃及伊蚊成虫脂质积累,我们发现5-HT2B在棉铃虫雌成虫腹部高表达,因此可推测其在棉铃虫雌性生殖过程中同样扮演了重要的角色。5-HT1A和5-HT1B在雌成虫触角的表达量显著高于雄成虫触角,而触角是昆虫主要的嗅觉器官,棉铃虫雌成虫触角在感受寄主植物挥发气味及产卵寄主植物选择中具有重要作用,推测这2种受体可能参与了该生理过程中。4种5-HT受体基因在棉铃虫幼虫阶段低表达,而在成虫期高表达,推测这些受体可能主要参与成虫嗅觉识别、生殖发育、求偶和寄主植物定位等生理功能。
本研究从棉铃虫转录组中筛选并克隆了4种5-HT受体基因(5-HT1A、5-HT1B、5-HT2A和5-HT2B),分析明确了此4种基因的序列特征,并对这4种基因的mRNA表达模式进行了解析。该研究结果为未来利用RNA干扰或CRISPR基因编辑技术进一步研究该类基因的功能奠定了基础。

