糖基化对罗非鱼皮胶原蛋白肽热滞活性及结构特征的影响
曹琳,欧阳及锦,韩梅,Julieth Majura,陈忠琴,2,曾少葵,2,张静,2,郑惠娜,2,曹文红,2*
1(广东海洋大学 食品科技学院,国家贝类加工技术研发分中心(湛江),广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,广东省海洋生物制品工程实验室,水产品深加工广东普通高等学校重点实验室,广东 湛江,524088)2(大连工业大学,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连,116034)
冷冻是海洋水产品的主要贮藏和加工方式,我国海洋水产品加工中约70%是冷冻加工。水产品在冻藏过程中易发生蛋白质冷冻变性造成品质劣变,加工利用价值显著降低[1-2]。生产中主要通过添加抗冻剂来防止在冻藏过程中的蛋白质冷冻变性以保持品质,传统商用抗冻剂主要由蔗糖、多聚磷酸盐组成。这类抗冻剂通过改变蛋白质中水存在的状态和性质间接作用于蛋白质,减缓蛋白质冷冻变性,但也存在一些缺陷,如糖类会带来不期望的甜味,而磷酸盐摄入过多会给人体带来健康风险[3]。因此,海洋水产冷冻加工业亟待研发新型安全、高效的抗蛋白质冷冻变性的抗冻剂。研究表明,从动物皮肤、骨骼和食源性明胶提取的胶原蛋白肽具有一定的热滞活性(thermal hysteresis activity, THA),可以改变冰晶的生长特性,降低冰点,抑制冰晶重结晶,从而达到抗冻的效果[4-8],THA是评价胶原蛋白肽抗冻活性的重要指标。具有冰结合特性的肽被称为抗冻肽,因具有开发成绿色抗冻剂的潜力,近年来成为研究热点[9]。虽然抗冻肽可以极大程度地满足人们对食品抗冻剂的要求,但对其进行开发探索仍存在一定的局限性[10]。天然抗冻肽主要提取自生物体内,数目有限,并且与传统抗冻剂相比,天然抗冻肽存在活性较低的问题。刘璐等[11]发现在牡蛎肉中添加5%的南极磷虾酶解产物时,其表现的抗冻活性与添加量为0.5%的含磷抗冻剂组相当。CHEN等[12]在草鱼鱼糜样品中添加鲢鱼鱼鳞抗冻肽,发现添加量为4%时可达到与商业抗冻剂相似的效果。张莉等[13]发现在马铃薯冷冻面团中添加4%、8%丝胶抗冻肽可以抑制冰晶重结晶,有效保持冷冻馒头的质构特性,减缓冷冻过程中对酵母的损伤。冷冻食品中常添加的商业含磷抗冻剂的添加量通常为0.5%~1%,虽然大量研究表明从动物、明胶中提取的胶原蛋白肽可以有效保证冷冻食品的品质,但与传统抗冻剂相比,其添加量较高,若要达到产业化程度,所需成本较大,这限制了抗冻肽在食品领域中的发展,所以开发出高活性、高稳定性的抗冻肽具有重要的应用前景。
糖基化反应通过共价连接游离氨基和游离羧基,改善蛋白质及胶原蛋白肽在溶液中的分布,改变其结构,增强稳定性,从而达到提高蛋白质、胶原蛋白肽生物活性的效果。HONG等[14]对鱼皮胶原蛋白肽和D-氨基葡萄糖进行糖基化反应,发现糖基化产物的抗氧化活性优于鱼皮胶原蛋白肽;WANG等[15]利用D-氨基葡萄糖制备玉米醇溶蛋白糖肽,发现其含有更多的酰胺键和疏水性氨基酸,可以有效改善急性酒精肝损伤;此外,有研究表明通过化学合成的抗冻糖蛋白与天然抗冻蛋白具有一样的活性,可以降低溶液冰点,抑制冰晶生长和重结晶效应,提高THA[16]。CHEN等[16]利用葡聚糖对猪皮胶原蛋白肽进行糖基化改性,改善了猪皮胶原蛋白肽的抗冻活性。虽然有研究证明糖基化反应可以提高猪皮胶原蛋白肽的THA,但由于部分人群因宗教原因,不食用哺乳动物来源的胶原蛋白肽,而鱼源性胶原蛋白肽具有更高的可接受度,且鱼皮是鱼类加工的主要副产物,尚未被充分利用。本研究以罗非鱼皮胶原蛋白肽为原料,利用糖基化反应改良其THA,并对糖基化产物的结构特征进行初步分析,以期为后续糖基化胶原蛋白肽的抗冻构效机制研究及绿色抗冻剂的开发应用提供前期数据。
1 材料与方法
1.1 材料与试剂
罗非鱼皮胶原蛋白肽(型号规格:CF-500-S-02)海南盛美诺生物技术有限公司;无水葡萄糖,广东光华科技股份有限公司;邻苯二甲醛(O-phthalaldehyde,OPA)、β-巯基乙醇,上海麦克林生化科技有限公司;牛血清白蛋白,北京索莱宝科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS),北京酷来博科技有限公司。乙腈,美国 Supelco 公司;乙腈、甲酸为质谱纯,其他试剂皆为分析纯。
1.2 实验仪器
XEVO G2-XS QTOF型超高效液相飞行时间质谱联用仪,美国Waters公司;TENSOR 27型傅里叶红外光谱仪,德国BRUKER公司;FE28型pH计,梅特勒-托利多仪器(上海)有限公司;Varioskan Flash全自动酶标仪,赛默飞世尔科技有限公司;XP205型分析天平,上海舜宇恒平科学仪器有限公司;QL-905漩涡混匀器,海门市其林贝尔仪器制造有限公司;DTT-A1000电子天平,福州华志科学仪器有限公司;SHJ-6AB磁力搅拌水浴锅,常州金坛良友仪器有限公司;DSC-300C差示扫描量热仪,南京大展检测仪器有限公司。
1.3 实验方法
1.3.1 糖基化产物的制备
参照WANG等[17]的方法,稍作修改。将胶原蛋白肽溶解于纯水中,配制成不同浓度的溶液,加入一定比例的葡萄糖,置于25 ℃磁力搅拌水浴锅中搅拌20 min,搅拌均匀后取部分混合液进行冷冻干燥,得到胶原蛋白肽-葡萄糖混合物。剩余混合液用0.1 mol/L的NaOH和HCl溶液调节pH值为8.0,将其置于磁力搅拌水浴锅中,并设置相应的反应时间及反应温度。待反应结束后迅速冷却至室温,得到糖基化产物,冷冻干燥备用。配制同等浓度的葡萄糖溶液为葡萄糖样品组,冷冻干燥备用。
1.3.2 胶原蛋白肽糖基化反应单因素实验
参考本课题前期研究以及于冬蕾[18]的试验方案稍作修改,以接枝度(degree of graft, DG)为测定指标,对胶原蛋白肽进行单因素试验,设置糖基化反应的温度为40、50、60、70、80 ℃、反应时间为30、60、90、120、150 min、胶原蛋白肽质量浓度为50、60、70、80和90 g/L,糖肽质量比为1∶2、1∶1、2∶1、3∶1、4∶1,探究以上4个因素对DG的影响。
1.3.3 正交优化胶原蛋白肽糖基化反应工艺
在单因素的基础上,选择反应温度、反应时间、胶原蛋白肽浓度和糖肽比进行4因素3水平L9(34)正交试验,如表1所示,以DG为指标,通过正交试验对糖基化反应条件进行优化,确定最佳工艺条件。

表1 葡萄糖糖基化反应正交试验因素水平编码表Table 1 Factors and levels for orthogonal test in glucose glycosylation
1.3.4 DG的测定
根据OPA法测量DG[19]。取80 mg OPA样品于2 mL甲醇中,搅拌至完全溶解,加入0.1 mol/L 的硼砂和20%(质量分数)SDS各5 mL,最后加入200 μL β-巯基乙醇,混合均匀后加入纯水定容至100 mL得到OPA试剂,现用现配。测定DG时,取4 mL OPA溶液,加入200 μL糖基化产物置于漩涡仪上混合均匀,以纯水为对照组,在35 ℃水浴锅中避光反应2 min,待反应结束后,于340 nm下测定糖基化产物吸光值,并以赖氨酸作标准曲线,按照公式(1)计算DG。
(1)
式中:c0,糖基化反应前游离氨基含量,mol/L;c1,糖基化反应后游离氨基含量,mol/L。
1.3.5 THA的测定
参考艾青等[20]的方法,稍作修改,采用差示扫描量热法(differential scanning calorimetry, DSC)进行THA的评价。将待测样品溶于纯水中,配成10 mg/mL的溶液,用移液枪精准移取10 μL样品于坩埚中,以牛血清白蛋白为对照,测定样品的THA。仪器稳定后,以10 ℃/min的速率从25 ℃降至-25 ℃,再升温至25 ℃,得到样品的熔点(Tm)和融熔晗(ΔHm)。然后,以10 ℃/min的速率降温至-25 ℃,以3 ℃/min的速率缓慢升温至样品呈固液混合状态,称为保留温度(Th),恒温2 min,以同样速率降温至-25 ℃,记录样品的起始结晶温度(T0)和结晶晗(ΔHf),按照公式(2)和公式(3)计算 THA 和冰晶含量(Ф)。
THA/℃=Th-T0
(2)
(3)
式中:Th,保留温度,℃;T0,起始结晶温度,℃;ΔHm,融熔晗;ΔHf,结晶晗。
1.3.6 红外光谱分析
参考WANG等[21]的方法,进行傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)扫描。称100 mg KBr研磨烘干,加入1 mg样品混合均匀,研磨压片。在4 000~400 cm-1进行红外光谱扫描,分辨率设置为4 cm-1。
1.3.7 质谱分析
参考范三红等[22]的方法并稍作修改。采用串联四极杆飞行时间质谱进行结构鉴定,设置流动相A为超纯水(含0.1%体积分数甲酸),B为乙腈(含0.1%甲酸),色谱柱:Waters UPLC BEH C18(2.1 mm×50 mm, 1.7 μm),柱温30 ℃,流速0.2 mL/min,将样品配成0.1 mg/mL的溶液,上样10 μL。梯度洗脱条件:96%A→50%A;50%A→0%A;0%A→96%A。
1.4 数据处理
每组试验重复3次取平均值,采用SPSS进行方差分析,P<0.05代表具有显著性差异,利用Origin 2021作图。
2 结果与分析
2.1 糖基化反应程度对THA的影响
胶原蛋白肽和葡萄糖的糖基化反应程度对糖基化产物的生物活性起着至关重要的作用,DG值可以评估胶原蛋白肽糖基化反应程度。固定糖基化反应时间和糖肽比,改变其他反应条件,测定不同反应条件下得到的糖基化产物的DG和THA,探究糖基化反应程度与THA之间的关系。如图1所示,糖基化产物的DG与THA呈正相关,随着糖基化产物DG的增大,其THA逐步增加,这证明胶原蛋白肽与葡萄糖糖基化反应程度越大,其产物的THA越大。

图1 糖基化反应程度对THA的影响Fig.1 Effect of degree of glycosylation reaction on THA注:图中括号内数据分别为糖基化反应温度和胶原蛋白肽浓度
2.2 胶原蛋白肽糖基化反应单因素试验结果
2.2.1 反应温度对糖基化DG的影响
温度是影响糖基化反应的关键性因素,不同反应温度对DG的影响如图2所示。随着反应温度从40 ℃上升至70 ℃,DG逐步增大,DG分别为(27.73±0.72)%、(32.87±0.88)%、(36.37±0.07)%、(38.7±0.32)%。这是因为由于温度升高,胶原蛋白肽的结构开始变得松散,使得胶原蛋白肽内的自由氨基暴露出来,同时温度越高,肽分子和糖分子运动越快,增加了体系内自由氨基和羧基的碰撞几率。但70~80 ℃时,DG出现下降趋势,推测糖基化反应活性位点趋于在70 ℃饱和,温度持续升高,反应进入到后期,糖被降解并且氨基化合物经过一系列反应生成晚期化合物,从而DG开始下降。这与ZHENG等[23]对卵清蛋白进行葡聚糖糖基化反应时的结果一致,不同反应温度下,DG随着反应温度的增加而增大,当糖基化反应活性位点趋于饱和时,DG便不再增加。

图2 不同反应温度下糖基化产物的DGFig.2 DG of glycosylated products of collagen peptides at different reaction temperatures
2.2.2 反应时间对糖基化DG的影响
胶原蛋白肽在70 ℃下,分别在不同反应时间30、60、90、120、150 min进行糖基化反应,结果如图3所示,DG分别为(30.95±0.61)%、(34.43±0.61)%、(38.70±0.32)%、(35.66±0.57)%、(33.45±1.07)%。随着反应时间增加,糖基化反应程度逐步增大,在90 min处达到峰值,随后趋于平缓。XIAO等[24]利用大米蛋白水解物进行葡萄糖糖基化反应时,同样发现DG在反应90 min时达到最大,与本文结果一致。在反应前期胶原蛋白肽经过高温水解造成肽链断裂,暴露出更多的游离氨基,从而促进了糖基化反应进程,而随着反应进行到90 min之后,糖基化反应结束,进入到下一阶段,导致氨基被消耗,从而DG开始下降[24-25]。

图3 不同反应时间下糖基化产物的DGFig.3 DG of the glycosylated products of collagen peptides at different reaction time
2.2.3 胶原蛋白肽浓度对糖基化DG的影响
如图4所示,随着胶原蛋白肽浓度不断升高,DG先增大后减小,当质量浓度达到80 g/L时,DG达到峰值(46.61±0.63)%,且胶原蛋白肽为80与90 g/L时,两者DG相差不大。这可能是因为相同反应温度和时间的条件下,肽浓度增高,体系内游离氨基也会增加,导致与游离羧基进行缩合反应的机会增加,所以DG增大。但由于葡萄糖含量是固定的,即羧基含量固定,胶原蛋白肽达到80 g/L时,糖基化反应已经趋于饱和,超过80 g/L后,DG不再增加,逐步趋于平衡。

图4 不同胶原蛋白肽浓度下糖基化产物的DGFig.4 DG of the glycosylated products of collagen peptides at different concentrations of collagen peptides
2.2.4 糖肽比对糖基化DG的影响
如图5所示,随着葡萄糖和胶原蛋白肽比例增加,DG先上升,后下降。糖肽比为3∶1时,DG达到最大值(51.16±0.79)%。这与ZHAO等[26]的报道一致,随着豌豆分离蛋白和低聚木糖的比值增加,糖基化产物的DG值先增加后降低,比值为3∶1时,DG达到最大。当体系中糖比例较低时,随着糖含量增加,糖基化反应进程被推动,DG变高。糖比例较高时,体系内溶液黏度增大,反而阻碍了游离氨基和羧基的碰撞几率,导致生成的糖基化产物减少。
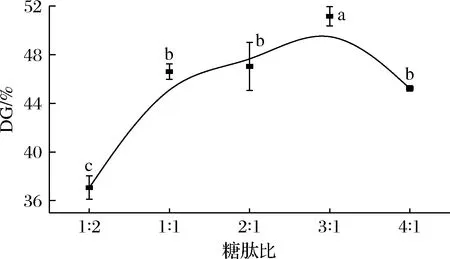
图5 不同糖肽比的糖基化产物的DGFig.5 DG of the glycosylated products of collagen peptides at different glucose-collagen peptides ratios
2.3 糖基化反应正交试验优化
为进一步探究糖基化反应最佳条件,在单因素试验结果的基础上,以DG为评价指标,以L9(34)正交表优化糖基化反应工艺条件,结果如表2所示,温度、时间、浓度和糖肽比4个因素不同程度上影响着糖基化反应进程。根据极差(R)结果,各因素对糖基化反应的影响大小为:A>B>C>D,即反应温度对实验影响最大。正交优化得到最佳糖基化工艺参数为:A2B2C3D3,即反应温度70 ℃、反应时间90 min、质量浓度90 g/L、糖肽比4∶1。进行验证该条件DG为(52.06±1.50)%,优于正交表中的各试验号。

表2 胶原蛋白肽糖基化反应正交设计及结果Table 2 Orthogonal design and results of the glycosylation reaction of collagen peptides
2.4 糖基化反应对胶原蛋白肽THA的影响
具有抗冻活性的胶原蛋白肽可以特异性地降低溶液冰点,但不改变其熔点,这会导致溶液的冰点和熔点之间产生差值,此差值被称为THA[27-28]。本研究采用DSC法探究糖基化反应前后胶原蛋白肽的THA,以牛血清白蛋白作为参照,图6展示了牛血清白蛋白、葡萄糖、胶原蛋白肽、胶原蛋白肽-葡萄糖混合物和糖基化产物的DSC热流曲线图,基于DSC曲线计算Th下的THA和Ф,结果如表3所示。

表3 糖基化产物及对照样品的THA和ФTable 3 THA and Ф of the glycosylated product and the control samples

a-糖基化产物;b-葡萄糖-胶原蛋白肽混合物;c-胶原蛋白肽;d-葡萄糖;e-牛血清白蛋白图6 糖基化产物及对照样品的DSC热流曲线Fig.6 DSC curves of freezing and melting process for glycosylated product and control samples
将冻结的样品溶液升温至Th,即保持在固液共存状态下,然后立即降温至-25 ℃以达到完全结晶状态。在相同的Th(0.1 ℃)下,由于牛血清白蛋白没有抗冻活性,当温度再次下降时,放热峰立即出现,几乎没有THA(0.3 ℃),而葡萄糖、胶原蛋白肽、胶原蛋白肽-葡萄糖混合物和糖基化产物的放热峰出现延迟,THA分别为1.2、1.1、2.3、0.4 ℃,THA在0.2~0.5 ℃为“中度活跃”抗冻蛋白,0.6~6 ℃为“极度活跃”抗冻蛋白[29-30],胶原蛋白肽、胶原蛋白肽-葡萄糖混合物以及糖基化产物都属于“极度活跃”抗冻肽。经过糖基化反应后,胶原蛋白肽的THA升高了1.1 ℃,较反应前提高了47.8%,Ф降低了29.94%。样品的THA越高,其Ф越低,该结果与CAO等[31]研究的结果相似,即THA与Ф之间存在线性负相关关系。推测因为糖基化反应会增加溶液黏度,从而降低样品的Ф,增大THA[16]。除此之外,糖基化反应可以引进大量羟基,据文献报道,抗冻肽主要通过氢键相互作用与冰晶中的水结合,以达到抑制冰晶形成的作用[32],大量羟基存在会增加其以氢键形式与冰晶结合的能力,从而导致糖基化产物的THA增强。
2.5 红外光谱分析


a-葡萄糖;b-胶原蛋白肽;c-胶原蛋白肽-葡萄糖混合物;d-糖基化产物图7 糖基化产物及对照样品的傅里叶红外光谱Fig.7 Fourier infrared spectroscopy of the glycosylated product and control samples
通过傅里叶自反褶积和高斯函数计算胶原蛋白肽和糖基化产物位于酰胺Ⅰ带的二级结构组成,结果如图8所示,胶原蛋白肽的二级结构主要由β-转角和β-折叠组成,分别占40.00%和60.00%,胶原蛋白肽-葡萄糖混合物与胶原蛋白肽的二级结构差异性不大,β-转角占59.15%,β-折叠占40.85%。而经过葡萄糖糖基化反应后,β-转角降低至4.82%,β-折叠增加至95.18%。这一结果表明,葡萄糖和胶原蛋白肽之间的相互作用会影响胶原蛋白肽的二级结构[38]。推测β-折叠增加可以推进糖基化产物与冰晶结合,从而增强抗冻肽的THA。

图8 胶原蛋白肽、胶原蛋白肽-葡萄糖混合物与糖基化产物酰胺Ⅰ带的红外光谱分析(a)及二级结构组成(b)Fig.8 Infrared spectroscopy analysis of collagen peptides, collagen peptides-glucose mixture and the glycosylated product (a) and secondary structure composition (b)
2.6 质谱分析
质谱是测定蛋白质和胶原蛋白肽相对分子质量的核心手段,通过分子质量转移分析胶原蛋白肽结构变化[39]。图9-a是罗非鱼皮胶原蛋白肽和糖基化产物的基峰离子(base peak ion, BPI)色谱图,色谱峰在9 min 内全部流出,经过糖基化反应后,0~3 min内胶原蛋白肽离子峰明显减弱,5.5~8 min时,离子峰数量增加,且其相对丰度增强。对胶原蛋白肽以及糖基化产物进行MS图谱分析(图9-b和图9-c),其结果与BPI色谱图相对应,经过糖基化反应后的胶原蛋白肽和糖基化产物的质荷比(m/z)以及峰强度发生变化,胶原蛋白肽的m/z值由300~700转移到400~800附近。这可能是由于葡萄糖与罗非鱼皮胶原蛋白肽发生了接枝反应,其质荷比发生迁移。
理论上,肽被1个葡萄糖修饰时,m/z会增加162,如果肽被2个或者3个葡萄糖修饰时,其m/z也成倍数增加[40]。葡萄糖与胶原蛋白肽进行糖基化反应时并非简单分子质量加成,此过程中葡萄糖分子可能会携带或失去部分离子。胶原蛋白肽与葡萄糖结合的机制尚不明确,以图9-c糖基化产物中响应值较高的2个峰为例,推测m/z为318.30的胶原蛋白肽与1个葡萄糖结合并脱去2个O2-,生成m/z为448.27的糖基化产物。m/z为274.28的胶原蛋白肽与3个葡萄糖分子和2个H+结合,生成m/z为762.42的糖基化产物。
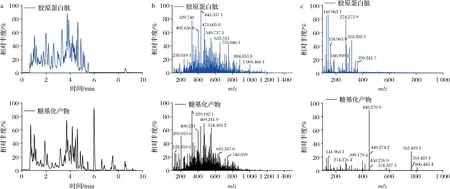
图9 胶原蛋白肽及其糖基化产物的基峰离子色谱图(a)、0~3 min MS(b)和5.5~9 min MS(c)图谱Fig.9 Base peak ion chromatography of collagen peptides and its glycosylation product (a), MS spectrum of 0-3 min (b) and MS spectrum of 5.5-9 min (c)
3 结论
改良抗冻肽的抗冻活性可提高其实用性,利用糖基化将抗冻肽与外源单糖进行接枝组装,可达到增加活性位点、优化结构、改良活性的目的。本文利用葡萄糖对罗非鱼胶原蛋白肽进行糖基化抗冻活性(THA)改良,优化工艺参数下其糖基化DG达(52.06±1.50)%;糖基化后的胶原蛋白肽THA和Ф均发生显著性变化,属于“极度活跃”抗冻肽;胶原蛋白肽与葡萄糖分子结合,使其m/z变大;糖基化反应后,胶原蛋白肽中大部分β-转角转变成β-折叠,改变了胶原蛋白肽的二级结构,引入大量羟基,导致其与冰晶中水分子的结合能力加强,从而致使THA增加。本研究结果为糖基化改良罗非鱼皮胶原蛋白肽THA及基于鱼皮胶原蛋白肽开发绿色抗冻剂提供了重要的前期数据,对其它水产胶原蛋白源抗冻剂的开发亦具有重要参考意义。

