表面活性剂增强超声法提取污泥胞外聚合物
周语桐,杨 英*,李卫华,张田田,吴 亮,程志龙
(安徽建筑大学 a.环境与能源工程学院,b.水污染控制与废水资源化安徽省重点实验室,安徽 合肥 230601)
0 引言
胞外聚合物 (Extracellular Polymeric Substances,EPS)是指细胞在新陈代谢时分泌的复杂高分子混合物,成分和微生物的胞内物质类似,主要是多糖、蛋白质和核酸等高分子聚合物。除细胞与水分以外,EPS是活性污泥的第3种重要组成部分,约占活性污泥总有机质的50% ~ 90%[1]。细胞外高分子具有疏水性,不但可以与阳离子相结合,而且对污泥絮凝沉淀和脱水特性也有较大的影响。确定一种有效的提取方法是研究胞外聚合物对污泥性能的影响及分析EPS组成的重要前提。
目前,EPS的提取方法一般有离心法、超声法、热萃取法、氢氧化钠法、EDTA 法、阳离子交换树脂法、“甲醛+NaOH”法和硫酸法等。超声法因不会造成二次污染被广泛使用。该方法可以使水相中的生物絮凝体分散开来,并将大颗粒物破碎分解成小颗粒物[2],但是提取效率低,只能提取部分EPS。
表面活性剂是一种被广泛用于工业生产的化学物质,可以有效地减少两相之间的界面张力,具有增溶、润湿、润滑、絮凝、分散、抗静电等诸多特性,可用于分离污泥中的EPS,使细胞的结构和性质均发生改变[3]。表面活性剂增强超声法是一种常用提取方法,可以大大提高胞外聚合物的提取效率。本文将以表面活性剂增强超声法提取污泥胞外聚合物,并与超声法和表面活性法进行对比分析,旨在为未来废物资源化利用奠定基础。
1 材料与方法
1.1 试验原料
活性污泥取自合肥经济开发区废水厂中的二次沉淀池,呈深褐色,从污水厂取回实验室后应立即进行EPS提取。
1.2 试验仪器
试验用仪器包括:电子分析天平(AS 220.RS,RADWAG公司);超声波清洗仪(GTSONIC-D20,广东固特超声股份有限公司);恒温震荡箱(ZQTY-70S,上海知楚仪器有限公司);冷冻高速离心机(FC-18R,广州市方统生物科技有限公司);水浴锅(HH-S2,常州万达升实验仪器有限公司);紫外-可见光分光光度计(UV-1800,日本岛津制作所)。
1.3 试验方法
取30 mL污泥样品,在3 220 g的离心力下离心10 min后倒掉上清液,再分别加入含0,3,6,9,12,15 g NaCl的重悬液恢复至原体积。磷酸盐缓冲液为40 mL 0.1 moL/L NaH2PO4·2H2O和60 mL 0.1 moL/L Na2HPO4·12H2O。
试验过程中采用的提取方法有:①超声法,将重新悬浮后的污泥放置于槽式超声波清洗仪中进行超声;②表面活性剂法,向重新悬浮后的污泥中添加不同的表面活性剂,再放置于恒温震荡箱中以200 r/min的转速分别震荡0,15,30,45,60 min;③表面活性剂增强超声法,向重新悬浮后的活性污泥中添加表面活性剂,以200 r/min的转速在恒温震荡箱中震荡1 h,再进行超声。提取结束后,将所有样品置于冷冻离心机中,在10 000 g的条件下离心15 min,再采用0.45 μm的水系滤膜过滤清液,并检测多糖、蛋白质和核酸等物质。
1.4 分析方法
用蒽酮-硫酸比色法测定多糖含量,葡萄糖为标准物质;采用考马斯亮蓝G250法测定蛋白质含量,以牛血清蛋白为标准物质;采用二苯胺法测定DNA,小牛胸腺DNA为标准物质。所有样品测定3次,取平均值为最终测定值。
2 结果与讨论
2.1 液相环境对EPS提取效果的影响
NaCl投加量对EPS各组分提取效果的影响如图1所示。由图1可知,NaCl的投加量对EPS各组分的提取效果影响很大。投加9 g NaCl时,EPS的提取量最高。当NaCl投加量在3~9 g时,随着投加量增大,多糖与蛋白质提取量也在不断增加;而超过9 g时,多糖与蛋白质的含量均下降。DNA提取量随着投加量增大而缓慢增加。因此,重悬液确定为投加量为9 g NaCl的PBS溶液,不仅能确保细胞始终处于相对完整的状态,也能促进EPS释放。

图1 NaCl投加量对EPS各组分提取效果的影响
2.2 表面活性剂对EPS提取效果的影响
表面活性剂对EPS各组分提取效果的影响如图2所示。由图2可知,添加表面活性剂可有效提高EPS提取量。其中,添加CTAB的EPS提取量最高,尤其是多糖的提取量提升最为显著,其次是SDS。这是由于EPS和二价阳离子均对生物的絮凝作用有显著影响。吐温对提高EPS各组分的提取量的作用虽然最低,但其DNA含量却高于SDS,并且这3种表面活性剂的DNA含量都显著高于空白组,说明高浓度的表面活性剂有可能导致细胞破裂。因此,采用CTAB提取EPS。
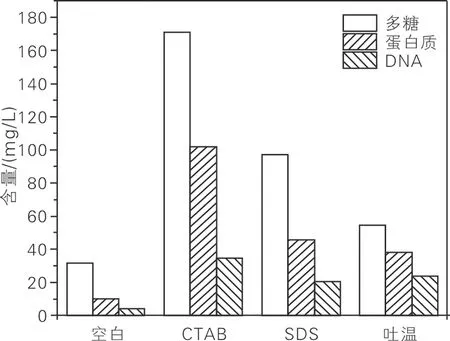
图2 表面活性剂对EPS各组分提取效果的影响
2.3 CTAB投加量对EPS提取效果的影响
CTAB投加量对EPS各组分提取效果的影响如图3所示。由图3可知,随着CTAB投加量从4 mg增加到48 mg,多糖和蛋白质的提取量大幅度提升;而当投加量继续提升至60 mg时,多糖的提取量增加缓慢,蛋白质提取量基本不变。其原因在于,较高浓度的表面活性剂对细胞的破坏程度较大,使胞内的物质(蛋白质、酸性多糖)被提取出来,又由于其自身具有絮凝作用而部分沉淀在污泥中。随着CTAB投加量增加,DNA提取量不断上升,说明更高浓度的表面活性剂对细胞的破坏程度更大,胞内物质可能会污染EPS。综合考虑,确定投加48 mg CTAB提取EPS。

图3 CTAB投加量对EPS各组分提取效果的影响
2.4 提取时间对EPS提取效果的影响
提取时间对EPS各组分提取效果的影响如图4所示。

图4 提取时间对EPS各组分提取效果的影响
由图4可知,在0~45 min时,CTAB对多糖和蛋白质的提取量均随着时间增加而增加;提取时间达到45 min时,EPS的提取量达到最高值;提取时间继续增加到60 min时,EPS提取量下降。这是因为部分EPS的提取只有在厌氧的条件下才能正常进行,EPS在长时间震荡的情况下会与氧气充分接触,无法达到厌氧条件。此外,随着时间增加,DNA的提取量先逐步上升,在30~60 min时始终保持稳定状态。综合考虑确定CTAB的最佳提取时间为45 min。FrØlund等[4]曾提出EPS最佳提取时间为0.5~1 h,此时细胞裂解的风险最低。
2.5 提取方法对EPS提取效果的影响
提取方法对EPS各组分提取效果的影响如图5所示。由图5可知,表面活性剂联合超声波法对EPS的提取量高于超声波法和表面活性剂法。这是由于表面活性剂中的亲水和疏水基团具有降低界面间表面张力的作用,从而导致超声的空化现象增加。一般认为,降低表面张力能够有效提升超声波的处理效果,降低超声过程的能耗。

图5 提取方法对EPS各组分提取效果的影响
2.6 超声条件对EPS提取效果的影响
超声条件对EPS各组分提取效果的影响如图6所示。由图6可知,当提取功率相同时,随着作用时间从2 min增加到10 min,多糖和蛋白质的提取量均有所上升。这是由于随着时间增加,在超声波作用下部分大颗粒物的粒径因水力剪切作用变小,从而使溶解度提高。当作用时间相同时,随着提取功率增加,多糖和蛋白质的提取量虽略有增加,但是总体趋势趋于平缓。这表明高的超声功率与表面活性剂的交叉相关性较差。因为超声波的功率越大,消耗的能量越大,考虑到能量损耗,最后确定最佳提取功率为100 W。在功率为100 W时,时间越长,EPS提取量越高,但是在2~5 min之间,DNA的提取量变化较为稳定,继续增加到10 min时,DNA的提取量急剧上升。这是因为超声波作用时间越长,细胞的受损程度越大,细胞内的DNA更容易泄露出来。综合考虑,超声条件确定为100 W,5 min。

图6 超声条件对EPS各组分提取效果的影响
3 红外光谱与荧光光谱分析
3.1 红外光谱分析
不同方法提取的活性污泥EPS的红外光谱如图7所示。

图7 不同方法提取的活性污泥EPS的红外光谱

3.2 荧光光谱分析
不同方法提取的EPS的三维荧光光谱如图8所示。提取的EPS主要包含酪氨酸、色氨酸类蛋白质、腐殖酸和富里酸。3种方法所提取的EPS在物质浓度以及荧光特性上存在区别。其中,表面活性剂法不能对腐殖酸和富里酸进行有效提取。超声法和表面活性剂增强超声法均含有色氨酸特征峰、腐殖酸特征峰和富里酸特征峰,表面活性剂联合超声法的光谱图中还出现了酪氨酸特征峰,表明此种方法对酪氨酸的提取优于超声法。表面活性剂联合超声法提取EPS的荧光强度最高,表面活性剂法荧光强度次之,超声法荧光强度最弱。

(a) 表面活性剂法 (b) 表面活性剂联合超声法 (c) 超声法图8 不同方法提取的EPS的三维荧光光谱
4 结论
表面活性剂增强超声法EPS提取量最高,提取组分最全面。添加CTAB后,EPS的提取量高于添加其他表面活性剂,且其最佳投加量为48 mg,最佳提取时间为45 min;在超声功率为100 W,有效超声时间为5 min的优化条件下使用CTAB表面活性剂会使提取效率提高。

