35份狗牙根种质材料指纹图谱构建及染色体倍性鉴定
何法慧,左倩倩,于景金,杨志民
(南京农业大学草业学院,江苏 南京 210095)
狗牙根(Cynodonspp.)是应用广泛的多年生暖季型草坪草之一,主要分布在热带、亚热带和暖温带地区[1]。狗牙根因其植株低矮、质地纤细、色泽度好、抗旱力强、耐践踏、繁殖力容易等优点,被广泛用于水土保持、园林绿化、运动场草坪建植等[2]。我国狗牙根种质资源遗传变异丰富,Taliaferro[3]把狗牙根植物分为9种10变种,其中用于草坪的狗牙根主要有普通狗牙根(Cynodondactylon)、非洲狗牙根(C.transvaalensis)、印苛狗牙根(C.incompletus)和杂交狗牙根(C.dactylon×C.transvaalensis)等4种。近年来,许多科研工作者对我国野生狗牙根种质资源进行了采集和开发利用,并进行了包括叶长、叶宽、草层高度、生殖枝高度和穗部性状等形态学观察和鉴定[4-7]。由于形态学鉴定存在不同程度的缺陷,单纯依靠传统形态学很难对狗牙根种质资源做出准确鉴定。随着分子生物技术迅速发展,细胞学和分子标记广泛应用于种质资源的鉴定[8]。细胞学鉴定能够明确显示染色体的遗传多样性的结构、形态及数量特征[9]。分子标记鉴定也在DNA水平上直接反映遗传多态性,主要包括扩增片段长度多态性(amplified fragment length polymorphism,AFLP)、随机扩增多态性(random amplified polymorphic,RAPD)、相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)和简单重复序列(simple sequence repeat,SSR)等[10]。把细胞学与分子标记鉴定相结合,能够快速精确辅助完成鉴别工作和遗传关系分析。
在几种常见的分子标记中,SRAP具有操作简单、多态性好、重复性好等特点[11]。SSR又被称为微卫星DNA(microsatellite DNA),是一类由1~5个核苷酸为重复单位构成的长达几十个核苷酸的串联重复序列[12]。SSR分子标记具有可区别纯/杂合位点、多态性高、在真核生物基因组的编码区和非编码区广泛分布的特点[13]。作为一种有效的研究遗传多样性的手段,SRAP和SSR分子标记已成功运用于狗牙根[14]、结缕草(ZoysiajaponicaSteud.)[15]、多花黑麦草(LoliummultiflorumLamk.)[16]和海雀稗(PaspalumvaginatumSw.)[17]等草种质资源品种鉴定、遗传多样性等研究。
流式细胞术(flow cytometry,FCM)是应用流式细胞仪进行分析、分选的技术,在植物学研究中,FCM主要用于检测植物细胞核DNA含量及其倍性水平[18]。其中G1期的DNA含量可间接反映该细胞的倍性水平,因此测定植物核DNA含量的同时可以获取倍性水平相关数据。FCM具有速度快、精度高、准确性好的优点,是当代最先进的细胞定量分析技术之一。目前在紫花苜蓿(MedicagosativaL.)[19]和黑麦草(LoliumperenneL.)[20]等植物中,已应用FCM技术准确测定出其染色体的倍性。
我国南方地区野生狗牙根资源丰富。近年来,我们在浙江、安徽和江苏等地区收集了数百份野生狗牙根种质资源,通过驯化、系统选育、杂交育种和诱变育种等手段,筛选出诸多有价值的新材料。本研究应用FCM、SRAP和SSR分子标记技术对35份狗牙根材料的染色体倍性开展检测并进行遗传多样性分析和指纹图谱构建,旨在鉴定这些狗牙根新种质,为狗牙根新品种选育奠定基础。
1 材料与方法
1.1 材料
从数百份狗牙根种质资源中筛选出35份,其中包括生产上常用的国外引进品种Tifway、Tifgreen、Tifdwarf、Tifeagle、Tifsport以及非洲狗牙根。这些材料种植于南京农业大学白马教学科研基地仲英草业科学中心资源圃。材料来源见表1。
表1 材料来源与编号Table 1 Materials source and number

续表1 Table 1 continued
1.2 SRAP和SSR分子标记
1.2.1 DNA的提取与检测随机采集35份狗牙根植株幼嫩叶片,每份材料重复3次取样,利用植物基因组DNA提取试剂盒(TIANGEN公司)提取试验材料基因组DNA。用8 g·L-1琼脂糖凝胶电泳进行DNA完整性检测,酶标仪检测DNA浓度,稀释至40 ng·μL-1,-20 ℃保存。
1.2.2 SRAP和SSR的PCR扩增反应体系及扩增条件扩增总反应体系为20 μL:DNA 1 μL(40 ng·μL-1),2×PCR Mix 10 μL,上、下游引物(10 μmol·L-1)各1 μL,用无菌水补足20 μL。SRAP反应程序:第1步94 ℃ 5 min,94 ℃ 1 min,35 ℃ 1 min,72 ℃ 1 min(5个循环);第2步94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min(35个循环);4 ℃保存。SSR扩增程序:94 ℃ 4 min;94 ℃ 40 s,60 ℃ 45 s,72 ℃ 1 min(35个循环);72 ℃ 10 min,4 ℃保存。
1.2.3 引物筛选参考已发表的引物序列[11,21-22],筛选得到条带清晰、稳定性高、多态性好的10对SRAP引物和10对SSR引物用于狗牙根种质资源的遗传多样性分析(表2)。

表2 SRAP和SSR引物序列Table 2 SRAP and SSR primer sequences
1.2.4 数据统计分析使用80 g·L-1非变性聚丙烯酰胺凝胶电泳(PAGE)检测PCR产物,电泳结束后进行银染显色[23]。将胶图中的条带信息转化为0~1数据,在电泳图中,有特征条带的记为1,无条带的记为0,以此得到数据库。利用NTSYYS-pc 2.1e软件的UPGMA法得到遗传相似系数(GS)、聚类图,同时构建35份狗牙根的DNA数字指纹图谱,利用SPSS 20.0进行SRAP和SSR分子标记基于GS之间的相关性分析。
1.3 35份狗牙根的染色体倍性鉴定
参照Takamura等[24]的方法,取狗牙根幼嫩叶片0.1 g左右,用蒸馏水清洗表面尘土,滤纸吸干。将样品放入预冷的培养皿中,再加入0.5 mL解离液,切碎,静置30~60 s。将切碎后的样品及解离液转至 30 μm 细胞过滤器进行过滤,过滤至5 mL离心管。向离心管中加入2 mL染液,静置30~60 s后进行上机检测。所用仪器为CyFlow Ploidy Analyser,购于德国公司Sysmex Partec GmbH。
流式细胞仪外标法测定狗牙根倍性时,需要先检测一个独立的参照样品,再进行供试样品检测,每次收集细胞数不少于10 000个。检测后通过如下方式和公式换算出供试样品的倍性及DNA含量:选非洲狗牙根(二倍体)为外标参照样品,在仪器采样后最终得到狗牙根叶片荧光直方图(峰图),其横坐标表示样品G1峰的荧光位置,纵坐标表示样品细胞核数目。保持流式细胞仪参数不变,以非洲狗牙根G1峰荧光均值为参照标准确定供试样品倍性水平。其倍性及DNA含量计算公式:待测样本核DNA含量或倍性水平=参照样本核DNA含量或倍性水平×(待测样本G1峰荧光均值/参照样本G1峰荧光均值)。
2 结果与分析
2.1 分子标记分析
2.1.1 SRAP和SSR引物扩增结果从表3可知:10对SRAP引物扩增出155条谱带数,其中多态性谱带132条,多态性比率85.16%,扩增的片段大小主要在100~2 000 bp。图1-A为SRAP引物me6-em3在35份狗牙根中电泳扩增图,该引物扩增出18条谱带,其中多态性谱带14条,多态性比率77.78%。10对SSR引物扩增出166条谱带,其中多态性谱带144条,多态性比率90.00%,扩增的片段大小主要在100~2 000 bp(表4)。图1-B为SSR引物S15在35份狗牙根材料中电泳扩增图,该引物扩增出22条谱带,其中多态性谱带20条,多态性比率90.91%。以上结果表明SRAP和SSR分子标记能获得较好的PCR扩增效果。从非变性聚丙烯酰胺凝胶电泳检测结果来看,3次重复PCR扩增的DNA片段大小基本一致,说明筛选出的引物对重复性好,可用于狗牙根品系的数字指纹图谱的构建。

表3 SRAP和SSR引物扩增结果Table 3 Results of SRAP and SSR primer amplification

图1 SRAP引物me6-em3(A)和SSR引物S15(B)在35份狗牙根中电泳扩增Fig.1 Electrophoretic amplification of SRAP primer me6-em3(A)and SSR primer S15(B)in 35 bermudagrass 编号1~35对应表1,图中M1和M2代表DNA标准品(500 bp,2 000 bp)。Numbers 1-35 correspond to Table 1,M1 and M2 represent DNA Marker(500 bp,2 000 bp).

表4 部分供试材料间遗传相似系数矩阵Table 4 Genetic similarity coefficient matrix among some tested materials
2.1.2 遗传相似系数分析供试材料的SRAP标记和SSR标记基于遗传相似系数矩阵相关性分析,SRAP和SSR的遗传相似系数之间的相关系数r=0.628,表明这2种标记存在极显著正相关性。基于2种标记的遗传相似系数矩阵相关性分析,对2种标记遗传相似系数矩阵数据进行整合处理。35份狗牙根的遗传相似系数为0.524~0.927,变幅为0.403,表明这些材料之间存在丰富遗传变异。由表4可知:BG013和BG128之间遗传相似系数为0.524,表明BG013和BG128之间的亲缘关系较远,BG010和BG011、BG012和BG018、BG025和BG109之间遗传相似系数为0.927,表明BG010和BG011、BG012和BG018、BG025和BG109之间的亲缘关系较近。
2.1.3 基于SSR和SRAP分子标记的遗传系数的聚类分析在遗传系数基础上,整合SRAP标记和SSR标记的数据,应用UPGMA法对供试35份狗牙根进行聚类分析,当遗传相似系数在0.699时,35份狗牙根可聚为4类(图2)。
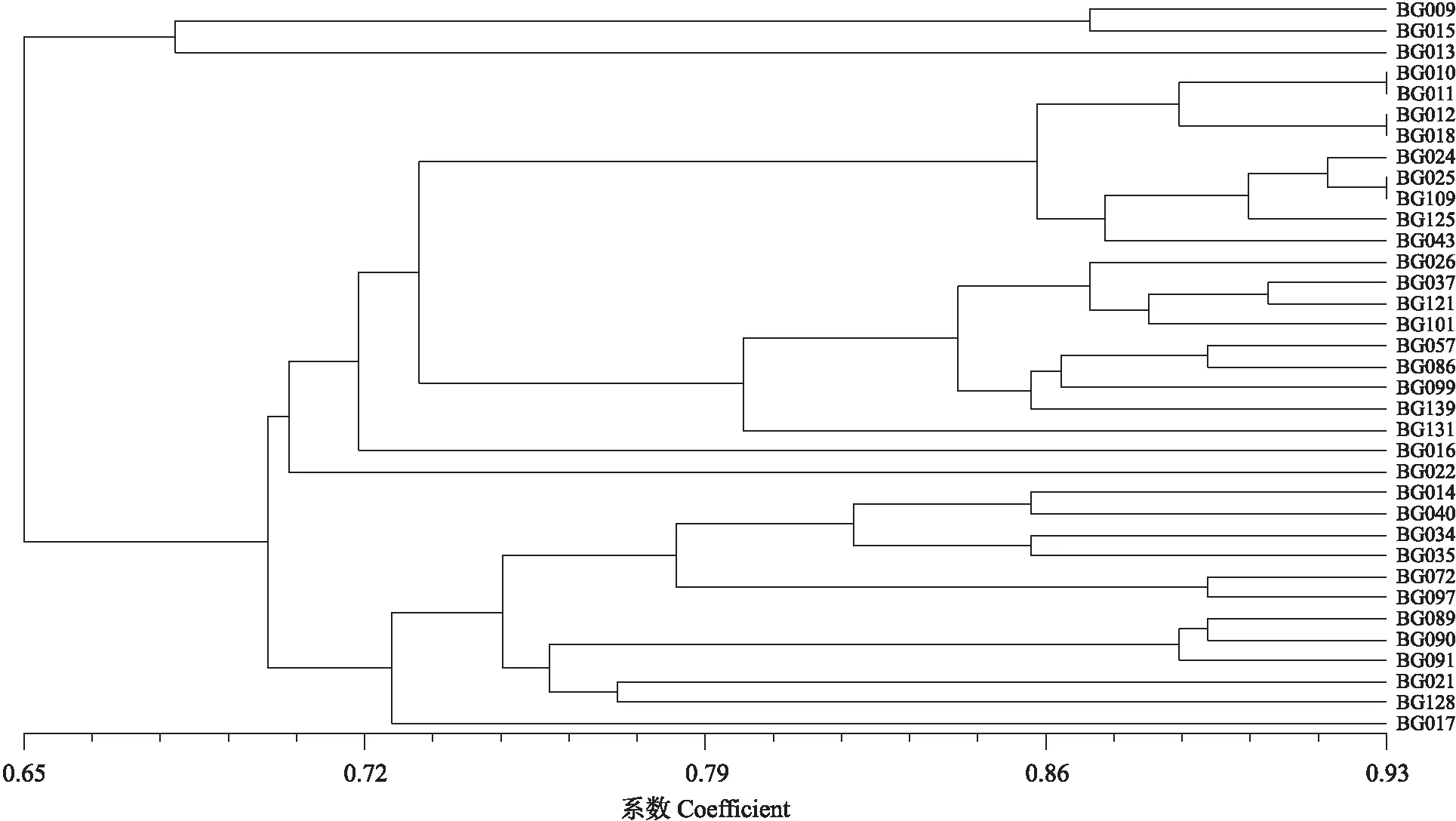
图2 基于SRAP和SSR标记整合的GS狗牙根聚类Fig.2 GS of bermudagrass clustering based on SRAP and SSR marker integration
第1类:包括BG009和BG015。由表5的表型评价结果可见,BG015和BG009在叶片宽度、叶片色泽、花药颜色、雌蕊颜色等形态特征方面极其相似,叶耳长均在2.56~2.66 mm,叶耳明显比其他材料长;经染色体倍性分析,BG009和BG015都是三倍体。第2类:仅包含BG013。BG013叶片长5 cm左右,花药颜色是粉红色,雌蕊颜色为紫色,穗枝数3个,经染色体倍性分析,BG013是三倍体。第3类:包括BG010、BG011、BG012、BG016、BG018、BG022、BG024、BG025、BG026、BG037、BG043、BG057、BG086、BG099、BG101、BG109、BG121、BG125、BG131、BG139,除BG139,其他材料的叶片长基本维持在1.63~2.14 mm,呈现叶片细腻的特点。当遗传相似系数是0.730时,第3类中可进一步划分为3类。BG022是非洲狗牙根,是二倍体,单独聚为一类;BG016是野生采集资源,花药颜色为黄色,雌蕊颜色是紫色。经染色体倍性鉴定为四倍体,单独聚为一类;其余的归为一类,经染色体倍性鉴定均为三倍体。第4类:包含BG014、BG017、BG021、BG034、BG035、BG040、BG072、BG089、BG090、BG091、BG097、BG128共12份材料,这些材料的叶宽为2.15~3.57 mm,呈现叶片宽特点。经染色体倍性分析,BG035、BG072、BG097和BG128为四倍体,其他的材料均为三倍体。
2.1.4 数字指纹图谱通过PCR扩增,分别筛选出条带清晰、稳定性好和重复性好的7对SRAP分子标记引物和5对SSR分子标记引物,7对SRAP引物分别是me3-em1、me1-em2、me6-em3、me5-em1、me4-em8、me9-em8和me4-em1,5对SSR分子标记引物分别是S15、R38、S12、R45和S17。这些引物分别通过PCR进行扩增,产生28条和24条特征性条带,构建出35份狗牙根的数字指纹图谱(表6和表7),以此鉴定35份狗牙根。

表5 35份狗牙根的形态指标Table 5 Morphological indicators of 35 bermudagrass

图3 3种狗牙根叶片细胞染色体倍性的流式细胞仪检测直方图Fig.3 Flow cytometry hitograms of chromosome ploidy in 3 bermudagrass leaf cells
2.2 染色体倍性检测
经流式细胞仪检测狗牙根染色体倍性,其中二倍体1份,三倍体28份,四倍体6份(表8)。二倍体参照样品BG022的峰值出现在横坐标12 526;BG021峰值出现在横坐标24 143,其荧光均值为二倍体的2倍,鉴定供试样品为四倍体(图3)。
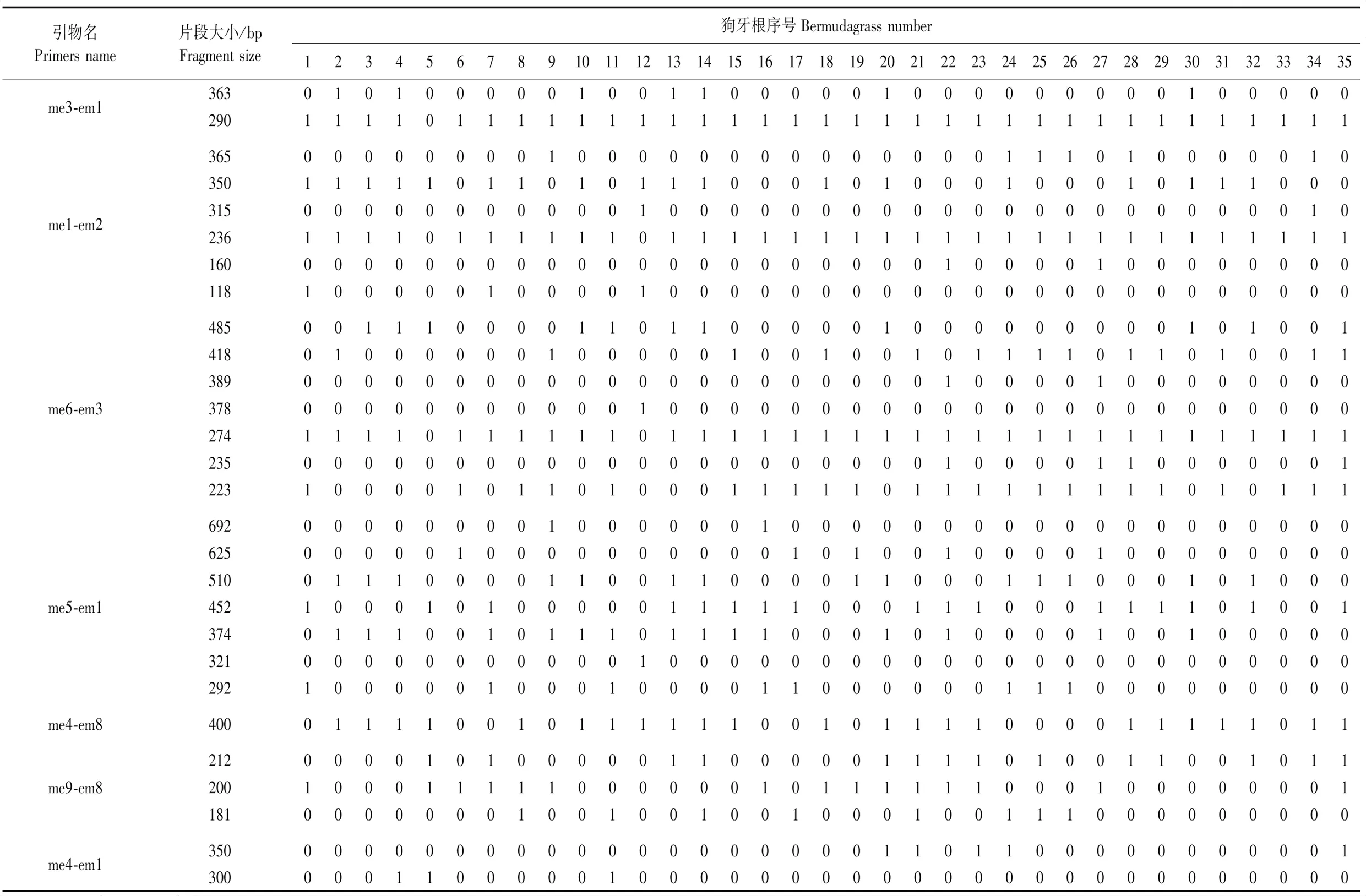
表6 用SRAP分子标记构建的35份狗牙根的数字指纹图谱Table 6 Digital fingerprints of 35 bermudagrass constructed with SRAP molecular markers

表7 用SSR分子标记构建的35份狗牙根的数字指纹图谱Table 7 Digital fingerprints of 35 bermudagrass constructed with SSR molecular markers

表8 35份狗牙根染色体倍性为二倍体、三倍体和四倍体统计Table 8 Diploid,triploid and tetraploid statistics of chromosome ploidy in 35 bermudagrass
3 讨论
本研究以29份狗牙根优良种质材料为研究对象,以6份源自国外的优异品种为对照,应用FCM进行染色体倍性检测,利用SRAP和SSR分子标记技术对这些种质材料进行遗传多样性分析和DNA指纹图谱构建。从10对SRAP引物和10对SSR引物对35份狗牙根的扩增结果来看,SRAP分子标记共扩增出155条清晰的谱带,其中多态性条带有132条,多态性比率为85.16%,SSR分子标记共扩增出166条清晰的谱带,其中多态性条带144条,多态性比率为90.00%。凌瑶等[21]利用SRAP分子标记对野生狗牙根的遗传多样性进行分析,用18对引物对共扩增出236条带,多态性条带数206条,多态性位点比率为87.29%。张延辉等[22]利用SSR分子标记对野生狗牙根的遗传多样性进行分析,用20对引物对共扩增出142条带,多态性条带数124条,多态性位点比率为87.86%。本研究中,狗牙根的SRAP和SSR标记表现出的多态性与前人研究结论接近,说明这2种分子标记多态性丰富,因此可利用SRAP和SSR技术对狗牙根进行遗传多样性分析和DNA指纹图谱的构建。
遗传多样性指物种之间存在的遗传变异,即种内的不同居群之间或者居群内不同个体之间的遗传变异[25]。随着分子标记技术的发展,其在种群遗传多样性研究、物种鉴定以及物种起源等方面得到了广泛的应用[26-27]。刘伟等[28]对西南区野生狗牙根的遗传多样性进行研究,表明野生狗牙根的亲缘关系与地理分布位置有一定的相关性。高文伟等[29]对新疆境内的狗牙根资源进行研究,结果显示各地区的狗牙根材料有一定的遗传相似性,但又相对独立。本试验通过SRAP和SSR分子标记数据整合聚类分析,29份狗牙根优良品系和6份对照材料可以聚为4大类。BG013单独聚为一类,从遗传相似系数矩阵得知,BG013和BG128之间遗传相似系数为0.524,表明BG013和BG128之间的亲缘关系较远,而BG013和BG128的地理位置相距远,体现狗牙根的亲缘关系与地理分布位置有一定的相关性。当遗传相似系数在0.927时,BG010和BG011聚为一类,表明BG010和BG011亲缘关系较近。Baxter等[30]研究结果显示BG011(Tifdwarf)是BG010(Tifgreen)体细胞变异育成的,说明BG011(Tifdwarf)和BG010(Tifgreen)亲缘关系近。这与本研究结果一致,进一步体现SRAP和SSR分子标记的准确性。总之,本试验中狗牙根遗传多样性结果与前人研究结果有一致性,也有差异性。
传统的形态学鉴定、田间鉴定受环境等因素影响,很难鉴定狗牙根品系。DNA指纹图谱是应用DNA分子标记技术进行PCR扩增构建的DNA电泳图谱。近年来,DNA指纹图谱技术广泛应用于植物品种鉴定[27]。如利用AFLP[31]、SRAP[32]、SSR[33]和ISSR[34]等分子标记构建DNA指纹图谱。狗牙根品种指纹图谱构建研究比较少,刘君等[35-36]和赵琴等[37]用AFLP、SRAP和ISSR分子标记技术构建9个狗牙根品种的DNA指纹图谱;王志勇[38]利用SRAP分子标记技术构建19个狗牙根品种的DNA指纹图谱。本试验用7对SRAP引物和5对SSR引物PCR扩增出28条和24条特征性条带,可分别用于构建35份狗牙根材料的DNA指纹图谱,用于35份狗牙根种质资源的鉴定。
植物染色体倍性鉴定在植物育种中起关键的作用,最常用的植物染色体鉴定方法是流式细胞术,能够快速鉴定植物的染色体倍性水平,特别适用于样品较多时的倍性检测分析,不受细胞所处时期和植物取材部位等限制[39]。许蕾等[40]利用流式细胞计数法鉴定46份鸭茅种质资源的倍性,为鸭茅倍性育种工作提供基本信息。高友汉等[41]应用流式细胞仪鉴定了9个居群蒙古冰草的染色体倍性。本研究使用流式细胞术鉴定出35份狗牙根种质的染色体倍性,其中二倍体1份,三倍体28份,四倍体6份。二倍体是非洲狗牙根,三倍体是杂交狗牙根,四倍体是普通狗牙根,它们属于不同的种,表明狗牙根种质间存在丰富的遗传变异。
随着植物细胞染色体倍性的增加,植物各器官体积一般趋于增大,表现出叶色变深、叶片变厚和茎秆粗壮等[42]。吴彦秋等[43]利用秋水仙素诱导培育的四倍体杜鹃兰植株粗壮,叶片质地较硬,假鳞茎变大,根粗短且数量少。陈敏敏等[44]发现秋水仙素诱导加倍后百合的四倍体气孔保卫细胞明显变大,与四倍体相比二倍体植株变矮,叶片颜色加深并肉质化加厚。在染色体倍性与形态特征差异性方面,本研究中BG035、BG072和BG097为四倍体,BG022为二倍体。与BG022相比,BG035、BG072和BG097的叶片颜色更深,叶片更宽,茎秆更粗壮,这与前人研究结果基本一致。BG011、BG012、BG018、BG025、BG043、BG109和BG125都是三倍体,与BG022相比,这些材料表现植株低矮,叶片小并且细,这与前人研究结果相反。BG011(Tifdwarf)是BG010(Tifgreen)体细胞变异育成的[30]、BG012(Tifeagle)是杂交狗牙根用C0-60γ射线进行辐射诱变育成的[45]。因此,推测导致本研究结果与前人结果相反的原因可能是这些狗牙根种质材料控制形态特征的相关基因发生突变。总之,这些狗牙根种质材料在形态学和染色体倍性方面有一定的关联性。
综上所述,本研究应用FCM、SSR和SRAP分子标记能够充分揭示狗牙根不同种质间存在的遗传差异,可用于狗牙根种质资源的遗传多样性分析、种质鉴定等研究工作,为后续狗牙根新品种选育奠定基础。

