磷酸烯醇式丙酮酸羧激酶1对胃癌细胞生物学行为的影响及相关机制
沈昕草, 朱孝仁, 刘媛媛, 吴晓阳
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属昆山医院临床实验研究中心,江苏 苏州 215300; 3. 江苏大学附属昆山医院胃肠外科,江苏 苏州 215300)
在全球恶性肿瘤中,胃癌发病率占第5位,病死率占第2位[1]。我国胃癌发病率逐年上升,已成为全球胃癌高发地区[2]。胃癌转移患者生存预后较差,无化疗的中位生存时间为3~5个月[3]。胃癌的发生和进展过程复杂,与多种基因的突变和表观遗传学改变相关[4]。
磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PCK)是一种多功能酶,在物种间高度保守,是调节糖异生的关键酶[5]。脊椎动物均含有两种PCK亚型,胞质型PCK1和线粒体型PCK2,二者由不同的基因编码[6]。PCK1位于染色体20q13.31,生理状态下PCK1蛋白主要位于细胞质中,激活时可转运至内质网。PCK1在糖异生、甘油异生和氨基酸合成等生物学过程中发挥重要作用[7],其高表达易引起高血糖症和胰岛素抵抗,既往研究多探究PCK1在2型糖尿病中的发病机制与治疗方案[8-9]。近年来,Montal等[10]研究发现,PCK1在结肠源性肿瘤中呈高表达,抑制其表达可显著降低三羧酸循环活性并抑制细胞周期。但是,PCK1对胃癌细胞增殖和迁移的影响尚不清楚。本研究拟检测PCK1在胃癌细胞中的表达及其调控网络并结合相关功能学实验等,探讨PCK1在胃癌中潜在的生物学作用。
1 材料与方法
1.1 细胞系及试剂
人胃癌HGC-27、AGS细胞由中科院上海生命科学研究院细胞库提供。RPMI 1640、F-12K培养基、胎牛血清、胰蛋白酶均为美国Gibco公司产品;敲低与过表达PCK1慢病毒和空载体购自上海吉凯基因科技有限公司(GENE);5-乙炔基-2′脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒为广州锐博生物技术有限公司产品;Transwell细胞迁移板为美国Corning公司产品;一抗兔抗人PCK1、一抗小鼠抗人β-肌动蛋白均为英国Abcam公司产品;兔抗人蛋白激酶B(AKT)、p-mTOR(Ser2448)、p-Akt(Ser473)、核糖体蛋白S6(S6)、p-S6、真核翻译起始因子-4E结合蛋白1(4EBP1)、p-4EBP1均为美国Cell公司产品;一抗β-微管蛋白、二抗均为中国ABclonal公司产品;BCA蛋白定量试剂盒为美国Thermo Fisher公司产品。
1.2 生物信息学分析
1.2.1 基于数据库分析PCK1表达水平 在R软件(3.3.3版本,用于可视化)中利用ggplot2软件包整合TCGA数据库(http://gepia.cancer-pku/index.html)以及GTEx数据库(https://www.genome.gov/Funded-Programs-Projects/Genotype-Tissue-Expression-Project)样本,分析PCK1在胃癌及癌旁组织中的表达水平,其中胃癌414例,癌旁组织210例。在Oncomine 4.5数据库(https://www.oncomine.org)中查找Cho Gastric Statistics数据集和TCGA Gastric Statistics数据集,Cho Gastric Statistics数据集中有19例胃癌样本和4例癌旁组织样本,TCGA Gastric Statistics数据集中有236例血液、94例胃癌和173例胃癌旁组织样本。生成PCK1转录差异表达图后,分析在胃癌及癌旁组织中PCK1mRNA表达和DNA拷贝数。在人类蛋白质图谱(Human Protein Atlas,HPA)数据库(https://www.proteinatlas.org/)中在线查找胃癌样本的免疫组织化学图,通过比较该数据库中胃癌组织与癌旁组织的PCK1免疫组织化学染色,分析PCK1在胃癌中的表达水平。
1.2.2 PCK1的基因本体论富集分析 在R软件(3.6.3版本,用于统计分析与可视化)中,基于TCGA数据库的胃癌样本,以PCK1mRNA表达值的中位数为界,对低表达和高表达的差异基因进行基因集富集分析(Gene Set Enrichment Analysis,GSEA,https://www.gsea-msigdb.org/gsea/msigdb/index.jsp),以识别胃癌中差异激活的信号通路。
1.3 细胞实验
1.3.1 细胞分组及转染 取处于对数期生长期的HGC-27、AGS细胞(5×104个/孔)接种于6孔板,于37 ℃和5% CO2培养箱中培养。当汇合率达60%~70%时进行转染。将敲低PCK1的细胞分为shPCK1-Seq1组、shPCK1-Seq2组和shC组,分别转染LV-Pck1-RNAi(91486-1)慢病毒、LV-Pck1-RNAi(91488-1)慢病毒和CON313(Hu6-MCS-C8h-gcGFP-Ires-puromycin)阴性对照病毒;将过表达PCK1的细胞分为OE-PCK1组和Vec组,分别转染LV-PFDN5(48826-1)慢病毒和CON335(Ubi-MCS-3FLAG-CBh-gcgfp-IRES-puromycin)阴性对照病毒;转染24 h后,加入2.5 μg/mL嘌呤霉素筛选3 d。shPCK1 Seq1的序列为CCAAGATCTTCCATGTCAA,shPCK1 Seq2的序列为TGGCCAGGATCGAAAGCAA。
1.3.2 CCK-8增殖实验检测细胞生长能力 取“1.3.1”转染后细胞(2×103个/孔)接种于96孔板,分别在培养箱中孵育24、48、72 h;弃培养基,PBS清洗3次;用完全培养基按1 ∶10稀释CCK-8试剂,每孔加入100 μL;孵育1 h,测450 nm处光密度值,并绘制细胞增殖曲线。每组设5个复孔。
1.3.3 EdU细胞增殖实验检测胃癌细胞增殖能力 取“1.3.1”转染后细胞(5×104个/孔)接种于24孔板,在37 ℃和5% CO2培养箱中培养。当汇合率达70%~80%时,用完全培养基按1 ∶1 000稀释EdU溶液,每孔加入300 μL EdU染色液,于培养箱中孵育2 h;加入Appolo染色液(按照说明书配制)避光孵育30 min;细胞核用1×Hoechst-33342染色30 min;于荧光显微镜(日本Olympus公司)下观察。从3个随机视野中选取至少200个细胞来计算每种细胞核内EdU阳性比率。EdU阳性比率(%)=EdU细胞数目/Hoechst细胞数目(同一视野)×100%。
1.3.4 克隆形成实验检测胃癌HGC-27、AGS细胞克隆能力 取处于对数期生长期的HGC-27、AGS细胞(1×103个/孔)接种于6孔板,在37 ℃和5% CO2培养箱中培养10~14 d,直到形成肉眼可见的细胞集落;弃培养基,PBS洗涤2次;4%多聚甲醛固定30 min;PBS洗涤1次;加入“1.3.1”转染后细胞用0.1%结晶紫染色30 min;洗去结晶紫待晾干后,拍照并计算克隆形成数。实验重复3次。
1.3.5 Transwell实验检测胃癌HGC-27、AGS细胞迁移能力 Transwell小室放置在24孔板上,下室加入含有20%胎牛血清的600 μL F-12,上室加入约5×104个细胞重悬在无血清F-12培养基中,细胞培养箱中孵育24 h;用2.5%结晶紫染色30 min;在相位对比显微镜(日本Olympus公司)下随机选择3张染色细胞的显微镜图,并用软件Image J计数细胞。
1.3.6 蛋白质免疫印迹实验检测胃癌细胞中相关蛋白表达水平 取“1.3.1”转染后细胞(5×104个/孔)接种于6孔板中,在37 ℃和5%CO2培养箱中培养。当汇合率达80%~90%时,加入裂解缓冲液置于冰上裂解约30 min;4 ℃行12 000 r/min离心15 min;取上清液行BCA蛋白定量;95 ℃变性8 min;10% SDS-PAGE 80 V电泳30 min,110 V电泳直至蛋白按分子大小完全分离;330 mA转膜120 min,将蛋白转移至PVDF膜;10%速溶脱脂奶粉封闭2 h;小鼠抗人β-肌动蛋白以1 ∶2 000稀释,兔抗人PCK1、p-mTOR、mTOR、p-S6、S6、p-AKT、AKT、p-4EBP1、4EBP1及β-微管蛋白均以1 ∶1 000稀释,4 ℃孵育过夜;TBST冲洗膜3次,每次10 min;二抗以1 ∶1 000稀释,室温孵育2~4 h;采用增强化学发光(ECL)检测系统,用Image J密度分析法定量条带灰度值。
1.4 统计学方法

2 结果
2.1 PCK1在胃癌中的表达情况
基于TCGA数据库分析结果显示,PCK1mRNA在胃癌组织中的表达显著高于癌旁组织(P<0.01,图1)。ROC曲线显示PCK1对胃癌患者预后具有良好的预测效能(图2)。Oncomine 4.5数据库分析结果显示,胃癌组织中PCK1mRNA表达水平明显高于癌旁组织,DNA拷贝数变异高于胃正常组织(P<0.05或P<0.01,图3)。HPA数据库中获得的免疫组织化学染色结果显示,PCK1蛋白表达在癌旁组织中为“+”,在胃癌组织中为“++”(图4)。
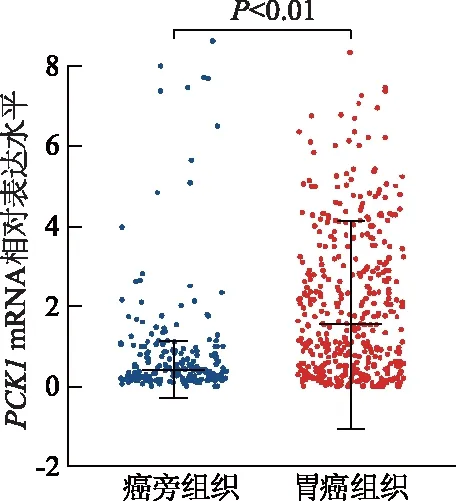
图1 胃癌与癌旁组织中PCK1 mRNA表达水平比较

A:在“Cho”数据子集中胃癌组织与癌旁组织中PCK1 mRNA表达水平比较;B:在TCGA数据库中胃癌组织与胃癌旁组织及血液中DNA拷贝数变异比较;*:P<0.05,与癌旁组织相比;**:P<0.01,与胃正常组织相比

图2 胃癌患者PCK1的诊断性ROC曲线

图4 胃癌组织与癌旁组织中PCK1免疫组织化学染色结果(50×)
2.2 PCK1相关信号通路的富集分析
GSEA(条件:校正后P<0.05;容错率<0.25)显示了MSigDB集合富集(c2.cp.kegg.v6.2.symbols.gmt)的巨大差异。与原发性免疫缺陷、细胞黏附分子、趋化因子信号通路、全身性红斑狼疮、产生IgA的肠道免疫网络及RIGⅠ样受体信号通路相关的基因集在PCK1基因低表达表型中差异富集(图5)。

图5 PCK1基因低表达表型中差异富集的基因集
2.3 敲低PCK1抑制人胃癌HGC-27、AGS细胞增殖和迁移
蛋白质免疫印迹结果显示,与shC组比较,shPCK1-Seq1组和shPCK1-Seq2组HGC-27与AGS细胞PCK1蛋白相对表达水平显著下降(P<0.05或P<0.01,图6)。CCK8实验结果显示,与shC组相比,shPCK1-Seq1组和shPCK1-Seq2组HGC-27与AGS细胞生长能力明显下降(P均<0.01,图7)。克隆形成实验结果显示,与shC组相比,shPCK1-Seq1组和shPCK1-Seq2组HGC-27与AGS细胞增殖能力明显下降(P<0.05或P<0.01,图8)。Transwell实验结果显示,与shC组相比,shPCK1-Seq1组和shPCK1-Seq2组HGC-27与AGS细胞迁移数显著下降(P均<0.01,图9)。由此表明,敲低PCK1抑制HGC-27与AGS细胞生长、增殖和迁移。

*:P<0.05,**:P<0.01,与shC组相比图6 蛋白质免疫印迹实验检测敲低PCK1后HGC-27与AGS细胞中PCK1蛋白表达水平

*:P<0.01,与shC组相比

*:P<0.05,**:P<0.01,与shC组相比

*:P<0.01,与shC组相比;标尺示100 μm
2.4 过表达PCK1增强人胃癌HGC-27、AGS细胞增殖和迁移
蛋白质免疫印迹结果显示,与Vec组比较,OE-PCK1组HGC-27与AGS细胞中PCK1蛋白相对表达水平显著增高(P均<0.01,图10)。CCK8实验结果显示,与Vec组相比,OE-PCK1组HGC-27与AGS细胞生长能力明显增强(P均<0.01,图11)。EdU细胞增殖实验结果显示,与Vec对照组相比,OE-PCK1组HGC-27与AGS细胞增殖能力明显增强(P均<0.05,图12)。Transwell实验结果显示,与Vec对照组相比,OE-PCK1组HGC-27与AGS细胞迁移数量显著增加(P均<0.01,图13)。由此表明,过表达PCK1增强HGC-27与AGS细胞生长、增殖和迁移。

*:P<0.01,与Vec组相比
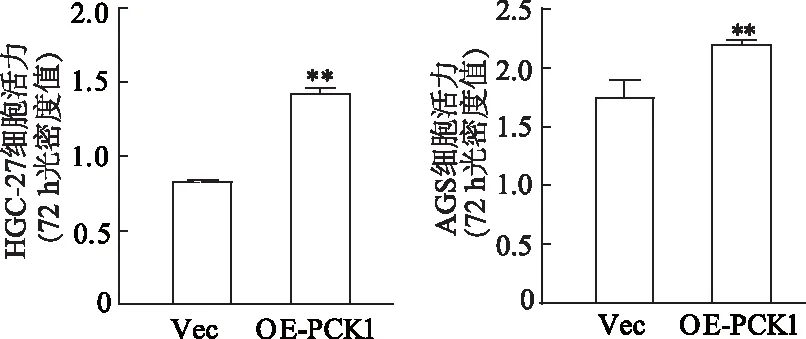
*:P<0.01,与Vec组相比

*:P<0.05,与Vec组相比

*:P<0.01,与Vec组相比;标尺示100 μm
2.5 PCK1参与调控AKT-mTOR信号传导
shRNA敲低PCK1后,蛋白免疫印迹检测结果显示,与shC组比较,shPCK1-Seq1组和shPCK1-Seq2组p-AKT、p-mTOR、p-S6和p-4EBP1相对表达水平显著下降(P<0.05或P<0.01,图14)。外源性过表达PCK1后,蛋白免疫印迹检测结果显示,与Vec组比较,OE-PCK1组p-AKT、p-mTOR、p-S6和p-4EBP1相对表达水平显著升高(P<0.05或P<0.01,图15)。由此提示,PCK1在胃癌中呈高表达,并可能以激酶形式调控AKT-mTOR通路的活化,从而参与调控胃癌细胞的恶性生物学行为。

*:P<0.05,**:P<0.01,与shC组相比
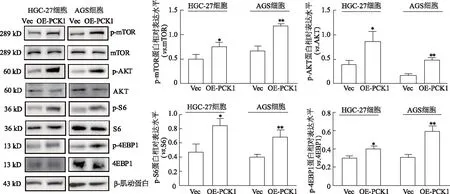
*:P<0.05,**:P<0.01,与Vec组相比
3 讨论
本研究结果显示,PCK1蛋白在胃癌中表达上调,但其高表达的调控机制和作用机制尚不明确,故进行GSEA以识别胃癌中差异激活可能的信号通路;结果显示,原发性免疫缺陷、细胞黏附分子、趋化因子信号通路、全身性红斑狼疮、产生IgA的肠道免疫网络及RIGⅠ样受体信号通路相关的基因集在PCK1基因低表达表型中差异富集。Ma等[11]报道,PCK1能通过糖原代谢途径调节CD8+免疫细胞形成和维持。Guo等[12]报道,孕烷X受体可能通过促进PCK1表达抑制趋化因子信号通路,进而对溃疡性结肠炎发挥保护作用。由此初步提示,PCK1可能通过免疫途径调控胃癌的进展。此外,ROC曲线显示PCK1对胃癌患者预后诊断具有良好的效能。
代谢重编程是肿瘤的典型特征之一[13],PCK1作为糖异生的限速酶,在代谢重编程中起重要作用[14-15]。既往研究表明,在肝脏和肾脏中,PCK1表达量较高,其发挥糖异生酶的作用从而抑制肿瘤细胞生长[15-16]。有研究报道在自身PCK1表达量较低的肺和结直肠中,PCK1表达量增高可促进肿瘤细胞生长,其机制可能与葡萄糖和谷氨酰胺增多有关[10,17]。PCK1高表达可增加细胞中葡萄糖和氨基酸尤其是谷氨酰胺的合成[18],谷氨酰胺可以衍生为谷氨酸,在蛋白质合成、转氨反应、营养物质交换等方面发挥作用,从而促进肿瘤细胞的生长[19]。本研究相关数据库结果提示,PCK1在胃正常细胞中相对表达较低,而在胃癌细胞中明显升高;此外,体外细胞功能学实验证实,在胃癌细胞中敲低PCK1可抑制胃癌细胞生长,反之则增强。Yamaguchi等[20]研究证实,在缺氧条件下PCK1可通过对核苷酸库的维持,主要促进还原羧化作用产生嘧啶前体天冬氨酸,进而促进肿瘤细胞迁移。本研究通过Transwell实验也证实,PCK1对胃癌细胞的迁移有促进作用。由此说明,PCK1可能是促进胃癌细胞生长与迁移的一个关键基因。
此外,本研究还发现,PCK1可能通过参与诱导AKT-mTOR通路调控胃癌的恶性生物学行为。研究表明AKT-mTOR信号通路是正常生理细胞和癌细胞生长的主要调节通路之一,该通路在肿瘤中经常被激活,目前已证实与胃癌、卵巢癌和乳腺癌等多种肿瘤的发生及不良预后相关[21-24]。Montal等[10]提出PCK1促进消化道肿瘤细胞的生长与增殖,并可能与AKT-mTOR通路激活有关。PCK1可以通过谷氨酰胺的分解与α-酮戊二酸的产生激活mTOR通路[25],提高细胞氨基酸、葡萄糖、核苷酸和脂质代谢[26];这些代谢途径可以为癌细胞的大分子合成提供原料[27]。本研究结果显示,敲低PCK1后胃癌细胞中AKT、mTOR以及其下游蛋白包括S6和4EBP1磷酸化水平显著降低;反之,过表达则升高。S6以及4EBP1对蛋白质合成起重要作用,其磷酸化水平可用于评价mTOR通路的活化程度,磷酸化水平越高说明AKT-mTOR通路活性越高。由此说明,PCK1可以促进AKT-mTOR信号通路的活化。
综上所述,PCK1在胃癌中呈高表达且与患者预后相关,其高表达可促进胃癌细胞生长、增殖与迁移,这可能与PCK1调控AKT-mTOR信号通路的活化有关,但具体分子机制有待进一步研究。

