趋化因子CCL5在非小细胞肺癌中的表达及生物学功能探究*
吴颖 高蔚 张佑扬 翁婷 李晶晶
(徐州医科大学附属宿迁医院·南京鼓楼医院集团宿迁医院呼吸科,江苏 宿迁 223800)
肺癌在我国的发病率有逐年上升的趋势,其早期检出率较前明显增加,治疗手段除了手术切除、放化疗之外,靶向治疗及免疫治疗在临床中也广泛应用,但是中晚期肺癌患者仍然预后不良,5年存活率仅仅15.9%,绝大多数患者死于肿瘤的复发与原发病灶的转移[1],因此尽早阻断肿瘤的转移对改善患者预后很重要。趋化因子是具有诱导趋化活性的一大类细胞因子,在肿瘤的转移过程中发挥了极其重要的作用,一定程度上参与了乳腺癌,肾癌,胃癌等肿瘤的发生与发展[2-4]。CCL5又称RANTES,是CC类趋化因子的一种。CCL5一般由活化的T淋巴细胞合成并分泌,对于包括T细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞等在内的多种细胞具有复杂而巨大的生物学影响。除趋化效应之外,CCL5也是一种重要HIV抑制因子,可通过与CCR5受体结合,减弱人原代巨噬细胞的单核细胞迁移,抑制HIV-1病毒体外复制[5]。CCL5还能增强肿瘤细胞浸润与转移能力,可能是通过介导免疫细胞定向趋化作用实现的[6],但其在肺癌中的作用尚未证实。因此,在本研究中我们首先在TCGA数据库中筛选出在非小细胞肺癌(Non-small cell lung cancer,NSCLC)中高表达的基因-CCL5,同时以原发性NSCLC患者为考察对象,利用免疫组化法及RT-PCR分别检测NSCLC患者肿瘤组织及血标本中CCL5的表达,并进一步分析其表达与患者临床病理特征和总生存时间相关性,从而阐明其在NSCLC中表达及临床意义。此外,通过敲低CCL5后探究对肺癌细胞的增殖、迁移能力影响而进一步阐明其可能潜在分子机制。
1 资料与方法
1.1 一般资料 NSCLC患者肺癌组织取材于徐州医科大学附属宿迁医院2014~2021年住院的72例肺癌患者,其中男54例,女18例,年龄30~75岁,中位年龄为59.5岁,术后病理明确诊断为非小细胞肺癌,手术前未经过放化疗等其它抗肿瘤治疗,无合并疾病。健康对照组36例,男21例,女15例,年龄37~70岁,中位年龄57.1岁。均为体检中心体检合格的健康人。对72例患者进行常规术后随访(采用电话沟通或门诊随诊方式),随访截止时间2021年7月,随访时间18~162个月,研究期间死于肺癌相关疾病者为完全数据。纳入标准:①经病理证实的非小细胞肺癌患者。②年龄≥18岁。③TNM分期为Ⅰ-Ⅲ期。④接受手术治疗。⑤患者随诊史及基本资料完整。排除标准:①其他类型肺癌患者及肺转移癌。②年龄<18岁。③原位癌、Ⅳ期肺癌、未接受手术治疗患者。
1.2 主要的试剂及仪器 CCL5兔抗人单克隆抗体(上海拜力生物科技有限公司);SP免疫组化试剂盒、DAB显色试剂盒(中杉金桥科技公司);反转录试剂盒、SYBR荧光定量试剂(日本TAKARA公司);人支气管上皮细胞株16HBE和人非小细胞肺癌细胞株A549、H358(中国科学院上海细胞库);小牛血清、DMEM培养液(美国Gibco公司);Trizol(总RNA抽提试剂)、脂质体Lipofect 3000、实时荧光定量聚合酶链反应(quantitativereal-time PCR,qRT-PCR)试剂盒(美国Invitrogen公司);Transwell培养小室(美国赛默飞公司)。
1.3 免疫组织化学法检测CCL5在肺癌组织和癌旁组织中的表达水平 离体组织石蜡切片4 μm,脱蜡,水化,热修复;阻断内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗3次;滴加鼠抗人CCL5单克隆抗体过夜,PBS冲洗;滴加聚合物辅助剂和辣根酶标记的羊抗兔IgG工作液,孵育30 min(37℃);显色、复染、脱水、树胶封固镜检。应用PBS作为阴性对照。在显微镜下仔细观察CCL5在组织中的表达。
1.4 CCL5免疫组织化学染色结果评价 免疫组化结果根据CCL5染色强度及细胞阳性比例两方面进行结果的评定。免疫组化定量分数=染色强度分数×阳性细胞比例分数。
1.5 血液中CCL5的含量 取血清上清液,依照说明书提取总RNA,检测OD值计算RNA浓度,将纯度良好的RNA按照试剂盒使用说明逆转录为cDNA,行RT-PCR扩增。以GAPDH作为内参基因,进行相关引物序列的设计,分析各基因Ct值,计算CCL5的相对倍比关系,该实验需要计算3次平均值。
1.6 RT-PCR检测肺腺癌细胞系A549、 H358及正常人支气管上皮细胞16HBE中CCL5的表达 人支气管上皮细胞株16HBE和人非小细胞肺癌细胞株A549均在37℃,含5%CO2恒温培养箱中培养,取对数生长期的细胞用于试验。用RT-PCR检测A549、 H358细胞系和人正常支气管上皮细胞中CCL5mRNA的表达。
1.7 RNA干扰和体外增殖能力检测培养细胞,取生长良好的A549细胞用于转染。贴壁后按照Lipofectamine 3000说明书进行细胞转染,将siRNA-NC、siRNA-CCL5转染至A549细胞中,分别作为对照组(siRNA-NC组)、实验组(siRNA-CCL5组)。转染后将两组细胞放入培养箱中继续培养待后续实验。RT-PCR法检测两组CCL5mRNA水平,评估转染效果。取对数生长期两组A549细胞,消化、离心、悬浮,取出所需细胞的总量接种在96孔板中。分别将转染质粒后24、48、72 h细胞每孔加入CCK-8(10 μL)+DMEM(90 μL),继续在培养箱中培养2 h,使用酶标仪测量细胞在450 nm处的光密度(opticaldensity,OD)值,并绘制72 h生长曲线。
1.8 Transwell实验检测细胞迁移、侵袭能力 迁移试验:取对数生长期两组细胞,胰酶消化,重悬,然后以4×104细胞数置于上室培养,下室加入含胎牛血清的DMEM培养基,培养48 h后擦去未迁移细胞,用甲醇固定迁移细胞,并用结晶紫染液染色。随机选择3个区域显微镜下计数迁移细胞数目。侵袭试验:提前用固定浓度的Matrigel凝胶包被Transwell小室上室底部膜,其它步骤同迁移实验。
1.9 统计学分析 采用SPSS 22.0软件进行统计学处理,采用双侧检验,t检验确定组间差异是否有统计学差异; CCL5与临床、病理因素关系的评估采用双侧t检验;NSCLC患者PFS与CCL5关系的分析采用Kaplan-Meier法,Cox比例风险回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 预测NSCLC中CCL5表达差异 本研究应用癌症基因组图谱(The Cancer GenomeAtlas, TCGA)和GTEx数据库中癌症相关数据分析在肺癌中转录过程中CCL5表达情况。共纳入肺癌患者969例(483例肺腺癌样本和486例肺鳞癌样本),女性427例,男性542例;年龄22~86岁,年龄中位数59岁。T分期:T1期251例,T2期428例,T3期260例,T4期30例;N分期:N0期211例,N1期368例,N2期305例,N3期85例;M分期,M0期832例,M1期137例。分析结果显示CCL5基因TPM(Transcripts Per Million,每千个碱基的转录每百万映射读取的Transcripts)表达水平在肺癌的腺癌和鳞癌均有增加,见图1。
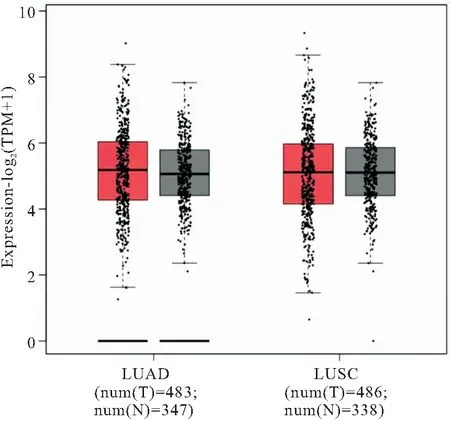
图1 CCL5mRNA表达在肺腺癌和鳞癌中增加
2.2 CCL5的免疫组化表达情况 结果显示CCL5蛋白在肺癌组织中广泛表达,其中中度阳性和强阳性的NSCLC患者48例(66.7%),弱阳性和阴性表达的患者24例(33.3%),而癌旁正常组织中度阳性和强阳性的NSCLC患者12例(16.7%),弱阳性和阴性表达的患者60例(83.3%),两者比较差异有统计学意义(P<0.01),见图2。
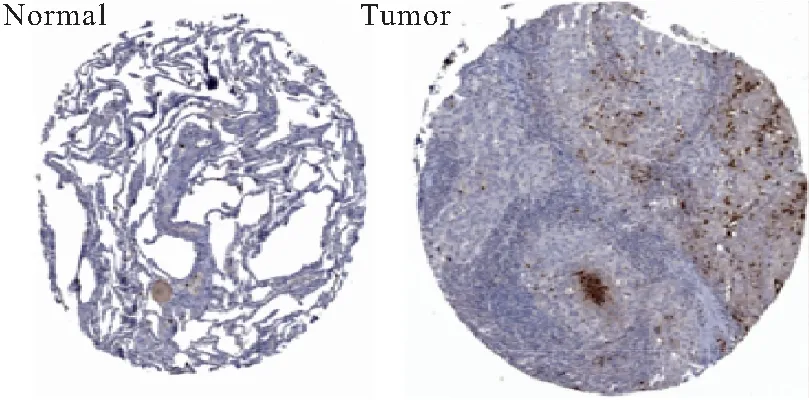
图2 NSCLC癌组织和癌旁组织中CCL5的显示结果
2.3 CCL5mRNA在血清中的表达 NSCLC患者血清中CCL5mRNA的表达量为(2.07±0.35),高于健康对照组的(1.02±0.81)(P<0.01)。见图3。
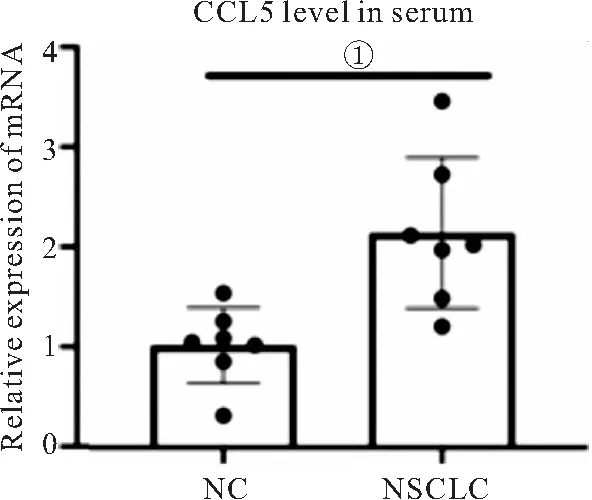
图3 CCL5在血浆中的mRNA表达水平
2.4 NSCLC组织中CCL5的表达与临床病理特征的关系 根据CCL5表达情况,将NSCLC患者分为高表达组48例(66.7%)和低表达组24例(33.3%),分析CCL5表达水平与NSCLC患者临床病理特征的相关性。结果显示,CCL5高表达与淋巴结转移显著相关(P=0.019),同时CCL5表达可能与肿瘤临床阶段相关(P=0.033)。CCL5表达水平高低与患者性别、年龄、组织分化、病理分型都无相关性(均P>0.05),见表1。
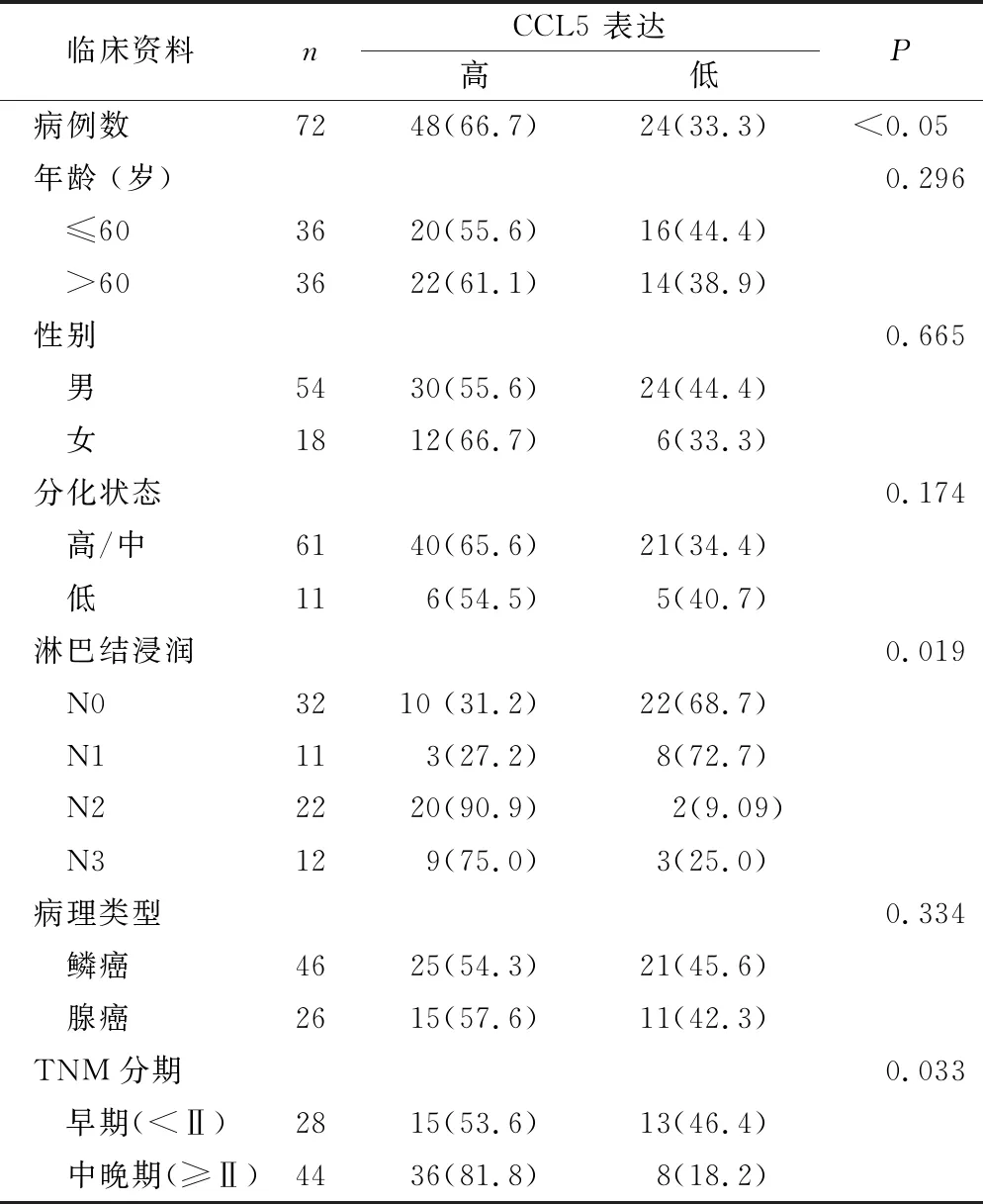
表1 NSCLC患者组织中CCL5的表达与患者临床病理特征的关系[n,n(×10-2)]
2.5 血清CCL5mRNA表达水平与预后的关系 采用Kaplan Meier生存曲线分析血清CCL5mRNA与NSCLC患者预后的相关性。72例NSCLC患者,从高到低排列CCL5mRNA表达水平,依据中位数的数值(1.63以上为高表达)将患者分为高表达组(CCL5 High,n=47)低表达组(CCL5 Low,n=25)。结果表明,CCL5mRNA表达与NSCLC患者的PFS相关(P<0.01),CCL5低表达者的PFS优于高表达者(P<0.01),见图4。
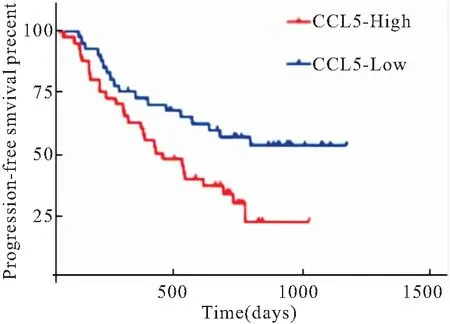
图4 血清CCL5mRNA的表达与患者预后的相关性分析
2.6 组织中CCL5高表达提示NSCLC患者预后不良 采用Cox多因素比例风险模型评估组织中CCL5表达与临床病理特征对NSCLC总生存的预测作用。结果显示,CCL5表达可作为NSCLC的独立预后因素之一,见表2。
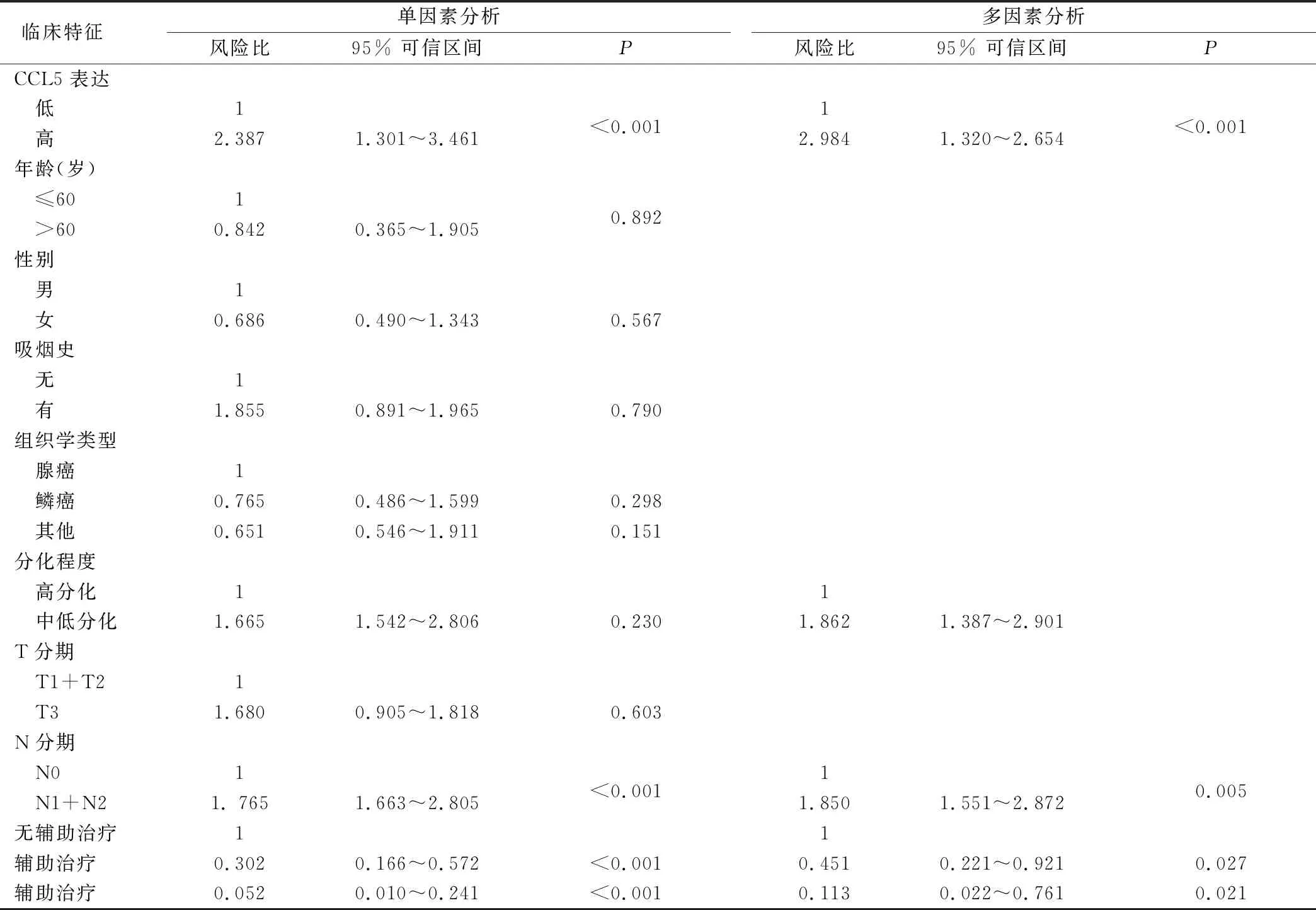
表2 单因素、多因素Cox回归模型分析影响NSCLC患者生存的临床病理因素
2.7 干扰CCL5抑制A549细胞的体外增殖、侵袭、迁移 为进一步探究CCL5在NSCLC中的生物学功能,我们首先在肺癌细胞及气管上皮细胞HBE中检测CCL5的mRNA表达水平,结果发现CCL5在肺癌A549、H358中细胞较正常上皮细胞中高表达,见图5A。同时选取高表达CCL5的肺癌细胞株A549行干扰质粒siRNA-CCL5瞬时转染,同时行质粒的干扰效果验证,与对照组相比,siRNA-CCL5转染组内CCL5mRNA表达水平明显降低[(0.73±0.08)vs(0.21±0.06)]。CCK8实验提示转染siRNA-CCL5的A549细胞在24、48、72 h时OD值小于siRNA-NC组,差异有统计学意义(P<0.01),见图5B; Transwell迁移实验显示,siRNA-CCL5组 迁移平均细胞数为(252±13)个,高于siRNA-NC组(105±10)个,P<0.01,见图5C、D。侵袭实验显示对照组侵袭平均细胞数为(198±15)个,高于实验组(98±11)个(P<0.01),见图5E、F。上述结果提示CCL5敲低后A549细胞增殖 、迁移、侵袭能力均受到抑制。
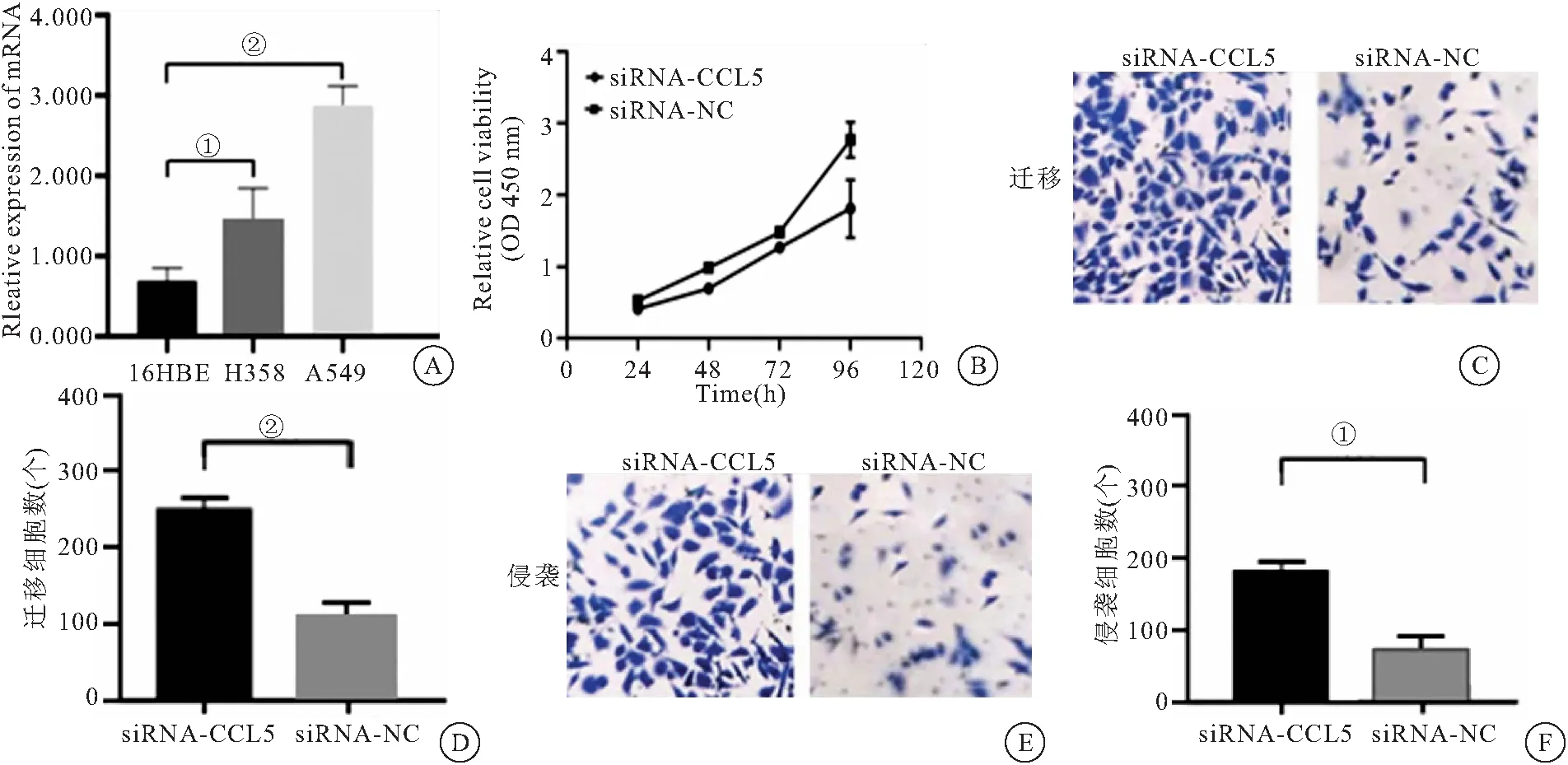
图5 CCL5在肺癌A549细胞中的生物学功能
3 讨论
随着医学研究领域的发展,识别有效的分子生物标志物对于肺癌的早期诊断和精准治疗具有非常重要意义。趋化因子与肿瘤发生及进展有一定相关性,它可以与靶细胞表面受体结合从而激活下游信号肽,促进肿瘤细胞的迁移和增殖。在肿瘤微环境的稳定、肿瘤血管生成、肿瘤耐药等方面发挥重要作用[7]。因此正确评估肿瘤微环境中的细胞因子和趋化因子谱,可提高我们对肿瘤免疫应答状态的认识,并极有可能发现癌症早期筛查的生物标志物。在巨噬细胞、单核细胞和特定类型的肿瘤细胞表面均有CCL5表达,它可部分调控肿瘤细胞的增殖和凋亡过程,主要通过与体内多种基因相互作用[8-9]。Aldinucci等[10]指出在血液系统、消化系统恶性肿瘤的发病中CCL5-CCR5通路发挥重要作用,与肿瘤的进展有关 ;Marjorie等[11]研究证实CCR5/CCL5轴相互作用影响肿瘤微环境,促进胰腺癌细胞的迁移和侵袭;Naike等[12]指出CCL5参与了淋巴瘤的进展过程。但CCL5蛋白表达在肺癌的研究目前相关研究报道极少。
本研究用免疫组化方法检测72例NSCLC患者与60例癌旁组织中CCL5蛋白表达情况,提示CCL5蛋白在肺癌组织中有高水平表达,而在正常组织中仅为弱阳性,甚至阴性表达。CCL5高表达与患者年龄、性别、肿瘤分型、大小无关,CCL5的阳性表达率与淋巴结转移、临床分期有显著相关性,说明CCL5与NSCLC的生长及侵袭密切相关,可能在NSCLC的转移与病情进展中发挥着一定的作用。有研究发现CCL5 mRNA在肝癌组织中呈现高表达,与肝癌的进展有关,且同期细胞实验证明巨噬细胞和成纤维细胞分泌CCL5促进肿瘤相关细胞的增殖或募集[13];Mio等[14]研究显示乳腺癌患者原发病灶、血液、转移灶、受侵犯的淋巴结中均高表达CCL5/CCR5,并且 CCL5高表达与肿瘤侵袭性、患者预后有明显关联,这提示CCL5在肝癌和乳腺癌的进展中起着关键性的作用。结合本研究结果,CCL5在NSCLC中也发挥一定作用。
本研究结果提示NSCLC患者血清中CCL5mRNA的表达量均高于健康对照组,提示其可能在NSCLC的发生发展中起一定的促进作用。本文还进行了CCL5表达高低与患者预后的K-M生存分析,结果显示高表达CCL5mRNA患者的生存期更短,预后更差。Cox多因素比例风险模型评估提示CCL5表达可作为NSCLC的独立预后因素之一。有研究表明,乳腺癌患者肿瘤组织和血清中CCL5的含量是乳腺癌患者的独立预后因子,并且血清中CCL5的含量可以作为乳腺癌疾病进展的实验室诊断指标[15-18],CCL5或许能成为治疗乳腺癌的靶点,并且前列腺癌患者中,高表达CCL5的前列腺癌患者肿瘤的侵袭性明显增强,CCL5的表达水平可能为判断患者预后的一个指标[19-21],与本文研究结果一致。
为探讨CCL5对肺癌细胞生物学功能的影响,本研究敲低CCL5后检测细胞增殖能力,结果发现转染siRNA-CCL5后A549细胞增殖能力明显降低,侵袭和迁移能力也降低,因此推测下调CCL5可抑制A549细胞增殖,侵袭,延缓转移,发挥抑癌作用,这与Gaili等[22]研究结果相似,该研究显示在特定类型的乳腺癌中,乳腺癌细胞能够自分泌CCL5促进肿瘤细胞的增殖、侵袭,下调CCR5和CCL5表达水平,可促进乳腺癌细胞的凋亡。部分基础实验也证明巨噬细胞和成纤维细胞分泌CCL5能促进肿瘤细胞的增殖,增加侵袭能力[23-25]。
4 结论
综上所述,本研究证实CCL5在NSCLC中高表达,并与患者T分期、N分期、M分期呈正相关,与预后呈负相关,CCL5可能同样在NSCLC发生发展过程中发挥重要的作用,有望成为一种潜在的新型肺癌肿瘤标志物用于临床诊断,并指导临床对NSCLC的预后判断,提高治疗的有效率。其临床意义值得进一步深入研究。

