全反式视黄酸在牛前脂肪细胞增殖及分化中的作用
范云珲,逯 璐,许秋实,郑晰丹,杨 童,徐 闯
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163000)
当奶牛分娩前脂肪堆积过多就会导致其抑郁、厌食、高酮血症和产奶量显著减少[1]。人类和啮齿动物肥胖模型表明,脂肪组织发育取决于脂肪细胞肥大和增生[2-3]。脂肪细胞的数量被认为是由于前脂肪细胞的增殖及分化为成熟脂肪细胞至关重要[4]。尽管已有研究证明它们与奶牛饮食诱导的正常脂肪发育密切相关,但对调节牛前脂肪细胞增殖及分化的细胞和分子机制知之甚少。
维生素A是一种对脂肪组织生物学和能量稳态具有显著影响的营养素[5]。膳食维生素A和维生素A原以视黄酯的形式储存或在细胞内代谢维生素A的主要活性形式—视黄酸(RA)[6]。研究表明,RA可通过影响哺乳动物的肥胖来调控发育与其他生化过程,包括脂肪细胞分化(脂肪合成)、脂肪分解和脂肪酸氧化[7]。RA有2种亚型,全反式RA(ATRA)和9-顺式RA,它们通过与类视黄醇受体及其异二聚体结合,通过基因组和非基因组机制对细胞过程产生影响[8]。至少在非反刍动物中,脂肪组织是仅次于肝脏的维生素A储存和代谢的器官,也是ATRA作用的主要目标组织[9]。在人类中,ATRA具有抑制肥胖的作用[5]。此外,ATRA通过抑制脂肪合成作用并直接增加了脂肪分解,降低了成熟3T3-L1脂肪细胞中的三酰甘油含量[10]。ATRA的这些分子机制是否与牛前脂肪细胞的增殖和分化具有生物学相关性尚不清楚。
ATRA是维生素A的代谢中间体,有证据表明ATRA可诱导许多干细胞的发育[11]。同时,ATRA也是正常脂肪发育的重要调节因子,可调控多种干细胞的增殖和分化。本研究旨在探讨ATRA调节牛前脂肪细胞增殖及分化的调控机制,为脂肪组织的发育提供理论基础。
1 材料与方法
1.1 细胞系与主要试剂本试验所用ATRA和DMEM/F12培养基购自Sigma公司;CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4、CDK6、PPA-RG、C/EBPA及Ki67一抗、HRP标记二抗购自Abcam公司;PI/RNase染色缓冲液(BD Biosciences)、EdU、MTS、检测试剂盒购自碧云天生物技术公司。
1.2 牛脂肪细胞培养根据先前发表的方法分离健康过渡奶牛的前脂肪细胞[12]。脂肪组织(1 g)用Ⅰ型胶原酶 (1 g/L;Sigma-Aldrich,St.Louis,MO)消化,通过40 μm细胞过滤器过滤,将基质血管细胞以800×g离心10 min,以将原代前脂肪细胞与基质血管细胞分离。通过裂解缓冲液去除所得细胞沉淀中残留的红细胞,依次以800×g离心10 min。弃去上清液后,将所得沉淀重悬于含有DMEM/F12、10%胎牛血清和1%青霉素/链霉素的基础培养基(BCM)中,在37℃、5% CO2下保持24 h。更换培养基以去除未贴壁的细胞和组织碎片,每48 h更换1次培养基。在6孔板中培养细胞,并达到70%~80%汇合(转染前细胞的密度为2×106)。将细胞分为2组:第1组正常培养,为对照组;第2组使用ATRA处理细胞48 h,ATRA终浓度为20 nmol/L,为ATRA组。
1.3 MTS分析按照MTS试剂盒说明书检测牛前脂肪细胞的增殖活性。细胞以每96孔板2×104个细胞的密度接种。对于接种均匀密度的前脂肪细胞,在第0 天将ATRA与DCM1分化培养基一起加入,然后再孵育8 d。每48 h补充1次含有ATRA的培养基。对于成熟的脂肪细胞,在分化8 d后将ATRA与BCM培养基一起加入,然后再孵育48 h。使用酶标仪检测其在490 nm处的吸光度,每组至少重复3次。结果表示为对照组的百分比。向细胞中加入ATRA,使其浓度为20 nmol/L,处理45 h。随后,向每孔细胞中加入20 μL MTS试剂,37℃孵育3 h。使用酶标仪检测其在490 nm处的吸光度,每组至少重复3次。ATRA使用DMSO溶解,对照组添加相同浓度的DMSO。
1.4 细胞周期分析接种前脂肪细胞于6孔板,待其贴壁后,通过无血清饥饿12 h,然后如上所述进行处理。向细胞中加入ATRA,使其浓度为20 nmol/L,处理45 h。在处理结束时,通过胰蛋白酶消化收集细胞,离心,用PBS洗涤,4℃于70%乙醇中固定过夜。固定细胞用PBS洗涤,0.5 mL PI/RNase染色缓冲液室温下染色15 min。通过流式细胞术(BD FACSCalibur;BD Biosciences)分析染色的细胞。
1.5 Western blot检测相关蛋白表达提取细胞总蛋白并测定蛋白浓度。滴注蛋白样品于SDS-PAGE凝胶进行电泳。将凝胶中的蛋白电转至PVDF膜上。将PVDF膜于5%脱脂乳溶液中室温封闭1 h,随后用以下一抗4℃孵育过夜:Ki67、CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4、CDK6、PPARγ和C/EBPα;β-actin作为内参。用TBST洗尽一抗,HRP标记二抗(1∶10 000)室温孵育1 h。再用TBST洗涤5次,用显影剂处理PVDF膜,在化学发光显影器中成像。用Image Pro Plus5.0软件进行图像分析。
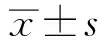
2 结果
2.1 ATRA对牛前脂肪细胞增殖活性的影响MTS结果表明,ATRA组的增殖活性显著降低(图 1A)。Ki67(细胞增殖的标志物)蛋白及EdU检测结果显示,与对照组相比,用ATRA处理后,前脂肪细胞的增殖活性显著减少(图 1B、C)
2.2 ATRA对牛前脂肪细胞的细胞周期的影响检测了细胞周期蛋白D1(CCND1)、2、3、CCNE1和细胞周期蛋白依赖性激酶2(CDK2)、4、6的表达。结果显示,ATRA能够显著减少上述蛋白的表达水平(图 2),说明ATRA能够减缓前脂肪细胞从G1期到S期的转变,减慢细胞周期进程。

A.MTS分析ATRA对牛前脂肪细胞增殖活性的影响;B.牛前脂肪细胞中Ki67蛋白表达(ATRA处理48 h);C.EdU分析牛前脂肪细胞增殖(ATRA处理48 h);**.表示与对照组相比差异极显著(P<0.01)。下同
A、B.Western blot检测细胞周期蛋白(CCND1、CCND2、CCND3、CCNE1)的蛋白水平;C、D.Western blot检测细胞周期蛋白依赖性激酶(CDK2、CDK4、CDK6)的蛋白水平
2.3 ATRA对牛前脂肪细胞增殖进程的影响结果显示,ATRA能够减少牛前脂肪细胞中S期细胞的比例,并升高了处于G1期细胞的比例(图3),说明ATRA能抑制前脂肪细胞的增殖。

A.流式细胞术检测细胞周期进程变化水平;B.细胞活力与细胞周期的关系
2.4 ATRA对牛脂肪细胞分化的影响检测了ATRA对脂肪细胞分化的影响。如图4A所示,ATRA抑制了脂肪细胞的分化。通过Western blot方法检测脂肪细胞中分化相关蛋白表达水平,如图4B所示,与对照组相比,添加ATRA组PPARγ和C/EBPα蛋白表达水平显著降低。进一步证实了体内试验,说明了ATRA在脂肪细胞中的减少了分化作用。
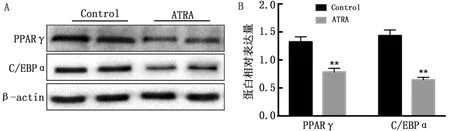
A.牛前脂肪细胞分化相关蛋白的免疫印迹;B.牛前脂肪细胞分化相关蛋白相对表达水平
3 讨论
肥胖奶牛在产犊前后食欲下降明显,在围产期发生代谢紊乱的风险较高,导致其相比于正常体况的奶牛出现更严重的负能量平衡状态[13]。ATRA的抗肥胖作用在人类和啮齿动物肥胖模型中得到了很好的证明[14-16]。本研究表明,ATRA可能通过以下2种方式抑制脂肪细胞的发育:抑制脂肪细胞增殖和分化,防止脂肪细胞中的脂质积累。本研究发现了ATRA在牛前脂肪细胞中调控增殖及分化,从而推测其参与了脂肪细胞的发育过程。
ATRA对癌细胞、成骨细胞和成肌细胞增殖和分化的影响已得到充分证实[17-19]。细胞增殖依赖于细胞周期的4个不同阶段(G0-G1、S、G2和M),G1到S期主要通过几种细胞周期蛋白依赖性激酶的连续激活来调节。这些蛋白质以细胞周期阶段特异性方式表达。例如,CDK4和CDK6活性是细胞通过G1期所必需的,而CDK2在G1晚期和S期有活性[20]。本研究中,ATRA抑制细胞周期从G1到S期的转变以及CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4和CDK6蛋白表达的降低表明ATRA抑制了细胞增殖。
当用ATRA处理时,MCF-7人乳腺癌细胞的S期细胞比例显著降低[21],与本研究结果一致。在融合生长停滞的3T3-L1前脂肪细胞中,脂肪合成刺激在细胞进入终末分化阶段之前启动有限的克隆扩增,包括脂质积累[22-23]。脂肪生成和正常脂肪细胞功能都需要转录因子C/EBPα[24],它通过诱导脂肪细胞分化的主要调节因子PPARγ的表达来促进脂肪生成[25-26]。在这方面,转录因子C/EBPα和PPARγ的高表达对脂肪细胞的分化具有重要作用[27]。结果显示,ATRA下调了牛前脂肪细胞中分化指标PPARγ和C/EBPα的表达,这与在3T3-L1脂肪细胞中观察到的结果一致[28-29]。因此,现有数据表明ATRA可能对脂肪生成及发育产生重要影响。
综上所述,本试验在细胞水平探讨了ATRA影响牛前脂肪细胞增殖及分化的机制,证实了维生素代谢产物在脂肪组织的发育过程中发挥的重要作用。

