酒花内生菌转化β-月桂烯合成芳樟醇和香叶醇
张逸凡,付冬梅,薛兆茹,王越
(大连工业大学生物工程学院,辽宁 大连 116034)
β-月桂烯是一种重要的功能性单萜,在合成香料及其它功能性物质方面有很大的经济潜力[1-2],是香料产业中具有价值的可再生化学品的原料和中间体[3-4]。在自然界中,β-月桂烯主要存在于酒花雌花果、月桂叶、马鞭草和柚子皮等,在酒花雌花果中,β-月桂烯含量丰富,最高可达70%[5],在其它的植物中含量较少,在柚子皮中含量仅为20.7%[6]。
β-月桂烯分子内有两个共轭双键和一个单一双键,容易发生氧化、聚合、异构、重排等化学反应,如化学合成薄荷、柠檬醛、香茅醇、香叶醇、橙花醇和芳樟醇,这些含氧衍生物更具商业价值。与化学方法相比,微生物也能够进行氧化、还原、水解反应、脱水以及形成C-C键和几种降解反应[7],并且反应条件温和、区域和立体选择性好、环境友好且获得的产品为“天然”产品[8-9]。因此近年来,研究者一直尝试对β-月桂烯进行微生物转化。
然而由于β-月桂烯及其含氧衍生物对细胞的毒性较高[10],因此对β-月桂烯生物转化的微生物报道较少,只有黑曲霉(Aspergillus niger)[11]、假单胞菌(Pseudomonas)[12-13]、红球菌(Rhododicus)[5]和德式梭菌(Alcaligenes defragrans)[14]对β-月桂烯生物转化的报道。Yamazaki等[11]利用 Aspergillus niger转化 β-月桂烯,主要产物为2-甲基-6-乙烯-7-辛烯-2,3-二醇、6-甲基-2-乙烯基-S-庚烯-1,2-二醇和7-甲基-3-亚甲基-6-辛烯-1,2-二醇。Esmasili等[12-13]用 Pseudomonas putida PTCC 1694转化β-月桂烯,主要产物为二氢芳樟醇(4.1%)、顺式β-二氢松油醇(67.6%)和芳樟醇(25.8%)。用Pseudomonas aeruginosa转化30 mmol/L β-月桂烯 36 h,生成了二氢芳樟醇(79.5%)与 2,6-二甲基辛烷(9.3%),总转化率为88.8%。Thompson等[5]将来源于酒花的Rhododicus erythropolis MLT1对β-月桂烯进行生物转化,产生了50 μmol/L的香叶醇,底物转化率为2%。这些好氧菌通过引入分子氧,使单萜烯发生了β-氧化反应[14-15]。另外有研究者报道厌氧菌也可以转化β-月桂烯为含氧衍生物。Brodkorb等[16]利用Alcaligenes defragrans对β-月桂烯进行水合反应,转化为0.22 mmol/L芳樟醇和0.20 mmol/L香叶醇等含氧衍生物,分离提取出芳樟醇水合-异构酶,该酶可以在厌氧环境中将β-月桂烯转化为芳樟醇和香叶醇,酶活性为9.228 nKat/mg。
在以β-月桂烯为底物进行微生物转化的几种氧化物中,芳樟醇是一种广泛用于香料和食品行业的单萜醇,是目前全球应用量最大的香料[17]。虽然可以从天然产物中提取,但提取率低、价格高[18],所以其主要来源为基于天然衍生的α-蒎烯的工业化学合成[19]。如果通过微生物对酒花中β-月桂烯选择性羟基化直接生成芳樟醇,将来源丰富的可再生原料转化成高经济价值的香料将是非常理想的。
本文从新鲜的酒花雌花果中筛选能够以β-月桂烯为碳源的内生菌,研究其对β-月桂烯转化产物组成和直接生成芳樟醇条件;以β-月桂烯含量丰富的酒花油为原料生物转化合成芳樟醇,以期提高酒花的经济价值。
1 材料与方法
1.1 材料与试剂
野生鲜啤酒花雌花果:采自秦皇岛,采集时间为2019年10月,花序成熟。β-月桂烯(90%β-月桂烯、8%柠檬烯、1%β-蒎烯):润友化学有限公司;浓缩酒花油:河南省帕洛丁贸易有限公司。初筛培养基:β-月桂烯4.08 g/L、硝酸钠8.5 g/L、琼脂粉20 g/L;葡萄糖蛋白胨酵母麦芽粉(glucosepeotoneyeastandmalt,GPYM)培养基:葡萄糖10 g/L、蛋白胨5 g/L、麦芽浸粉3 g/L、酵母浸粉 3 g/L、pH5;营养琼脂(nutrient agar,NA)培养基:蛋白胨10 g/L、牛肉膏3 g/L、氯化钠5 g/L;溶菌肉汤(luria-bertani,LB)固体培养基:胰蛋白胨 10 g/L、酵母提取物5 g/L、氯化钠10 g/L、琼脂20 g/L。其他所用试剂均为国产分析纯。
1.2 仪器与设备
气相色谱仪(福立GC9790Plus):浙江福立分析仪器股份有限公司;气相色谱-质谱联用仪(Agilent7890A/5975C):美国 Agilent公司;毛细管色谱柱(DB-FFAP,30 m×0.25 mm,膜厚 0.25 μm):中科院大连化物所;SPME专用磁力加热搅拌器(PC-620D)、固相微萃取手柄(SPME-GC PK1):北京康林科技有限责任公司;固相微萃取萃取头(50/30 μm DVB/CAR/PDMS):美国Supelco公司。
1.3 试验方法
1.3.1 酒花内生菌的筛选
1.3.1.1 雌花果的表面灭菌
将新鲜雌花果超声洗涤,25℃风干,用75%乙醇浸泡10 min,无菌水冲洗3次,用4%次氯酸钠浸泡干酒花10 min,无菌水冲洗3次。将最后一次冲洗的无菌水涂布至LB固体培养基,30℃下培养24 h,若LB培养基上无菌落出现,则可以开始筛选内生菌[20]。
1.3.1.2 内生菌的初筛
将表面灭菌的干酒花在无菌条件下用研钵碾碎,加入10 mL无菌水,继续研磨出浸出液,将浸出液倒入LB液体培养基中,30℃下200 r/min富集培养24 h。吸取200 μL菌液涂布至初筛培养基上。挑出生长菌株,在LB固体培养基划线纯化单菌落,接种至试管斜面保藏。
1.3.1.3 内生菌的复筛
挑出初筛保藏的菌株,接入至100 mL复筛培养基中,30℃下200 r/min振荡培养18 h后,每天加入0.15 g β-月桂烯,连续培养5 d。利用固相微萃取-色谱-质谱(solid-phase microextraction-gas chromatography-mass spectrometer,SPME-GC-MS)检测发酵液中挥发物质。
1.3.1.4 菌株鉴定
提取筛选菌株的DNA,利用1492R和27F通用引物进行16S rDNA聚合酶链式反应(polymerase chain reaction,PCR)扩增。由吉林省库美生物技术有限公司测序,在NCBI数据库中进行基本局部比对,采用MEGA 7.0软件构建系统发育树。
1.3.2 内生菌株转化β-月桂烯
将筛选的菌株接种至GPYM培养基中,加入10 g/L β-月桂烯。在30℃、200 r/min条件下培养6 d,取发酵液,8 000 r/min离心20 min后取上清液。通过SPMEGC-MS检测上清液中β-月桂烯转化产物[12]。
1.3.3 细胞破碎转化
将1.3.2离心沉淀菌体用无菌生理盐水冲洗3次后,加入 2 mmol/L 二硫苏糖醇(dithiothreitol,DTT)后,600 W超声5 s,停留3 s,再超声20 min进行细胞破碎。取上清液30 mL,加入10 g/L β-月桂烯。30℃、200 r/min振荡反应3 h,检测胞内转化物质。
1.3.4 好氧与厌氧转化
按照方法“1.3.2”将筛选所得菌株接入GPYM培养基中进行生物转化,厌氧培养时在具塞250 mL三角瓶中通入0.05 MPa 99.99%氮气1 min,排出瓶中空气。在30℃、200 r/min条件下培养6 d,8 000 r/min离心20 min,取上清液。通过SPME-GC-MS检测上清液中转化物质。
1.3.5 酒花油的生物转化
将筛选的菌株接种至GPYM培养基中,加入0.2g/L~17.6g/L商品酒花油。在30℃、200r/min条件下培养6 d,取发酵液,8 000 r/min离心20 min,取上清液。通过SPME-GC检测上清液中酒花油转化产物。β-月桂烯的转化率计算公式如下。

式中:W为β-月桂烯的转化率,%;C产物为生成芳樟醇或香叶醇的浓度,g/L;C月为投入β-月桂烯的浓度,g/L。
1.3.6 SPME-GC-MS分析方法
将发酵液在4℃、8 000 r/min条件下离心10 min。吸取5 mL上清液,移入固相萃取样品瓶中,加入2 g NaCl促进样品挥发。将样品瓶放在固相萃取仪上,温度为60℃,转速为170 r/min。推出50/30 μm DVB/CAR/PDMS萃取头吸附30 min后,插入GC进样口解吸5 min[21]。
GC条件:色谱柱为DB-FFAP毛细管色谱柱(30m×0.25 mm×0.5 μm),载气为氮气;进样口温度 240℃,柱箱初温50℃,以10℃/min升至80℃,1.5℃/min升至147℃,15℃/min升至205℃,保持10 min,分流比为10∶1。
MS条件:离子源温度220℃,电离方式为电子轰击(electron impact,EI),电子能量 70 eV,离子源温度230℃;扫描范围m/z 100~420。
1.4 数据处理
试验重复3次,使用Execl软件处理数据,SPSS 25软件分析误差,MEGA 7.0构建系统发育树。
2 结果与分析
2.1 酒花内生菌筛选
研究表明,可转化β-月桂烯的菌株为黑曲霉、铜绿假单胞菌、恶臭假单胞菌、德式梭菌[5,11-14]等,其中好氧菌Pseudomonas putida PTCC 1694对β-月桂烯生成芳樟醇的转化率为25.8%,而厌氧菌Alcaligenes defragrans的转化率为0.7%,研究结果显示,好氧菌的转化效率高于厌氧菌。考虑到后期产物的制备,好氧条件易于控制,因此筛选菌株时采用好氧条件。
按照方法“1.3.1”对新鲜啤酒花雌花果内生菌进行初筛。由于初筛培养基以β-月桂烯为碳源,菌株生长少,且菌落非常小,因此只挑选出4株,分别命名为Z1、Z2、Z3和Z4。将4株菌进行复筛,通过SPME-GC-MS检测发酵液中单萜氧化物含量,结果见表1。
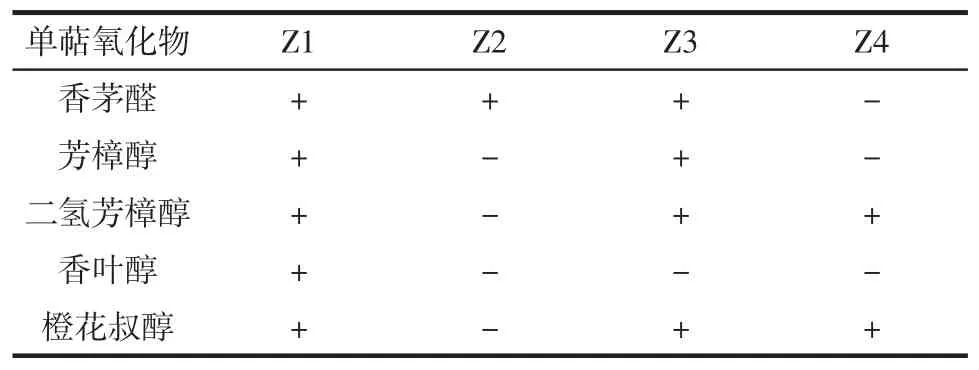
表1 筛选4株菌转化β-月桂烯生成单萜氧化物Table 1 Biotransformation of β-myrcene to monoterpene oxides by four strains
从表1可看出,筛选出的Z1、Z2、Z3和Z4菌株,均可将β-月桂烯转化成单萜氧化物。只有Z1将β-月桂烯转化生成了0.37 mg/L芳樟醇和0.21 mg/L香叶醇,这两种物质是食品和医药行业中应用量最大的香料[17]。同时这种菌株还将β-月桂烯样品中少量的柠檬烯(含量8%)和β-蒎烯(含量1%)转化成紫苏醇、紫苏醛、金合欢醇和橙花醇等香气优秀的氧化物(未显示)。因此选择Z1作为转化β-月桂烯的菌株。
2.2 菌株的鉴定
根据NCBI的对比结果,Z1菌16S rDNA(序列号:ON502447)和Pantoea ananatis的同源性为98.2%,Z1菌株的系统发育树如图1所示。Z1菌株16S rDNA序列与Pantoea ananatis更接近,属于泛菌属。Z1菌株的菌落形态和生理生化结果分别见图2和表2。

表2 Z1菌株生理生化鉴定Table 2 Physiological and biochemical identification of strains Z1
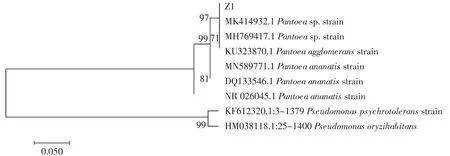
图1 Z1菌株基于16S rDNA基因的系统发育树Fig.1 Phylogenetic tree of strain Z1 and related type species based on the 16S rDNA gene sequences

图2 Z1菌株的菌落形态Fig.2 Colony morphology of strain Z1
由图2可知,Z1菌株菌落在GPYM固体培养基上平坦,不透明,表面湿润、生长较快,为革兰氏阳性菌,从形态学上符合Pantoea ananatis菌落特征。从表2可以看出,Z1菌株的生理生化特征符合Pantoea ananatis,结合图1中16S rDNA系统发育树,将Z1命名为Pantoea ananatis Z1。
2.3 P.ananatis Z1对β-月桂烯的转化条件
由于从啤酒花雌花果中筛选的内生菌P.ananatis Z1属于兼性厌氧细菌[23],因此考察Z1菌在有氧和厌氧两种环境下对β-月桂烯的转化。按照方法“1.3.4”将Z1菌接入GPYM培养基中进行厌氧培养转化。细胞破碎方法参照“1.3.3”,利用SPME-GC-MS检测转化产物,结果见表3。

表3 P.ananatis Z1菌株转化条件Table 3 Biotransformation conditions of strains P.ananatis Z1
由表3可知,有氧条件下,P.ananatis Z1菌株在胞外将β-月桂烯转化生成了芳樟醇、二氢芳樟醇和香叶醇等单萜氧化物;胞内酶对β-月桂烯转化产物种类很少,只有少量二氢芳樟醇和顺式氧化芳樟醇。在厌氧条件下,P.ananatis Z1可以生长,但对β-月桂烯没有转化活性。
β-月桂烯及其含氧衍生物对细胞的毒性较高[10],能转化利用β-月桂烯的微生物很少。目前报道能将β-月桂烯生物合成芳樟醇或香叶醇的微生物只有假单胞菌(Pseudomonas putida PTCC 1694)[12-13]、红球菌(Rhododicus erythropolis)[5]和德式梭菌(Alcaligenes defragrans)[14],但这3株菌的转化条件和途径不同。P.putida PTCC 1694和R.erythropolis需在有氧条件下,通过引入分子氧,使单萜烯发生β-氧化反应[5]。研究表明,Rhododicus erythropolis转化β-月桂烯的关键酶是酰基辅酶A脱氢酶(acyl-CoA dehydrogenase)[5]。而Alcaligenes defragrans是在厌氧环境下生成芳樟醇脱水酶-异构酶(linalool dehydratase-isomerase),在该双功能酶的催化下,β-月桂烯水合生成芳樟醇和香叶醇,同时香叶醇和芳樟醇互相异构化[14,24]。
表3结果表明,P.ananatis Z1是在有氧条件下将β-月桂烯合成芳樟醇和香叶醇,推测其转化途径可能和R.erythropolis类似,其中催化的关键酶还需要进一步分离纯化鉴定。
2.4 β-月桂烯浓度对转化的影响
有研究表明,高浓度的β-月桂烯对微生物细胞有毒害作用[25],影响微生物转化能力并抑制其生长[26],这也是微生物转化单萜生成单萜醇的难点之一。为了考察β-月桂烯浓度对P.ananatis Z1菌株转化影响,在GPYM培养基中加入不同浓度的β-月桂烯,按照方法“1.3.2”转化β-月桂烯,结果如图3所示。

图3 β-月桂烯浓度对单萜醇生成量的影响Fig.3 Effects of β-myrcene concentrations on the production of monoterpene alcohols
由图3可知,在一定范围内,随着β-月桂烯浓度的升高,P.ananatis Z1转化β-月桂烯生成单萜醇的浓度增加,当β-月桂烯浓度为14.1 g/L时,单萜醇的生成量最高,主要是二氢芳樟醇,生成量为2.06 mg/L,而芳樟醇仅为0.89 mg/L,香叶醇为1.09 mg/L。β-月桂烯浓度超过14.1 g/L,生成的单萜醇浓度下降。结果表明,β-月桂烯浓度对P.ananatis Z1转化有影响,超过14.1 g/L,会对菌株的生长与转化产生抑制。Esmaeili等[12]利用Pseudomonas putida PTCC 1694转化4.62 g/L β-月桂烯,芳樟醇产量为1.05 g/L,转化率为22.73%。与此相比,P.ananatis Z1对β-月桂烯生成芳樟醇和香叶醇的转化率仅为0.007%和0.016%,转化效果并不理想。初步分析原因,可能是β-月桂烯不溶于转化体系,与细胞接触少,导致转化率低。
为了提高β-月桂烯在转化体系中的溶解度,通常会在反应体系中加入共溶剂[12]。在P.ananatis Z1的转化体系中分别加入0.1g/L和1.0g/L甲醇、乙醇和丙二醇作为共溶剂,考察共溶剂对转化率的影响,结果见表4。
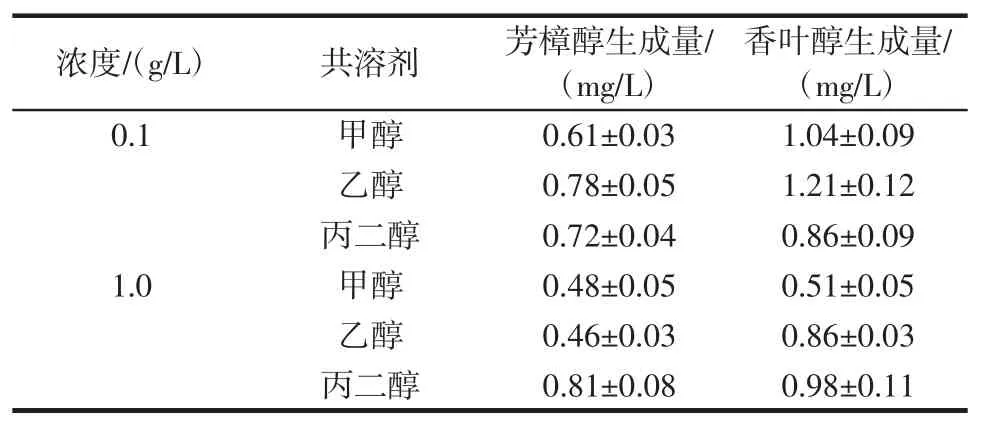
表4 不同浓度共溶剂对芳樟醇和香叶醇生成量的影响Table 4 Effects of different concentrations of cosolvent on the production of linalool and geraniol
由表4可知,改变共溶剂成分与增加共溶剂的浓度均不能提高芳樟醇和香叶醇的合成量,说明P.ananatis Z1菌株对β-月桂烯的低转化率并不是因底物溶解度低导致。
廉长盛等[21]曾利用啤酒花内生菌Pseudomonas oryzihabitans F0-1催化酒花油中柠檬烯,生成α-松油醇浓度为(97.54±3.34)mg/L,比转化分析纯柠檬烯提高了10.6倍。因此本文认为酒花油中一些萜烯类物质可起到促进转化作用。酒花油是啤酒花雌花果中腺体分泌的一种精油,质量占1.5%~2.5%,β-月桂烯含量丰富,最高可达70%[5]。因此为了提高P.ananatis Z1菌对β-月桂烯的转化率,继续考察该菌株对酒花油中β-月桂烯的转化。
2.5 P.ananatis Z1对酒花油β-月桂烯的转化
啤酒花在中国种植广泛,以酒花油中的β-月桂烯为原料对其进行生物转化,其来源广泛且可再生,微生物转化产物被认为是天然产物[3-4]。利用SPME-GC-MS方法检测了商品酒花油成分,结果见表5。

表5 商品酒花油单萜物质成分Table 5 Monoterpene constituents of commercial hops oil
由表5可知,一般提取酒花油中,芳樟醇占比不超过1%[27],而商品酒花油中芳樟醇占3%,表明该酒花油经过浓缩。将P.ananatis Z1菌株接入GPYM培养基中,加入不同浓度酒花油。酒花油中β-月桂烯浓度为61.86 g/L,丙二醇为900.50 g/L,若按照图3中β-月桂烯浓度加入酒花油,则转化体系中丙二醇浓度为5.80 g/L~305.55 g/L。前期加入共溶剂试验结果显示,丙二醇浓度超过10 g/L,对P.ananatis Z1菌生长有明显抑制作用。所以选择添加酒花油浓度为0.4 g/L~17.6 g/L,使转化体系中β-月桂烯浓度为0.02 g/L~1.08 g/L。按照方法“1.3.5”在30℃、200 r/min的条件下转化24 h,测定芳樟醇和香叶醇的浓度。由于酒花油含有芳樟醇和香叶醇,将没有接入P.ananatis Z1菌株的含有酒花油的GPYM培养基作为空白,结果见图4。

图4 P.ananatis Z1对酒花油β-月桂烯转化Fig.4 Biotransformation of β-myrcene in hops oil by strains P.ananatis Z1
由图4可知,当酒花油中浓度低于0.9 g/L,转化产物主要为二氢芳樟醇0.05 g/L,酒花油中的芳樟醇和香叶醇浓度减少,表明香叶醇异构化芳樟醇,再被还原成二氢芳樟醇[16];当酒花油浓度超过3.5 g/L,芳樟醇、香叶醇生成量开始增加;酒花油浓度为14.1 g/L时,转化量最高,芳樟醇和香叶醇的浓度分别为0.52 g/L和0.09 g/L,酒花油β-月桂烯转化率为60.8%和10.6%,二氢芳樟醇生成量为0,表明芳樟醇停止了还原转化为二氢芳樟醇的途径,转而异构化香叶醇。比较图3和图4可知,在底物仅为β-月桂烯时,芳樟醇生成量为0.89 mg/L,香叶醇生成量为1.09 mg/L,对β-月桂烯的转化率为0.006%和0.007%,转化率很低;当底物为含有β-月桂烯的酒花油时,芳樟醇生成量为0.52 g/L,香叶醇生成量为0.09 g/L,和底物仅为β-月桂烯比较,芳樟醇和香叶醇的转化率分别提高了10 248和1 483倍,比文献[12]报道的Pseudomonas putida PTCC 1694的转化率22.73%提高了2.67倍。
Z1菌对酒花油中β-月桂烯的转化率大幅度提高的原因可能是酒花油中的一些主要成分对β-月桂烯的转化起到关键促进作用,打破了β-月桂烯、芳樟醇和香叶醇之间的反应平衡,促使β-月桂烯大量转化成芳樟醇和香叶醇。有文献报道[28],芳樟醇能破坏细菌细胞膜的完整性,增加细胞膜的通透性,胞内物质向外泄漏,导致细胞死亡。同时芳樟醇还能抑制呼吸链脱氢酶活性,引起细胞呼吸代谢活力降低,从而导致胞内代谢紊乱,抑制菌体生长。酒花油中含有3%芳樟醇和0.1%香叶醇,可能是酒花油中的芳樟醇部分破坏了细胞膜磷脂双分子层结构,增加了细胞通透性和疏水性。由于β-月桂烯具有疏水性,诱导细胞生成转化酶的机会增多。同时芳樟醇会促使细胞膜蛋白暴露在反应体系溶液中,使β-月桂烯作为底物增加与酶的亲和性。Thompson等[5]认为β-月桂烯作为底物对红球菌Rhodococcus erythropolis MLT1生成香叶醇有诱导作用,但是芳樟醇对P.ananatis Z1转化β-月桂烯的作用以及代谢调控需要进一步研究。
3 结论
从新鲜啤酒花雌花果中筛选到一株能够转化β-月桂烯生成芳樟醇和香叶醇的菌株,经生理生化与分子学鉴定,将该菌株命名为Pantoea ananatis Z1。该菌可以在胞外有氧条件下将β-月桂烯转化生成芳樟醇与香叶醇,推测其代谢途径和Pseudomonas putida PTCC 1694的代谢途径类似。当β-月桂烯浓度为14.1 g/L时,生成芳樟醇为0.89 mg/L,香叶醇为1.09 mg/L,对β-月桂烯的转化率为0.006%和0.007%。
利用P.ananatis Z1转化酒花油中的β-月桂烯,芳樟醇和香叶醇生成量达0.52 g/L和0.09 g/L,转化率为60.8%和10.6%,比转化单一底物β-月桂烯的产量提高了579倍和84倍,芳樟醇和香叶醇的转化率分别提高了10 248和1 483倍。初步认为β-月桂烯和芳樟醇的共同存在促进了P.ananatis Z1对β-月桂烯的转化。针对β-月桂烯和芳樟醇协同作用对P.ananatis Z1转化β-月桂烯途径的影响,下一步将提取该菌代谢β-月桂烯的关键酶,研究β-月桂烯和芳樟醇对其性质影响,以提出一种生物转化的机制,并开发一种可规模化生产芳樟醇和香叶醇的生物催化工艺。

