藻菌共生体对养猪废水中抗生素和常规污染物的去除效果研究
徐长江,赵永军,刘 娟*,刘 丽
(1.浙江工业大学 药学院,浙江 杭州 310014;2.嘉兴学院 生物与化学工程学院,浙江 嘉兴 314001)
抗生素被广泛用于预防和治疗人类感染传染病和兽医治疗,是一种具有抗细菌和抗真菌作用的活性物质,尤其在畜牧业能够促进牲畜生长和预防传染性疾病[1]。然而,抗生素在人体和动物体内的吸收率往往不足50%[2]。大部分抗生素直接经人或动物的消化系统,以原形或代谢产物形式随尿液和粪便排到环境中。国内外的调查研究表明,在地表水、土壤及沉积物等环境介质中广泛地检测到各类抗生素的存在。据报道,养猪废水中抗生素含量较高,土霉素浓度为0.73~354.0 mg/kg,金霉素浓度为0.68~139.4 mg/kg,磺胺嘧啶浓度为0.68~98.8 mg/kg[3]。如果养猪废水未经任何处理直接排入环境中,废水中残留的抗生素将会对环境和人类健康产生巨大的潜在危害,环境中的抗生素会沿食物链进入人体,使人体产生耐药性,危害人体生命健康[3];会改变土壤中细菌的抗药性[4];对水生动植物产生毒效应[5]等。由于抗生素具有较高的水溶性和较低的生物可降解性,故很难将其从环境中去除。因此,加强抗生素去除相关的基础与应用研究,开发去除抗生素的高效、绿色技术已迫在眉睫。
微藻是一类单细胞光合生物的总称,包括蓝藻及真核藻类,具有生长速率快、对环境无污染等特点。利用微藻进行废水处理,既能高效去除抗生素、氮磷等营养物质,又能降低能耗。目前,关于微藻去除废水中抗生素的有效性已被证实,相对于传统的化学、物理去除方法,该生物技术具有处理效率高、成本低、不需要任何吸附剂或者催化剂,且可以有效同步去除水体中的营养物TP、TN 等优点[6]。当微藻接触抗生素时,藻细胞为了生存会通过一系列反应清除有毒抗生素。在此期间,藻细胞可通过吸附、积累、生物降解等途径去除废水中的抗生素[7]。周楠等[8]研究发现,微藻对头孢拉定的去除率达到70%。Gojkovic 等[9]用一种耐热性小球藻(Chlorella sorokiniana)对氧氟沙星12 d 的去除率达到65%,普通小球藻(Chlorella vulgaris)对土霉素12 d 的去除率为69%。最近研究发现,菌类微生物能够强化微藻对废水中抗生素和常规污染物的去除效果。Liu 等[10]构建的微藻-细菌颗粒淤泥系统对四环素和磺胺嘧啶的去除率分别高达79.0%和94.0%。Bodin 等[11]证实了真菌也可以强化微藻对抗生素的去除效果,小球藻-黑曲霉菌共生体对废水中雷尼替丁具有显著的去除效果,去除率为(50±19)%,而真菌对雷尼替丁的去除率仅为(20±13)%。本研究通过构建小球藻-灵芝菌共生体,研究其对模拟养猪废水中盐酸土霉素(OTC)、盐酸环丙沙星(CPFX)、磺胺二甲嘧啶(SM2)三类抗生素和营养物质TP、TN 的去除效果。同时,分析藻菌共生体的生长性能和光合性能,为藻技术在废水处理领域的有效应用提供一定的理论依据。
1 材料与方法
1.1 实验材料
HZ-9310KBG 恒温摇床培养箱,湖南迈达仪器有限公司;SW-CJ-2D 型超净工作台,苏州净化设备有限公司;YXQ-LS-75Sll 立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;UV-6000PC 紫外可见分光光度计,上海精密仪器仪表有限公司;AP-C100 掌上水体叶绿素荧光仪,北京易科泰生态技术有限公司;1260 型高效液相色谱仪,美国Agilent 公司。
实验所用的小球藻藻种购于中国科学院武汉水生生物研究所淡水藻种库,编号为FACHB-8。灵芝菌菌种购于中国普通微生物菌种保藏管理中心,编号为5.765。BG11 培养基、PDW 培养基均购于海博生物技术有限公司。葡萄糖、尿素、NaHPO4·2H2O、KH2PO4、CaCl2、MgSO4均 为 分 析纯,购于国药集团。盐酸土霉素(OTC)(CAS 号:2058-46-0)、盐酸环丙沙星(CPFX)(CAS 号:93107-08-5)、磺胺二甲嘧啶(SM2)(CAS 号:57-68-1)、浓硫酸、丙酮、Ag2SO4等均为分析纯。
1.2 藻菌共生体的构建
小球藻在BG11 培养基扩大培养至藻密度为107 个/mL,培养条件:25 ℃,光照强度为200 μmol·m-2·s-1,保持12 h 光照/12 h 黑暗的光周期。灵芝菌在PDW 培养基中摇成约0.5~1 cm 直径的真菌球,培养条件:温度为(28±0.5)℃,转速为160 r/min,黑暗条件。
藻菌共生体干重接种比为藻:菌=10:1,在超净工作台取小球藻泥和灵芝菌菌球加入模拟养猪废水(由葡萄糖、尿素、NaHPO4·2H2O、KH2PO4、CaCl2、MgSO4配置而成,COD:1424 mg/L,TN:348 mg/L,TP:42 mg/L)中,置于恒温摇床培养箱中25 ℃黑暗处理12 h,转速为160 r/min,使小球藻完全吸附到灵芝菌菌球上。
1.3 养猪废水净化
分别以藻菌共生体、小球藻、灵芝菌处理模拟养猪废水,实验组及空白组均设置三组平行。实验步骤:在超净工作台操作,向配置好的200 mL模拟养猪废水中加入盐酸土霉素,紧接着投入50个藻菌共生体。同时,向200 mL 模拟养猪废水中分别加入与藻菌共生体同等干重的小球藻和灵芝菌菌球。将藻菌共生体净化体系、小球藻单一培养净化体系和灵芝菌菌球单一培养净化体系分别置于恒温摇床培养箱中,在25 ℃下进行实验,保持12 h 光照/12 h 黑暗的光周期,转速为160 r/min。空白组不加入任何生物材料,仅为含盐酸土霉素的模拟养猪废水。盐酸环丙沙星与磺胺二甲基嘧啶净化操作同上。其中,3 种抗生素的初始浓度均为60 mg/L,COD 含量为第1 天、第3天、第5 天取样检测,其余指标均为每天检测。
1.4 分析方法
1.4.1 叶绿素a(CHL-a)浓度测定
取4 mL 藻液或者一个藻菌共生体,离心(8000 r/min)处理10 min,弃去上清液,向沉淀中加入90%体积分数的丙酮,使用旋涡混合器混匀,使沉淀完全溶于丙酮,放置于4 ℃下黑暗环境处理24 h。24 h 后将样品离心(8000 r/min)处理10 min,取上清液用紫外可见光分光光度计分别测量630 nm、645 nm、663 nm 和750 nm 处波长的吸光度,用90%丙酮做空白对照。叶绿素a(Chl-a)浓度计算见式(1)。
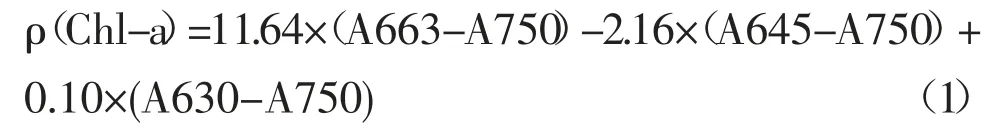
式(1)中:ρ(Chl-a)为叶绿素a 浓度,mg·L-1;A663、A750、A645、A630 分别为对应波长下测得的样品吸光度数值。
1.4.2 碳酸酐酶活性测定
采用Wilbur-Anderson 电量法测定。取4 mL小球藻液离心10 min,转速为4000 r/min,将离心收集的沉淀用去离子水洗涤3 次,然后悬浮在4 mL预冷的1 mmol/L 二硫苏糖醇(DTT)和1 mmol/L EDTA 的0.010 mol/L Tris 缓冲液(pH 为8.3)中洗涤2 次。再次离心10 min,转速为4000 r/min,将离心收集的沉淀悬浮在4 mL 预冷的上述Tris 缓冲液(pH 为8.3)中,再迅速加入4 mL 冰浴CO2饱和蒸馏水后,记录pH 从8.3 下降到7.3 所需的时间。为保持实验过程的温度控制在4 ℃,整个过程在冰浴中进行。碳酸酐酶活性的计算公式见式(2)。
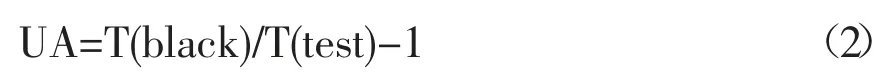
式(2)中:UA 为每个细胞的活性单位(units of activity),表示酶活性;T(black)为反应体系中未加藻细胞的空白对照pH 下降所需的时间;T(test)为反应体系中加藻细胞时pH 下降所需的时间。
1.4.3 小球藻光合性能测定
使用AquaPen 手持式叶绿素荧光测量仪进行测量。测量前取4 mL 小球藻进行暗适应10 min,然后将其倒入测量仪配备的比色皿中,再放入叶绿素荧光测量仪,测量快速叶绿素荧光动力学(OJIP)参数。
1.4.4 总氮、总磷和化学需氧量测定
按照HJ 636—2012 的方法,用碱性过硫酸钾消解紫外分光光度法测定模拟养猪废水中的总氮(TN);按照GB 11893—89 的方法,用钼酸铵分光光度法测定模拟养猪废水中的总磷(TP);按照GB 11914—89 的方法,用重铬酸钾法测定模拟养猪废水中的化学需氧量(COD)。
1.4.5 抗生素含量测定
取4 mL 样品离心(8000 r/min)处理10 min,将上清液过0.45 μm PES 滤膜,滤液用于抗生素含量测试。
其中,盐酸土霉素采用高效液相色谱法测定,液相条件为:色谱柱:ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm);洗脱流动相:乙腈与0.01 mol·L-1磷酸二氢钠的体积比为20%:80%;流速为1 mL·min-1;柱温为35 ℃;检测波长为355 nm;进样量为20 μL。
盐酸环丙沙星与磺胺二甲嘧啶采用分光光度法测定,分别于波长277 nm 与260 nm 处以纯水做参比测定吸光度。其中,盐酸土霉素标准曲线:y=0.0336x+1.4813,R2=0.9999;盐酸环丙沙星标准曲线:y=13.979x+0.5682,R2=1;磺胺二甲嘧啶标准曲线:y=16.811x+0.4622,R2=1。
2 结果与讨论
2.1 藻菌共生体对抗生素的去除效果
3 种抗生素的初始浓度均为60 mg/L,小球藻、灵芝菌和藻菌共生体对3 种抗生素的去除效果见图1。由图1(a)可知,藻菌共生体对OTC 的去除效果较好,第5 天去除率高达(89.93±1.70)%;其次是小球藻,去除率为(60.41±2.21)%;灵芝菌去除率为(50.06±2.75)%。由图1(b)和(c)可知,小球藻、灵芝菌和藻菌共生体对SM2 和CPFX 无明显的去除效果。
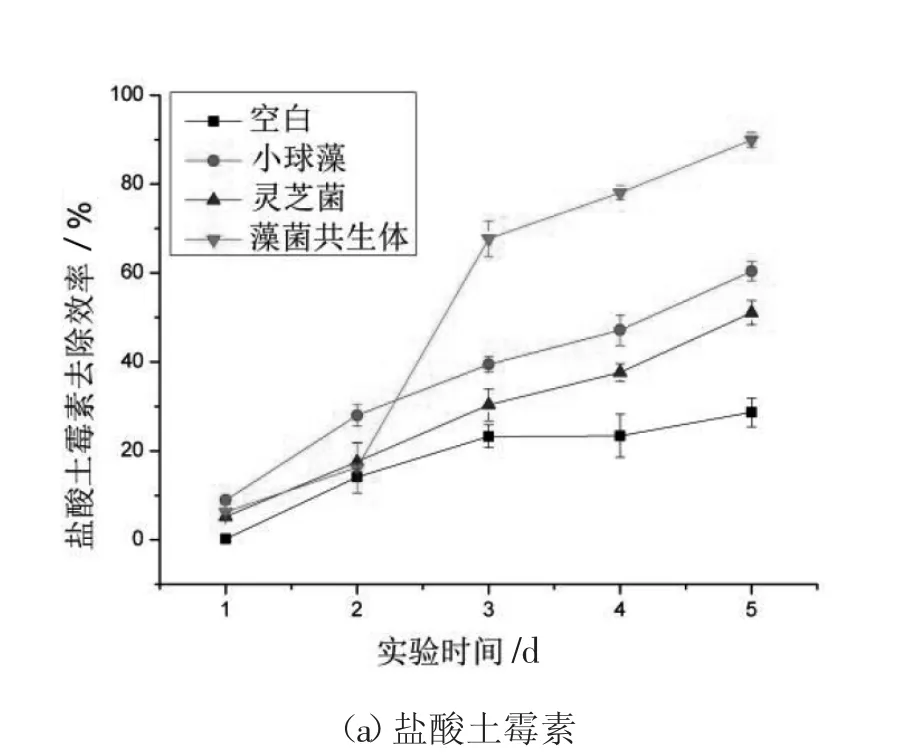
图1 抗生素去除效果Fig.1 Removal effect of antibiotic
由图1(a)可知,在第1 天到第2 天、第3 天到第5 天,藻菌共生体对OTC 去除率的斜率与小球藻和灵芝菌单独对OTC 去除率的斜率基本一致,可知藻菌共生体刚开始在OTC 的胁迫下不能进行良好的相互作用和物质交换,因此初始阶段去除率不高。结合CHL-a、CA 活性和OJIP 光合性能参数可知,在第3 天藻菌共生体对OTC 的去除率突然增长可能是发生了生物降解。随着OTC浓度的降低,去除率也随之降低,推测有两种可能:一是OTC 的胁迫作用降低后,对藻菌共生系统的危害性降低,故后者也并不急需将OTC 进行生物降解;二是OTC 的浓度降低后,抗生素与藻菌共生系统的比例也随之改变,而这个比例影响抗生素降解。除了生物降解还有另一种可能机制,Zhang 等[12]发现诺氟沙星的降解率与小球藻和Fe(Ⅲ)有关,分别测定了诺氟沙星在小球藻、Fe(Ⅲ)和小球藻加Fe(Ⅲ)中的光解情况,实验结果与本实验藻菌共生系统对OTC 的降解情况基本一致,诺氟沙星在含有藻类的溶液中通过藻类产生的羟基自由基氧化而快速降解,这一过程在Fe(Ⅲ)的协同下会加快,OTC 的单独降解机理基本为光解,普通小球藻和灵芝菌可能产生促光解的基团或者自由基,而藻菌共生系统有可能产生促进光解过程的更强基团或自由基。
2.2 藻菌共生体对常规污染物的去除效果
图2 为含OTC 的模拟养猪废水中COD、TN和TP 的去除率,在第5 天藻菌共生体对TP、TN、COD 的去除效率分别是(76.42±1.51)%、(74.41±1.68)%、(46.05±9.30)%。通常来说,微藻单独去除营养物的能力不如藻菌共生体,形成共生体后,真菌通过消耗有机物产生CO2供微藻用于光合作用。同时,微藻又释放氧气促进真菌生长,并且某些真菌胞外酶可以将大分子污染物转化为小分子化合物,能够提高微藻对营养物的去除率[13]。如图2 所示,第1 天的TP、TN 去除率,藻菌共生体要高于单独的微藻与灵芝菌,随后去除率几乎相同,推测是在高浓度的抗生素胁迫下,藻菌共生体吸收营养物的效率遭到了抑制。最终藻菌共生体对于污染物的去除无明显优势,可以看到,灵芝菌和藻菌共生体对TP 的去除前期与小球藻相比有优势,但第4 天开始出现反弹。三者对TN的去除率不相上下,对COD 的去除灵芝菌较有优势。
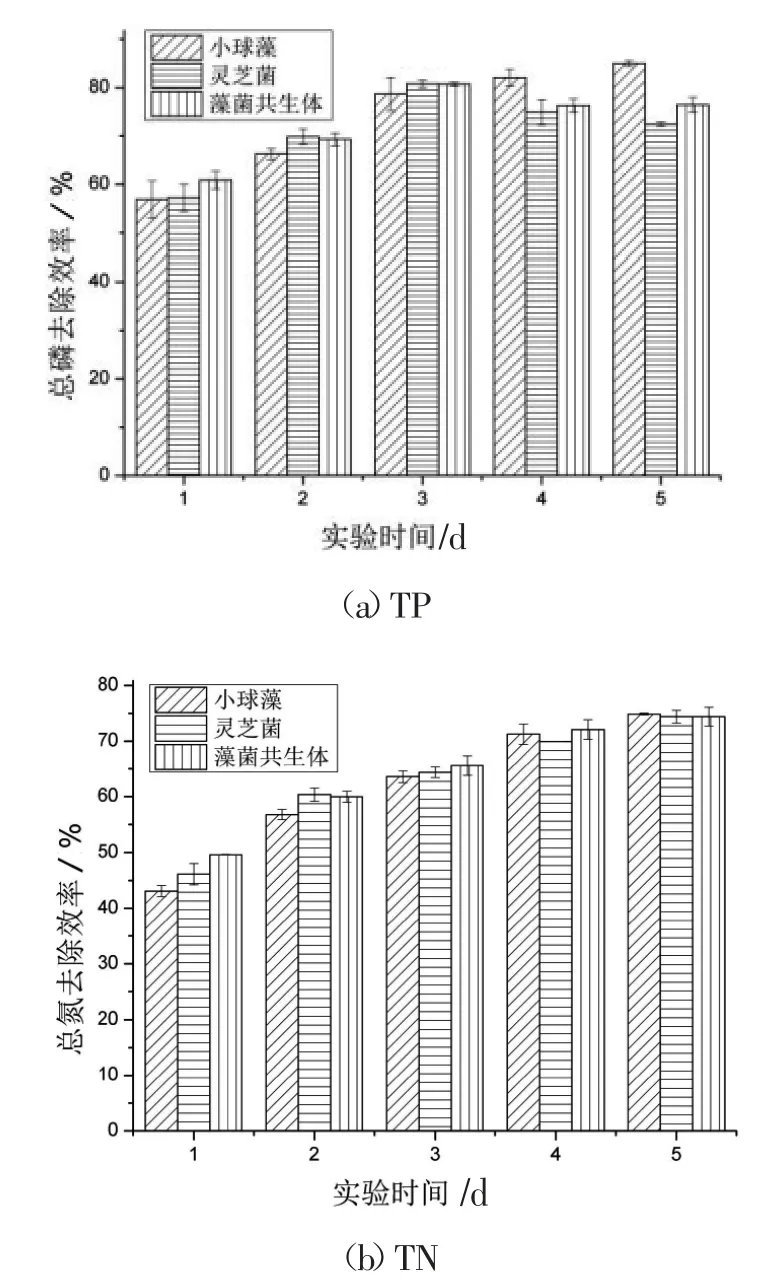
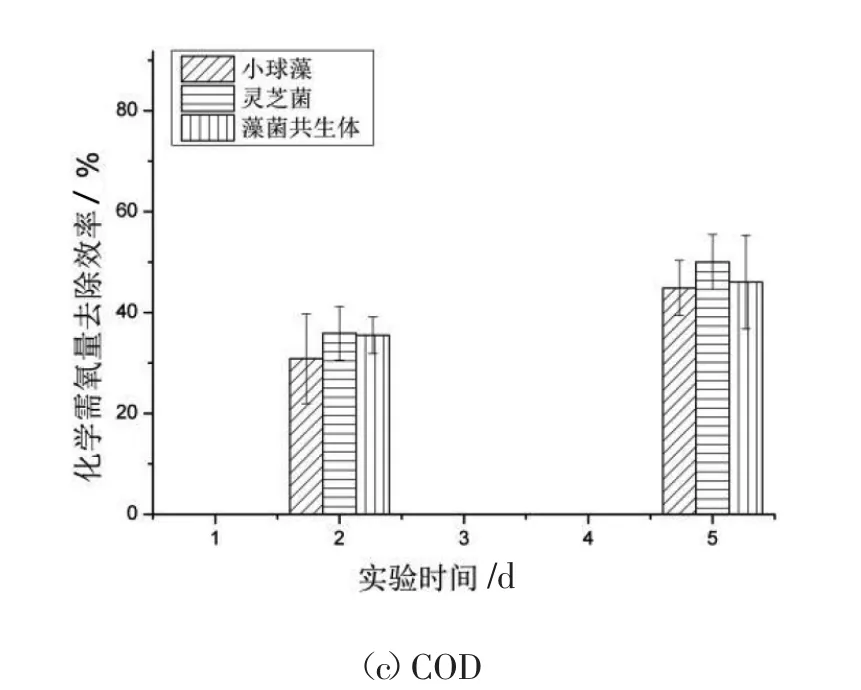
图2 藻菌共生体对模拟养猪废水中TP、TN、COD的去除效率Fig.2 Removal efficiency of TP,TN and COD from simulated pig wastewater by microlgal-fungal symbiosis
2.3 藻菌共生体生长性能分析
2.3.1 Chl-a 含量
叶绿素a(Chl-a)是微藻内的一种色素,用于吸收光进行光合作用,其含量可以作为判断微藻生长情况的重要指标[14]。图3 分别是藻菌共生体和小球藻中小球藻在不同抗生素作用下的Chl-a含量变化。对小球藻而言,最初两天3 种抗生素均能促进小球藻生长,这符合抗生素作用与藻类的普遍规律,由于藻类伴生杂菌的存在,一定浓度范围内的抗生素在第1 天均会不同程度地促进微藻的生长。姜思等[15]选用4 种抗生素作用于莱茵衣藻上,发现不同浓度的四环素在前两天对微藻均有不同程度的促进作用,并呈现抗生素剂量依赖效应。CPFX 与OTC 组分别在第3 天和第4 天对小球藻产生了明显的抑制作用,聂湘平等[16]研究出盐酸环丙沙星对蛋白核小球藻的毒性属于中等。崔探[17]指出盐酸环丙沙星对三角褐指藻的细胞形态、抗氧化性、膜透性及光合作用均产生毒性影响。对于OTC 影响的小球藻,在第4天Chl-a 猛然增长,随后在第5 天达到峰值后又几乎同趋势减少,说明从第5 天开始藻的光合作用抑制率达到最大,藻细胞无法获得充足的能量,生长受到抑制,甚至导致叶绿体结构破裂,从组织内流出[18]。而SM2 几乎对小球藻没有明显影响。由此可知,3 种抗生素中,CPFX 对普通小球藻毒性最大。对藻菌共生体而言,CPFX 与OTC 一开始就对藻菌共生体上的微藻有微弱的抑制作用;SM2 则对藻菌共生体有明显的促进作用,这可能是磺胺类抗生素对杂菌的特异性抑菌机理造成的。徐明等[19]利用平菇菌和普通小球藻构建藻菌共生体,小球藻的生物量显著增加。

图3 不同抗生素对藻菌共生体和小球藻Chl-a含量的影响Fig.3 Changes of Chl-a content in microalgalfungal symbiosis and Chlorella vulgaris with different antibiotics
2.3.2 碳酸酐酶活性
碳酸酐酶(carbonic anhydrase,CA)是一种含锌金属酶,是微藻中固定CO2的关键酶,其作用是催化CO2转化为碳酸氢盐[20]。由图4 可知,OTC和CPFX 对普通小球藻CA 活性有抑制作用,其中CPFX 尤为明显,从第4 天开始CA 活性明显下降,SM2 则对CA 活性无明显影响。正如Chen等[21]发现喹诺酮类、四环素类、氨基糖苷类、β-内酰胺类对蓝藻胞外碳酸酐酶均有不同程度的抑制作用一样,这可能与喹诺酮类和四环素类对藻类的抑制作用有关。在藻菌共生体上也是如此,由图4 可知,OTC 和CPFX 对藻菌共生体的CA活性也有抑制作用。第4 天OTC 组CA 活性突然增加,结合OTC 第4 天的降解率突然增加,CA 的活性与OTC 的降解效率高度相关,有可能是胞外碳酸酐酶的活性提高促进了CO2的固定,加速了光能向化学能的转换,促进了OTC 进入藻细胞进行生物降解。SM2 小球藻的CA 活性有促进作用,这与CHL-a 的结果高度一致,推测是磺胺类抗生素对杂菌的特异性抑制作用。实验结果与小球藻的CHL-a 含量结果基本一致。
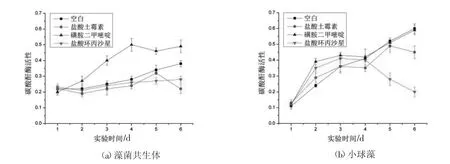
图4 不同抗生素对藻菌共生体和小球藻CA 活性的影响Fig.4 Effects of different antibiotics on CA activity of microalgal-fungal symbiosis and Chlorella vulgaris
2.4 藻菌共生体光合性能分析
不同抗生素废水中藻菌共生体和小球藻第4天的叶绿素荧光数据见表1。对暴露在抗生素下的小球藻,3 种抗生素的FV/FM和PIABS均处在正常区间,其中OTC 中小球藻的最大光学效率最高,性能指数最明显,光合性能最好。对于藻菌共生体,OTC 和SM2 的Fv/FM和PIABS远高于CPFX,ΨO、ΦEO和ΦDO的变化透露出微藻对光能的吸收和电子传递效率下降,最大电子传递产量降低,几乎无法进行PSⅡ。结果均表明CPFX 对小球藻的胁迫作用最大,这与CHL-a 和CA 活性结果基本一致。
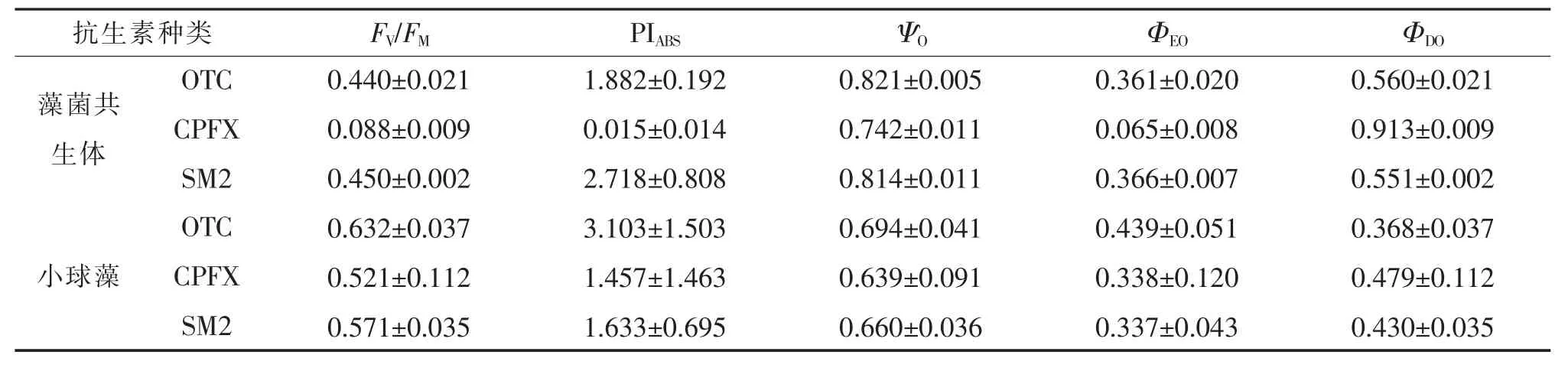
表1 不同抗生素第4 天藻菌共生体和小球藻叶绿素荧光数据
图5 为OTC 组藻菌共生体上小球藻OJIP 各个参数的变化情况,前两天的数据表示,微藻在OTC 的胁迫下,光能的吸收性能指数(PIABS)降低,捕获的机子能导致电子传递的效率(ΨO)降低,电子传递的量子产额(ΦEO)降低,进而导致微藻的最大光学效率(Fv/FM)在逐渐降低,预示着有活性的反应中心数目下降,所以微藻便迫使剩余的有活性反应中心的效率提高,从而导致吸收的光能增加(ABS/RC),热耗散(ΦDO)增加。然后便开始转变,首先是第2 天光系统捕获机子导致电子传递的效率(ΨO)开始增加,紧接着其他参数均在第3天出现拐点,结合此时OTC 的降解率猛然增加,胁迫微藻的抗生素浓度在一天时间内减少了至少40%,微藻的最大光学效率和性能指数开始上升,且后者上升更加明显,这表明PIABS能够更加灵敏地反映光学反应的变化[23],随后各个参数的反弹,均表明在OTC 浓度降低后微藻的光合作用得到缓解,这也进一步证明OTC 被逐渐降解成对微藻没有胁迫作用的产物,揭示了OTC 的降解途径为生物降解而非生物吸附和生物积累。
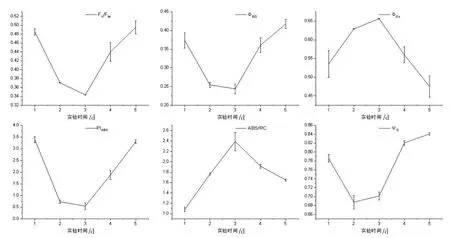
图5 OTC 作用下藻菌共生体的OJIP 各个参数变化情况Fig.5 Changes of OJIP parameters of microalgal-fungal symbiosis under the action of OTC
3 结论
小球藻-灵芝菌共生体对OTC 有明显的去除能力,第5 天的去除效率高达(89.93±1.70)%,同样条件下小球藻和灵芝菌对OTC 的去除效率分别为(60.41±2.21)%和(50.06±2.75)%,藻菌共生体对OTC的降解有明显的优势,但是三者对SM2 和CPFX均无去除效果。藻菌共生体对TP、TN、COD 的最终去除效率分别为(76.42±1.51)%、(74.41±1.68)%、(46.05±9.30)%。无论在哪种抗生素体系中,小球藻、灵芝菌和藻菌共生体对TP、TN、COD 的去除效果均大同小异。第4 天的小球藻Chl-a、CA 和藻菌共生体叶绿素荧光数据均表明:CPFX 无论是对小球藻还是藻菌共生体均有明显的胁迫作用,说明高浓度CPFX 对小球藻毒性较大。虽然SM2 能促进藻菌共生体的生长,但和小球藻之间无明显相互影响。本文构建的小球藻-灵芝菌共生体,对盐酸土霉素具有很强的去除效率,对生物方法处理废水中抗生素具有一定的理论指导意义和应用价值。在后期研究中,应关注如何将藻菌共生体系应用于环境污染抗生素处理并实际应用,同时进一步完善藻菌共生体处理抗生素的机理研究。

