夏季光温耦合对白及驯化苗生长发育及多糖含量影响
黄苏豫,刘佳微,刘筱,杨丽丽,黄安林,吴明开
1.贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与保护种质创新教育部重点实验室,贵阳 550025;2.贵州省农业科学院现代中药材研究所,贵阳 550006; 3.贵州省农业科学院科技信息研究所,贵阳 550006
在自然条件下由于云层的运动,植物通常会经历光的突然增加,尤其是设施栽培环境下,温室骨架以及植物上部冠层的遮荫使温室植物冠层呈现大量且持续变化的光斑。当光强突然增加时,PSⅡ对光的吸收也会立刻增加[1],但是电子传递系统不能及时利用多余的还原能,从而导致光化学系统的抑制[2]。光强的变化通常也伴随着温度的变化,波动光和热胁迫是热带和亚热带地区夏季的典型生境,当植物同时受到光强和温度胁迫时会使线性电子传递和环式电子传递受阻,导致非光化学淬灭(non-photo‑chemical quenching,NPQ)不能有效耗散过剩光能来保护光合系统,对PSIⅡ造成不可逆损伤[3-4]。目前关于高温和波动光对植物光合作用的影响研究大多是在受控环境生长的植物上进行的。
兰科植物白及(Bletilla striata)是一种濒危药用植物,贵州野生白及生长于海拔950~1 600 m、土壤含腐殖质较丰富的林下、草丛、岩石缝中[5]。白及繁殖常利用其种子进行组织培养,因白及组培苗抗逆性差、羸弱,不能直接用于大田栽培,需要移栽到人工大棚中进行适应性锻炼,培育形成块茎,块茎达到一定大小形成分叉才能移栽至大田[6]。但现有研究多集中在基质类型、遮阴度、施肥和病虫害防治方面[7],而关于白及组培苗移栽温室后对环境适应的影响研究较少。同时,植物在夏季通常会受到波动光和热胁迫,白及作为一种典型的阴生植物,在生产种植过程中需要采用遮阴栽培,温度超过35 ℃会对白及的光合作用产生抑制并且对白及PSⅡ系统造成不可逆的影响[8]。基于白及对强光强和高温的敏感性,本研究探讨夏季光温胁迫对白及生长及生理生化特性的影响,旨在为白及移栽驯化提供理论依据。
1 材料与方法
1.1 供试材料及处理
本研究以白及(Bletilla striata)种子培育的组培种苗为研究材料,炼苗后,移栽在泥炭混合基质(V泥炭∶V锯末∶V蛭石=3∶1∶1)的育苗穴盘中,在相对湿度为60%~70%的大棚中生长,使用遮阳网控制光照,夏季正午最大光强约为1 300 μmol /(m2·s),最高温度约为38 ℃,栽培过程中不存在水分或营养胁迫。待植株移栽90 d时,将植株转入人工气候培养箱进行2 h的温度(25、30、35、38 ℃)处理。测定叶绿素荧光和光合气体交换参数。
1.2 样品采集与测定
白及移栽30、60、90 d时随机选取10株白及,测量移栽苗株高、茎宽、叶片长、叶宽、块茎宽度及厚度、根长,称根、块茎、叶鲜质量。在105 ℃烘箱中杀青10 min,于80 ℃烘干至恒质量,称各部分干质量。烘干后的各部分样品粉碎,采用硫酸-苯酚比色法测定多糖含量。
1.3 气体交换参数测定
参考Yang等[4]的方法,待测叶片首先在6400-40荧光叶室中强光(1 000 μmol/(m2·s))和不同温度(25、30、35、38 ℃)处理适应20~30 min,以25 ℃处理为对照,至净光合速率(Pn)和气孔导度(Gs)稳定后,叶片在弱光[50 μmol /(m2·s),2 min]和强光[1 000 μmol /(m2·s),2 min]之间交替变化,持续30 min。Li-Cor 6400XT每2 s记录1次数据。待测叶片在同样的处理下适应20~30 min,至Pn和Gs稳定后,在弱光(50 μmol/(m2·s))下持续5 min和10 min,随后光强再次上升到强光(1 000 μmol /(m2·s))持续5 min。Li-Cor 6400XT每2 s记录1次数据。测定期间,叶室内测量光为Li-Cor 6400XT默认光源,即90%红光+10%蓝光,CO2浓度为400 μmol/mol,空气流速为500 μmol/s。
测定期间,某时刻的光合诱导状态为此时的净光合速率占最大净光合速率的百分比[9],光合诱导状态=(Pn-Pnd)/(Pnf-Pnd)×100,式中,Pn为净光合速率;Pnd为待测叶片暗适应时稳定的净光合速率;Pnf为25 ℃时,光诱导期结束(即强光强下,适应30 min)时待测叶片达到的最大净光合速率。
1.4 叶绿素荧光参数测定
植株首先在暗室中暗适应30 min,随后将待测叶片在6400-40荧光叶室中暗适应30 min左右,记录最小(Fo)和最大(Fm)荧光。暗适应结束后将Li-Cor 6400XT叶室内光强瞬时提高到1 000 mmol /(m2·s)并持续30 min,记录Fs和Fm'。计算PSⅡ最大量子产量(Fv/Fm)、PSⅡ有效量子产量(ΦPSII)、光化学猝灭系数(qP)、光下最大光化学效率(Fv'/Fm')、光保护指标(ΦNPQ)、光损伤指标(ΦNO)、线性电子传递速率(ETR)和非光化学淬灭系数(NPQ)[10]。
1.5 数据分析
采用单因素ANOVA进行方差分析确定不同处理的差异显著性,绘图采用Origin 2022。
2 结果与分析
2.1 光温耦合对气体交换参数的影响
测定结果显示,白及叶片经连续强光-弱光-强光转换,光合诱导状态对温度胁迫展现出不同的响应,高温胁迫显著降低了光合诱导状态,35和38 ℃处理下的光合诱导状态分别为55%~65%和30%~40%,25和30 ℃下的白及植株在经过一系列交替光的转换后光合诱导状态仍高达80%~90%和70%~80%(图1A)。
交替光转换下温度和Gs呈负相关,在25~35 ℃下降明显,峰值从0.17左右降到0.90左右(图1B)。白及叶片的胞间二氧化碳浓度和温度呈正相关(图1 C),CK和38 ℃相比,Ci上升了7%,并且蒸腾速率和温度也呈现正相关(图1D)。温度的升高致使叶片光合下降,高温胁迫下各处理在弱光和强光的转换之间仍然保持相同的变化趋势。
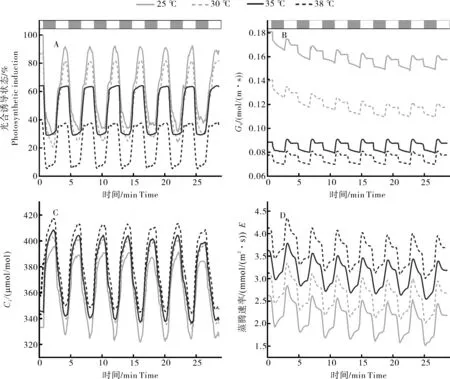
图1 白及叶片经连续强光-弱光-强光转换下气体交换参数对瞬时温度胁迫的响应Fig.1 Response of gas exchange parameters to transient temperature stress in Bletilla striata leaves under continuous strong-weak-strong light conversion
2.2 温度对弱光照射持续时间的影响
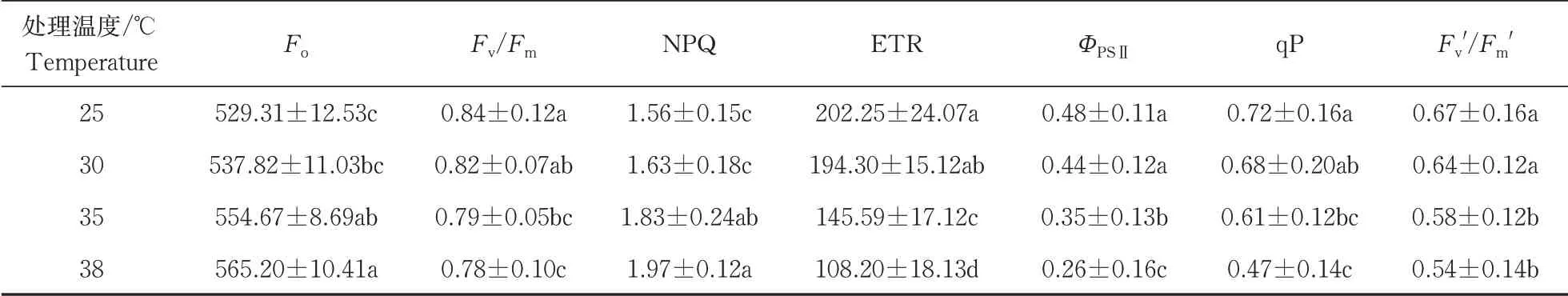
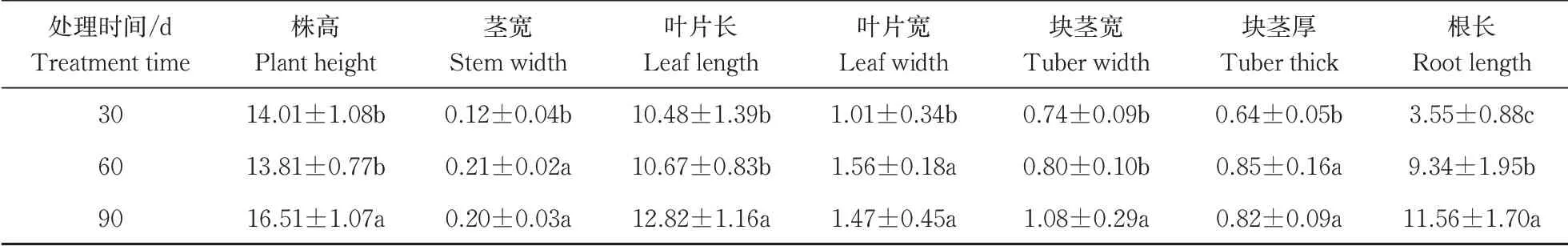
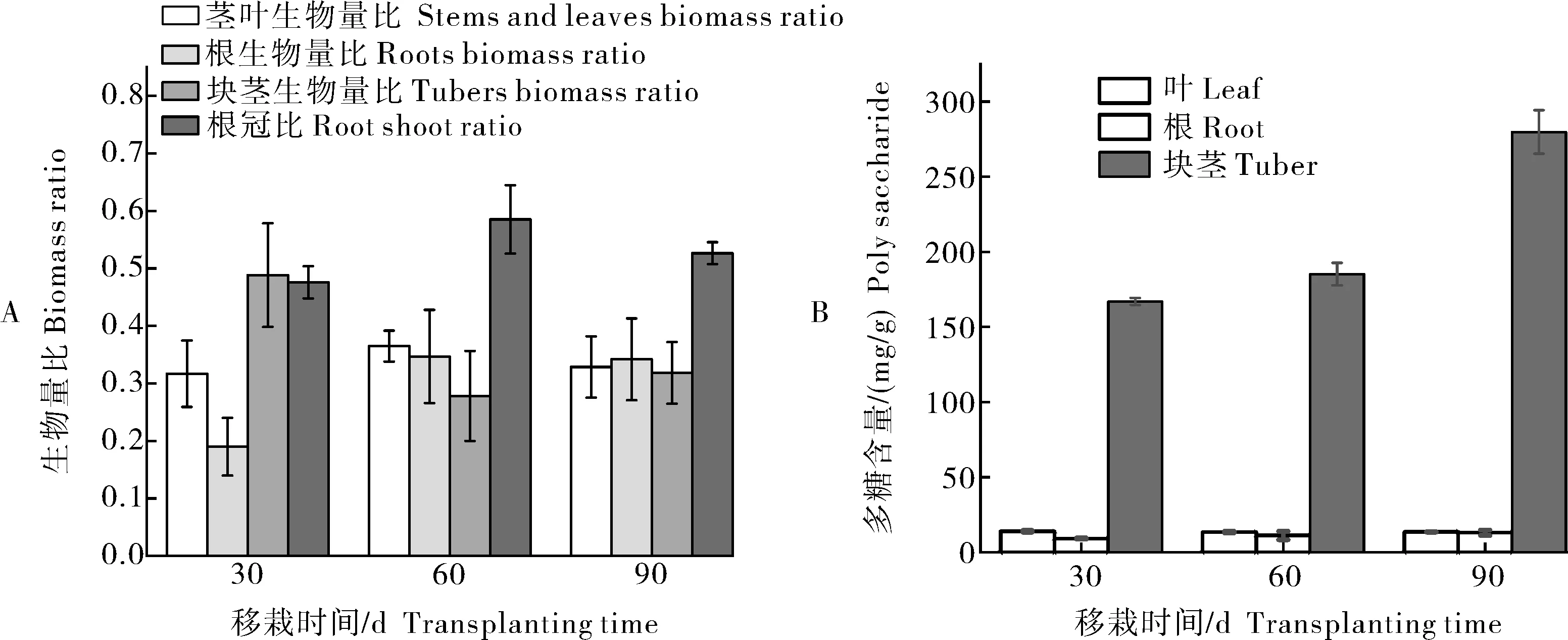
在经历5 min的弱光后,强光来临时,各个温度达到稳态的时间t35℃ 图2 叶片经不同时间弱光处理后转移到强光下其光合速率变化过程对温度胁迫的响应Fig.2 Response of photosynthetic rate change process of leaves to temperature stress after different time of weak light treatment transferred to strong light 由表1可知,38 ℃处理的Fo最高,35 ℃处理次之,均显著高于25 ℃处理(对照),说明白及叶片在高温条件下类囊体膜受损严重。CK(25 ℃)的Fv/Fm值为0.84,优于其他处理;30、35、38 ℃时的Fv/Fm值比对照处理的分别下降了2.4%、6.0%和7.1%,表明高温对白及光能转换效率均有不同程度的抑制作用,温度越高抑制作用越明显。NPQ随温度升高而上升,38 ℃时的NPQ比25 ℃提高了26%。说明白及受到高温胁迫后,PSⅡ吸收的光能中用于耗散和发出荧光的能量增多,而用于光化学反应的能量减少。高温胁迫下ETR下降明显,38 ℃与CK相比约下降了46.5%。ETR下降说明光合机构受损,电子传递过程不能正常有效进行,导致光能转换效率降低,进而导致光合速率的下降。ΦPSⅡ随温度升高呈现出下降的趋势,与CK相比,30 ℃下被利用的光能并没有显著的改变,但是在35和38 ℃下降趋势明显,分别下降了27%和45%。光化学猝灭系数(qP)和光下最大光化学效率(Fv'/Fm')同样随温度升高显著降低。 表1 温度胁迫对白及叶片叶绿素荧光参数的影响Table 1 Effects of temperature stress on chlorophyll fluorescence parameters of Bletilla striata leave 由于白及组培苗抗逆性差、羸弱,不能直接进入大田栽培,需要移栽到人工大棚中进行适应性锻炼。驯化初期,30 与60 d的株高并没有表现出差异,但是在茎宽、根数、根长、块茎厚上表现出显著差异(P<0.05),随着驯化时间的延长,在90 d时,株高、叶片长、块茎宽和根长表现出显著差异(表2),但是在90 d时,白及仍未初步形成“马鞍型”块茎。 表2 驯化时间对白及移栽苗生长指标的影响Table 2 Effect of domestication time on growth indexes of Bletilla striata seedlings cm 白及移栽苗根冠比呈现先升后降的趋势,表明在移栽前期以地下部的生长为主,于90 d左右地上部的生长占主要部分。根的生物量占比和茎叶生物量占比均随驯化时间的延长而提高(图3 A),但块茎生物量比呈现相反的趋势。 白及多糖含量是白及质量指标之一,由图3可以看出,块茎的多糖含量随驯化时间的延长而提高,并且在60 d后显著增加,多糖含量相比于60 d时增加了51%。而叶片和根的多糖含量受驯化时间的影响较小(图3 B)。 图3 移栽驯化时间对白及幼苗生物(A)和多糖含量(B)的影响Fig.3 Effect of transplanting and accliating time on biomass(A) and polysaccharide content(B) of Bletilla striata seedlings 净光合速率下降,胞间CO2浓度或气孔导度上升,说明净光合速率的下降是由非气孔限制因素造成的[11]。在高温下,光化学反应和碳代谢受到抑制,叶片的水分状态和细胞内二氧化碳浓度出现显著变化,这些变化都导致了光合速率的降低[12-14]。热胁迫导致的光抑制被认为是由于抑制了RuBP的羧化速率和Rubisco活性[15-16]。叶片由强光转移到弱光下,再次转换到强光时,光合速率恢复至强光水平的时间和Rubisco活性有关[17-18]。 在本研究中,35 ℃与CK相比光合速率显著降低,而在前人的研究中34 ℃短期内对白及的光合速率不会产生太大的影响[8],原因可能是选用的白及生长期不同以及在波动光下,供给侧产生的还原能不能被受体测利用,加重了光抑制现象。白及叶片在强-弱-强光的转换下,叶片的光合速率受温度胁迫的影响,并随着弱光持续照射时间的增加,净光合速需要更长的时间来恢复至正常水平。 叶绿素荧光参数是植株响应热胁迫的重要指标,高温会使Fo升高,原因是类囊体结构遭到了破坏,因此,Fo也被作为植物耐热性相关的生理特征[19-20]。热胁迫通过抑制PSⅡ的修复来降低PSⅡ活性从而加深植物的光抑制程度[21-22]。Fv/Fm反映PSⅡ对光能的利用效率,是评判光抑制的重要指标,在胁迫状态下会发生明显的变化。ΦPSⅡ是PSII反应中心部分关闭时的光能捕获效率,Fv'/Fm'反映开放的PSⅡ反应中心的光能捕获效率,两者都能体现PSII反应中心对光能的转化效率。荧光淬灭是植物体内光合效率调节的一个重要指标,分为光化学淬灭和非光化学淬灭两类。光化学淬灭反映光能直接被用于光化学电子传递的比例,非光化学淬灭的大小表明植物耗散过剩光能为热的能力,反映了植物的光保护能力,并且热耗散对植物光合机构免受破坏起到积极的作用。高温下,PSⅡ反应中心的失活和类囊体结构的改变,被认为是ETR下降的主要原因。高温抑制PSⅡ活性,降低其稳定性,进而抑制光合作用。 本研究探讨了夏季光温耦合对白及驯化苗生长发育及多糖含量的影响,结果表明:白及移栽苗的生长指标和驯化时间成正比,根冠比在90 d内先升后降,块茎多糖含量90 d较60 d增加了51%,夏季波动光和高温对白及生长发育产生严重危害。因此,在夏季应该加强对白及驯化苗的水肥管理,从而减轻高温和波动光带来的伤害。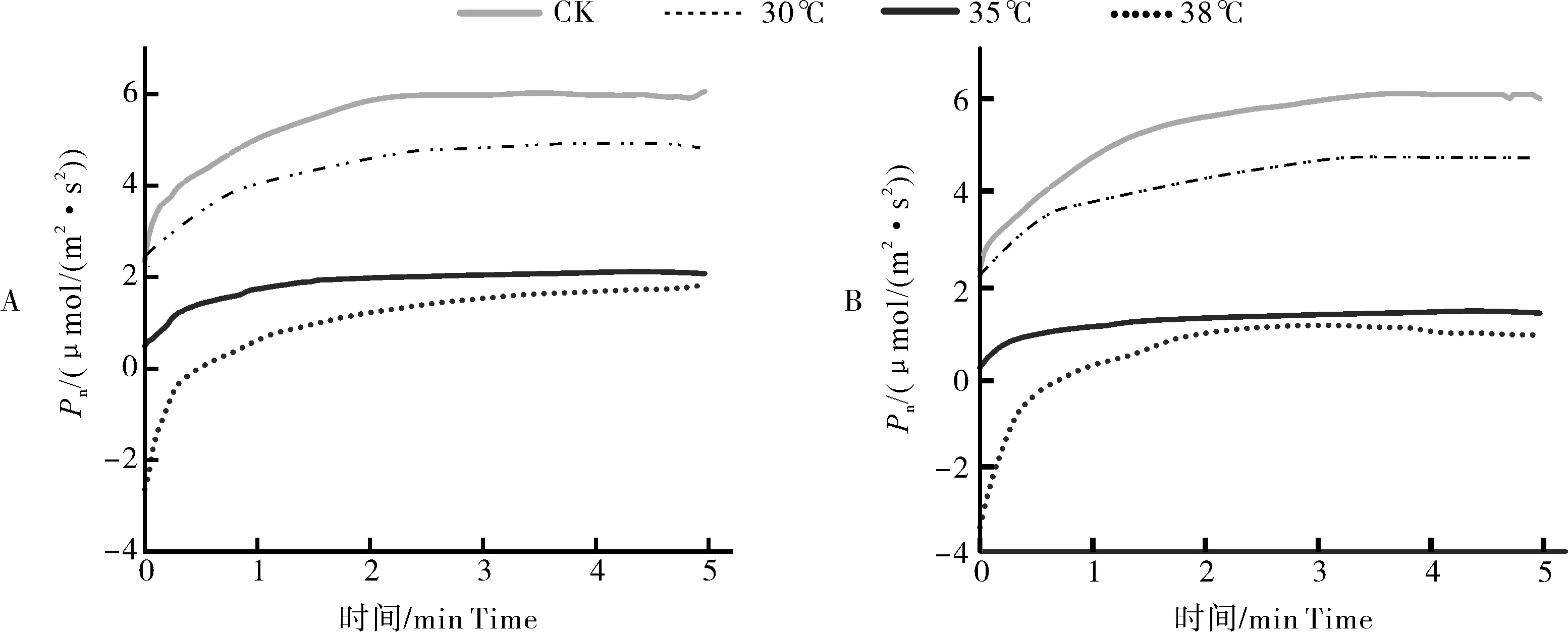
2.3 温度对叶绿素荧光参数的影响
2.4 夏季移栽对白及生长指标、生物量和多糖含量的影响
3 讨论
3.1 光温耦合对气体交换参数的影响
3.2 温度对叶绿素荧光参数的影响

