再生稻田拟环纹豹蛛与青翅蚁形隐翅甲间的集团内捕食及其影响因素
孙佳琦,王晨,王光华,任应党,祝增荣,白耀宇
(1.西南大学植物保护学院,重庆 400715;2.河南省农业科学院植物保护研究所,郑州 450002;3.浙江大学农业与生物技术学院昆虫科学研究所,农业农村部作物病虫分子生物学重点实验室,杭州 310058)
“再生稻”是指在单季稻基础上发展起来的,利用头季稻收割后稻桩上存活的休眠芽重新发苗和再生蘖而形成的水稻,通常从8 月下旬水稻收割至10 月下旬稻谷成熟再收割的稻田为再生稻田。种植再生稻是有效提高稻田复种指数、增加单位面积稻谷产量和经济收入的主要措施之一[1]。目前,广泛分布在重庆、四川等西南丘陵山区的单季稻区水稻种植主要采用中稻或中稻结合再生稻模式。
有研究指出,在陆地生态系统广食性捕食者间,普遍存在能削弱它们对害虫抑制力的集团内捕食(intraguild predation, IGP)作用[2-3]。IGP 是指在一个生态系统中位于同一营养层或功能团的消费者在它们组成的捕食者/猎物模式中,通过充当不同的角色而分享资源并互作的现象,被视为一种极端种间竞争形式和经典的捕食类型。而且这种现象本质上能够影响捕食性天敌对目标害虫的控制效力[3]。一些生物和非生物因素与IGP 密切相关,如集团内捕食者和集团内猎物的相对体型大小[2]、集团外猎物丰度[4]、栖息地结构和复杂性[5]、生境基质[6]、温度[7-9]等。迄今为止,有关IGP的研究多集中在非稻田生态系统上。尽管如此,一些研究者指出在水稻生育期稻田捕食者间也普遍存在着IGP 现象。例如,在晚稻种植早期,拟环纹豹蛛(Pardosa pseudoannulata)(以下简称豹蛛)与青翅蚁形隐翅甲(Paederus fuscipes)(以下简称隐翅甲)间存在着单向性IGP[10]。而在水稻抽穗期,针对捕食者肠道内容物的分子检测结果指出,豹蛛和隐翅甲等集团内捕食者能猎杀集团内猎物黑肩绿盲蝽(Cyrtorhinus lividipennis)和中华淡翅盲蝽(Tytthus chinensis),且这种IGP 作用强度受到集团内猎物的种类、水稻品种抗性和集团外猎物丰度的影响[11]。另外,也有研究表明,豹蛛能够捕食台湾裂头小皿蛛(Atypena formosana)和黑肩绿盲蝽[12]。但目前尚无关于水稻收割后的再生稻田广食性捕食者间IGP 的研究报道。
豹蛛和隐翅甲是稻田节肢动物群落中最主要的广食性捕食性天敌,在水稻收割后的冬水田休耕季节(包括再生稻期间)发生量很大[13]。常规的聚合酶链反应(polymerase chain reaction,PCR)技术已在有关捕食作用的研究中被使用[14-15];而特异性更强、灵敏性更好、准确性更高以及可量化分析的实时荧光定量PCR(quantitative real-time PCR,qPCR)尽管在捕食作用的研究中有一些应用[11,16],但尚无在上述2 种捕食性天敌间IGP 研究中的报道。鉴于此,本研究建立和优化了隐翅甲和豹蛛的qPCR探针法检测体系,基于此分析再生稻田中这2 种天敌间的IGP 水平,并在室内通过两者的共存试验系统分析它们间的IGP 及影响该IGP 的生物和非生物因素。该研究的开展可发掘增强再生稻田捕食性天敌种群发生的新途径,为制定可持续的全年作物系统水稻害虫“绿色防控”策略提供重要的理论参考依据,同时也将丰富捕食者间的IGP理论体系。
1 材料与方法
1.1 研究区概况
研究地点位于重庆市璧山区(29°17′—29°53′N,106°02′—106°20′E)。该地的再生稻田为典型的低海拔丘陵山地沟壑田。水稻收割后的再生稻田(8月下旬至10 月下旬)通常不再进行施肥、施药等管理,但会对其进行蓄水管理,因此也被认为是休耕季节的早期冬水田[16]。
我们在前期研究[17]的基础上,选择了2 个在当地比较有代表性的试验点进行再生稻田供试节肢动物的采集,试验地分别位于重庆市璧山区大路街道(29°43′ N,106°13′ E)和河边镇(29°40′ N,106°11′E)。水稻种植模式均为近10年来连续耕作的一季中稻结合再生稻种植模式。
1.2 集团内猎物DNA 测定
1.2.1 供试节肢动物
于2020 年9—10 月在上述2 个地点,使用盆拍法结合人工捕捉法开展豹蛛和隐翅甲及其他节肢动物的采集。使用乙酸乙酯立即处死采集到的节肢动物并装入保存管中带回实验室,于-30 ℃冰箱中保存,待用。用于DNA测序的捕食性天敌在田间不立即处死,而是带回实验室于25 ℃条件下供水饥饿处理6~7 d(清除肠道内的残留物)后处死,随后保存于-30 ℃冰箱中,待用。
1.2.2 主要仪器与设备
Centrifuge 5424R 离 心 机(德 国Eppendorf 公司)、DFD-700 水浴锅(上海树立仪器仪表有限公司)、YXQ-50S Ⅱ立式压力蒸汽灭菌器(上海博迅实业有限公司)、DYY-6C 电泳仪(北京六一生物科技有限公司)、Universal HoodⅡ凝胶成像系统、T100 Thermal Cycler梯度PCR 仪、CFX384 Touch实时荧光定量PCR仪、DGX-9053B-1鼓风干燥箱、移液器等。
1.2.3 qPCR 检测体系的建立和优化
1.2.3.1 DNA提取、测序和引物与探针设计
使用DNA提取试剂盒D1700(北京索莱宝科技有限公司)提取供试节肢动物的DNA,采用琼脂糖凝胶电泳分析提取的DNA 质量。使用COⅠ和ITS基因的通用引物进行PCR 扩增[18-19],扩增产物检测合格后送至生工生物工程(上海)股份有限公司进行测序。
将测序正确的目标种DNA 序列在NCBI 数据库(https://www.ncbi.nlm.nih.gov)中通过BLAST 比对,以验证物种及序列的准确性,同时搜集下载近缘种同一基因的DNA序列并使用DNAMAN 6.0软件比对它们间的差异。使用Primer Premier 5.0软件设计特异性引物和探针,并委托生工生物工程(上海)股份有限公司合成。以再生稻田系统内共存的其他节肢动物及水为对照,通过qPCR 检验目标种基因引物与探针的特异性,qPCR 扩增体系为:12.5 μL TaqProbe 2×qPCR-Multiplex 预混液,0.5 μL 上、下游引物(20 mmol/L),0.5 μL 探针(20 mmol/L),0.5 μL DNA,10.5 μL ddH2O。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环。
1.2.3.2 qPCR检测体系的优化
检测体系的优化。隐翅甲和豹蛛的检测体系均为单重qPCR检测体系;为保证检测时荧光强度好且扩增曲线平滑完整,对该反应体系进行优化,优化后的反应体系为:5 μL TaqProbe 2×qPCR-Multiplex预混液,0.05 μL上、下游引物(20 mmol/L),0.025 μL探针(20 mmol/L),1 μL DNA,3.875 μL ddH2O。反应程序为:94 ℃预变性8 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环。
检测下限与重复性分析。委托深圳华大基因科技有限公司直接合成含有靶基因序列的DNA 样品,对该样品进行10 倍浓度梯度的稀释,最终获得DNA 拷贝数1×101~1×108copies/μL 8 个浓度梯度的标准品。对低浓度到高浓度的标准品依次进行PCR 扩增,以确定最低检测浓度。每个浓度设置3组,每组重复3次。
标准曲线的建立与扩增效率分析。选择最低检测浓度以上的5个连续浓度梯度标准品进行PCR扩增,得到该检测体系的标准曲线方程。该方程的通用公式为:Y(CT)=a×lg(样品浓度)+b。其中,CT为循环阈值(cycle threshold,CT);a、b为常量。由该方程可知,CT与样品浓度的对数呈线性关系,故使用线性回归方法构建的方程来计算qPCR扩增效率(E),公式为:E=[10(-1/a)-1]×100%。
1.2.4 集团内猎物DNA 检出率及DNA 拷贝数的测定
为探究不同发育阶段的豹蛛对隐翅甲成虫捕食的差异,本研究以再生稻田发生最为普遍的2 种体型的豹蛛虫态(中龄幼蛛和亚成蛛/成蛛)为代表,开展它们肠道内隐翅甲DNA 的残留分析。试验开始前,测得豹蛛亚成蛛/成蛛和中龄幼蛛的体长分别为≥7.0 mm 和4.0~7.0 mm。同时也测量隐翅甲成虫的体长。使用DNA 提取试剂盒D1700 提取整个捕食者的DNA。为保证DNA 提取的质量,参考有关文献[20]对体长大于10 mm 的豹蛛仅提取其腹部的DNA。在目标种DNA 提取完成后,检查DNA质量,方法同1.2.3.1节。
使用1.2.3.2节中建立的qPCR检测体系对提取的捕食者DNA样品进行扩增。PCR扩增结束后,统计对集团内猎物DNA 有阳性反应的集团内捕食者的检测个体样品数,并计算集团内猎物DNA的检出率,该检出率计算公式为:DNA 检出率=DNA 阳性样品数/全部检测样品数×100%。
使用1.2.3.2 节中建立的检测体系的标准曲线方程计算检出基因的DNA拷贝数,即捕食者肠道内集团内猎物的DNA 拷贝数。计算公式为:DNA 拷贝数=100×10(CT-b)/a。其中,100 为DNA 提取的最终溶液体积,μL。
1.3 2 种捕食性天敌间的IGP 及其影响因素分析
1.3.1 供试节肢动物及试验条件
在上述2 个再生稻田采样点,使用盆拍法结合人工捕捉的方式获取隐翅甲成虫和豹蛛成蛛以及集团外猎物天台刺齿跳虫(Homidia tiantaiensis,Ht)和白翅叶蝉(Thaia rubiginosa,Tr)成虫。供试豹蛛低龄幼蛛为室温条件下利用天台刺齿跳虫饲养携带卵囊的雌蛛获得。所有试验均在人工气候箱中的玻璃培养皿内进行。人工气候箱温度为(22±1)℃,相对湿度为(85±10)%,光照周期为12 h/12 h(光照/黑暗)。
1.3.2 2 种捕食者间的IGP 分析
为进一步明确这2种天敌间IGP的发生规律及程度,在室内开展了它们间的IGP 试验。由于这2种天敌在再生稻田大量发生且易捕捉到的虫态分别为豹蛛成蛛和幼蛛以及隐翅甲成虫,因此,在参考IGP 理论中集团内捕食者/猎物相对体型大小对IGP发生规律影响的基础上,设计了这2种天敌间2类IGP情景配对试验,即豹蛛成蛛和隐翅甲成虫间、豹蛛低龄幼蛛和隐翅甲成虫间的IGP试验(附图1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.041)。
1.3.2.1 豹蛛成蛛和隐翅甲成虫间的IGP试验
豹蛛成蛛饥饿处理而隐翅甲成虫未饥饿处理的试验。试验前对豹蛛成蛛饥饿处理6 d,且在试验期间不再饲喂集团外猎物;而隐翅甲成虫为非饥饿个体。为明晰IGP处理中隐翅甲成虫死亡是IGP的结果而非饥饿所致,在试验期间,每24 h 用集团外猎物天台刺齿跳虫饲喂的隐翅甲成虫活跃个体替换IGP 处理中的个体。在捕食者接入培养皿前,先在空白培养皿底部滴入少许无菌水,然后放入2 种捕食者各1 头到同一培养皿中,用塑料薄膜将培养皿顶端封住后置于人工气候箱内开始试验(记为T1)。同时,设置对照组(CK1)。CK1中的豹蛛成蛛和隐翅甲成虫均为单独个体,其他同T1处理。观察期为6 d。在试验过程中,如某个培养皿中2头天敌中的一头(T1)或单独一头(CK1)个体死亡,则不再进行该培养皿的观察试验并记录最终试验结果。每24 h观察和记录一次试验结果。在记录时,标注被豹蛛取食的隐翅甲个体数(视为集团内捕食的结果)。每个培养皿为1 个重复,各处理重复20~40次。
豹蛛成蛛和隐翅甲成虫均未饥饿处理的试验。试验前对田间采集的豹蛛成蛛和隐翅甲成虫不进行饥饿处理和饲喂集团外猎物,设置处理组和对照组,分别记为T2和CK2。其他同上。
1.3.2.2 豹蛛低龄幼蛛和隐翅甲成虫间的IGP试验
隐翅甲成虫饥饿处理而豹蛛低龄幼蛛未饥饿处理的试验。试验前对隐翅甲饥饿处理6 d。幼蛛为离开雌蛛体背1~2 d 的个体(1~2 龄[21])。在试验期间,处理组(T3)中的幼蛛每24 h 用集团外猎物饲喂的活跃个体进行替换,而隐翅甲为饥饿个体。对照组(CK3)中的豹蛛低龄幼蛛和隐翅甲成虫均为单独个体,其他同T3处理。另外,在统计结果时不去除隐翅甲死亡的重复数。
隐翅甲成虫和豹蛛低龄幼蛛均未饥饿处理的试验。在处理组(T4)中,从田间采集的隐翅甲不再进行饥饿处理,同时设置对照组(CK4)。其他同上。
1.3.3 影响2 种捕食者间IGP 的因素分析
上述1.3.2 节中这2 种捕食者间高IGP 发生率存在于豹蛛低龄幼蛛和隐翅甲成虫间,因此,选择豹蛛低龄幼蛛和隐翅甲成虫为配对试验对象开展它们间IGP 发生的影响因素研究。由于集团外猎物天台刺齿跳虫(Ht)和白翅叶蝉(Tr)在该季节的稻田发生量巨大[13],故将他们作为影响该IGP 的生物因子。集团外猎物密度通过预试验确定,分别采用20 头Ht 和10 头Tr。预试验前,IGP 和对照处理中的隐翅甲成虫均为饥饿处理6 d 的个体,而豹蛛低龄幼蛛为离开雌蛛体背1~2 d 的个体;试验期间,IGP 和对照组中的隐翅甲和幼蛛均不饲喂集团外猎物。
共设置5 个生物、非生物因素及其结合处理。其中,2 个生物因素处理为10 头Tr(记为10Tr)、10头Tr+20头Ht(10Tr+20Ht)。2个非生物因素处理为:由10 g 再生稻田灭菌处理后的土壤和13 mL 无菌水混合而成的土壤基质(Ss)结合两端孔洞封闭的2 根稻秆(Rs)(图1)处理(Ss+Rs)、在Ss 基础上再加入5 mL无菌水且土表面约有1 mm水层(模拟再生稻田生境)的淹水条件(Wi)处理(Ss+Rs+Wi)。1 个集团外猎物和上述非生物因子结合的处理,即Ss+Rs+Wi+20Ht。在上述处理中接入2种捕食者各1头到培养皿中开始试验。同时,将豹蛛低龄幼蛛和隐翅甲成虫单头个体分别作为上述IGP试验的非IGP 对照(CK)。各处理重复12~20 次。试验观察期均为6 d。其他同1.3.2节。
图1 稻秆放置示意图Fig.1 Diagram of rice straw layout
1.4 统计与分析
使用SPSS 24.0 和Excel 2019 软件对试验数据进行差异显著性和相关性分析。
2 结果与分析
2.1 2 种捕食者间IGP 的集团内猎物DNA 检测结果
2.1.1 qPCR 检测体系引物与探针的特异性
本研究首次设计和合成了拟环纹豹蛛COⅠ基因和青翅蚁形隐翅甲ITS基因的特异性引物和探针,并在GenBank 数据库进行了登记,具体信息见表1。

表1 qPCR检测体系的引物与探针信息Table 1 Information for primers and probes of qPCR detection system
利用上述引物对再生稻田常见节肢动物进行qPCR扩增,结果如图2所示。从中可知:该反应体系仅对目标种标记基因有扩增反应,而对62种非目标种(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.041)基因均无扩增反应,说明本研究设计的引物与探针特异性强,完全能用于后续田间调查中对这2 种天敌IGP 的检测分析,且检测结果可靠度高。
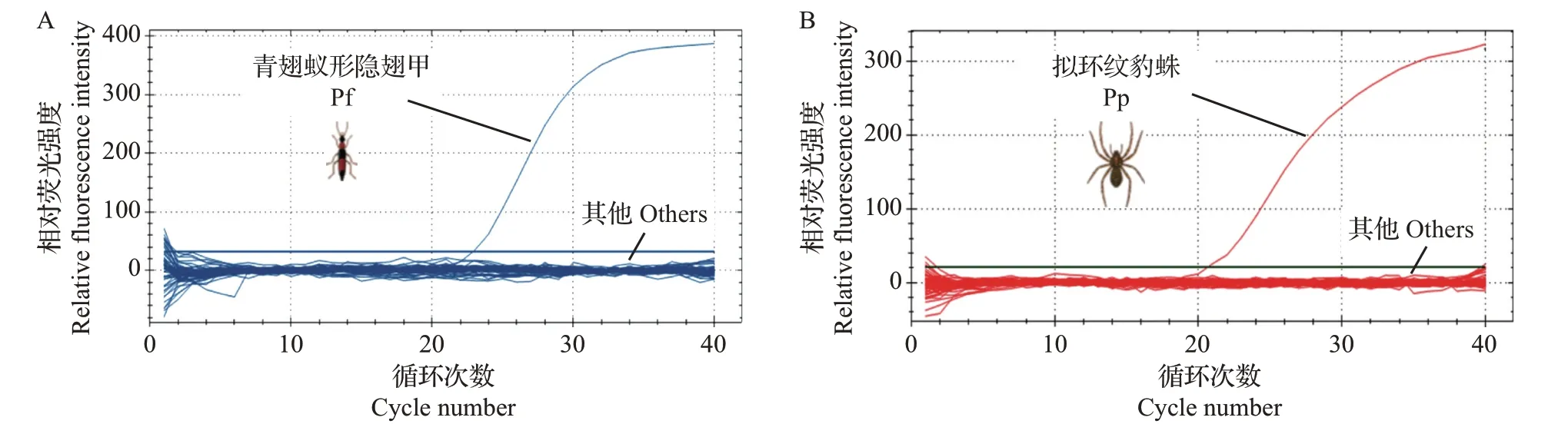
图2 青翅蚁形隐翅甲和拟环纹豹蛛qPCR检测体系的扩增曲线Fig.2 Amplification curves of qPCR detection systems of Pf and Pp
2.1.2 qPCR 检测体系的可靠性分析
优化后的qPCR 检测体系灵敏性试验结果表明,该体系对这2种捕食者DNA模板的检测灵敏度高,最低检测浓度均为1×102copies/μL。同时,重复性试验结果进一步表明,该检测系统CT值的变异系数均小于5%,说明该检测体系对这2种天敌标记基因的扩增重复性良好(表2)。
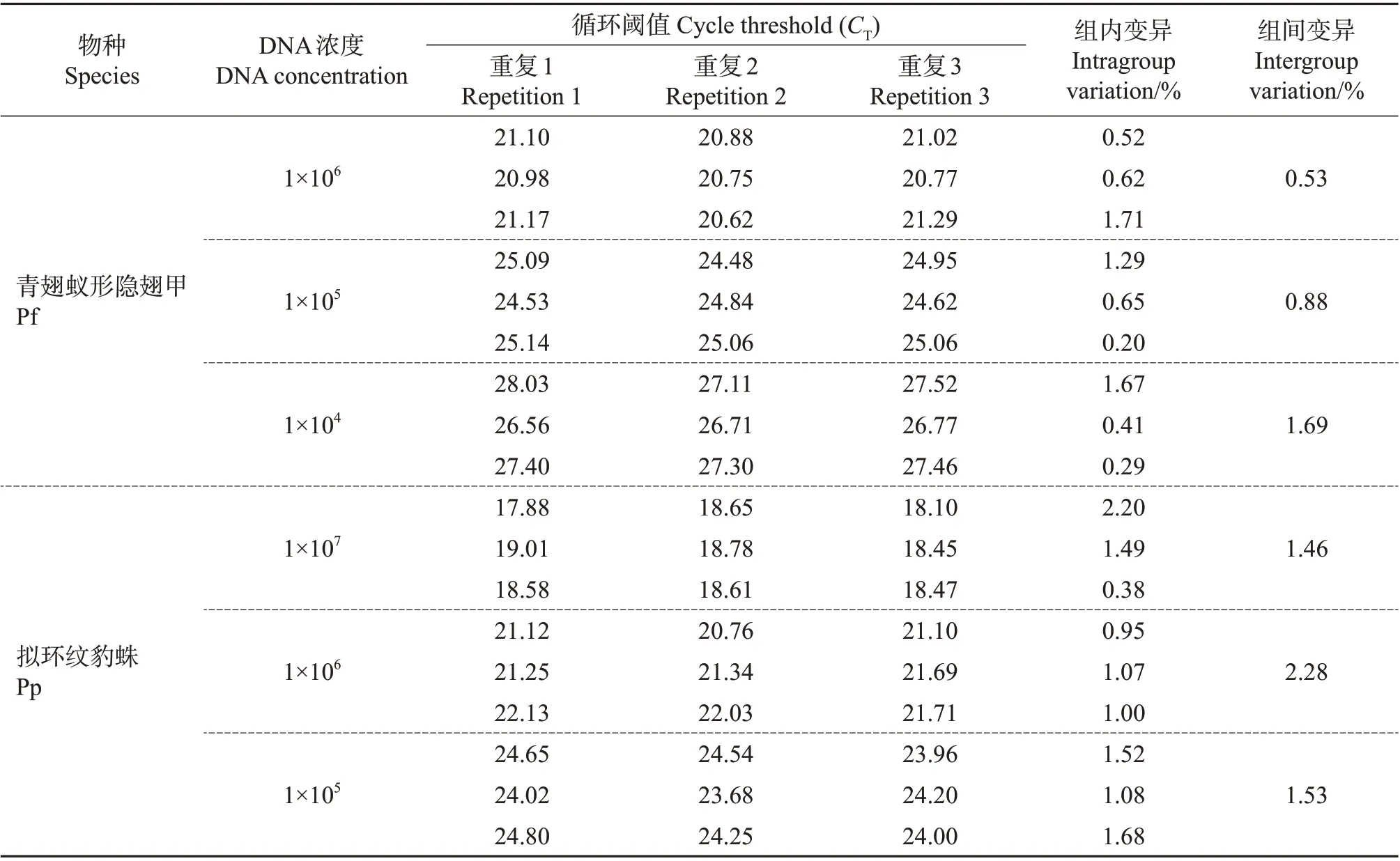
表2 针对2种捕食者建立和优化后的qPCR检测体系的扩增重复性分析Table 2 Amplification repeatability analysis of qPCR detection systems established and optimized for the two predators
根据5个浓度梯度标准品qPCR的结果,建立了豹蛛和隐翅甲qPCR 检测的标准曲线方程,分别为Y=-3.20X+40.47(R2=0.992)和Y=-3.14X+39.78(R2=0.989)。同时,由扩增效率计算公式可知,该反应体系对豹蛛和隐翅甲的标记基因扩增效率(E)分别为105.4%、108.2%,且90%<E<110%,进一步表明该反应体系扩增效果好,完全能用于这2 种捕食者肠道内集团内猎物DNA的检测。
2.1.3 捕食者肠道内集团内猎物DNA的检测结果
2.1.3.1 3类捕食者体长比较
共采集到3 类捕食性天敌1 527 头,包括511 头隐翅甲成虫、484头豹蛛中龄幼蛛以及532头豹蛛亚成蛛/成蛛。这3类供试捕食者的体长统计分析结果见表3。从中可知:同一采样点3类天敌的体长排序为豹蛛亚成蛛/成蛛>隐翅甲成虫>豹蛛中龄幼蛛,它们之间的体长差异极显著(P<0.001),且两两间也存在显著性差异(P<0.05);但是,同种天敌在2个不同采样点间的体长差异均不显著(P>0.05)。
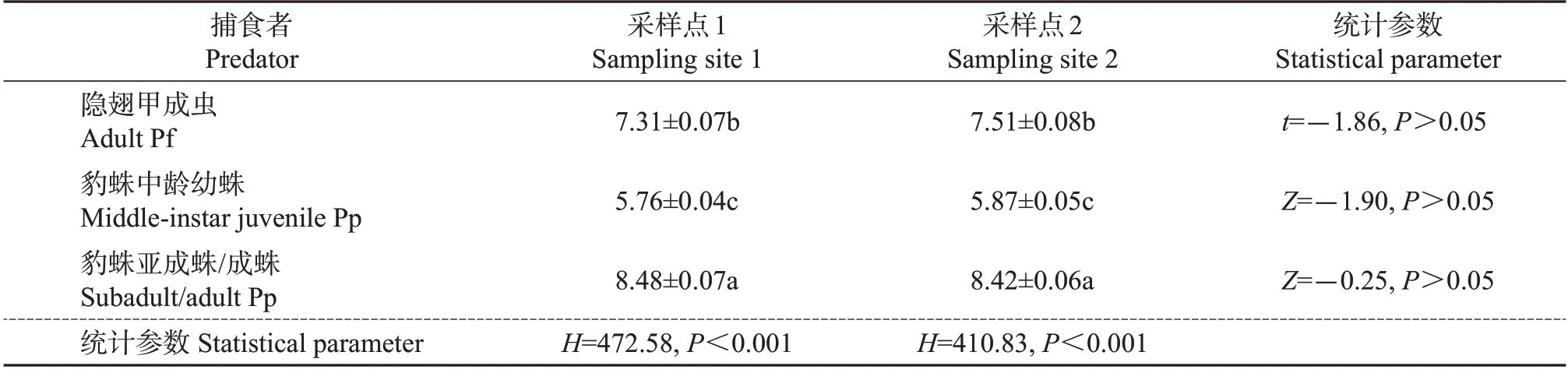
表3 用于IGP中集团内猎物DNA检测的捕食者体长分析Table 3 Analysis of the body length of predators used for determination of intraguild prey DNA in the IGP mm
2.1.3.2 DNA检出率
对采集到的1 527头隐翅甲和豹蛛个体肠道内集团内猎物DNA的检出率进行分析,结果如图3所示。从中可知:尽管3类天敌间无IGP(集团内猎物DNA 检出率为0)的发生率均显著高于它们间IGP(集团内猎物DNA 检出率大于0)的发生率(P<0.05),但隐翅甲成虫肠道内豹蛛DNA 的检出率及豹蛛亚成蛛/成蛛肠道内隐翅甲DNA的检出率分别高达35.4%和22.7%,而豹蛛中龄幼蛛肠道内隐翅甲DNA的检出率则低至3.9%。
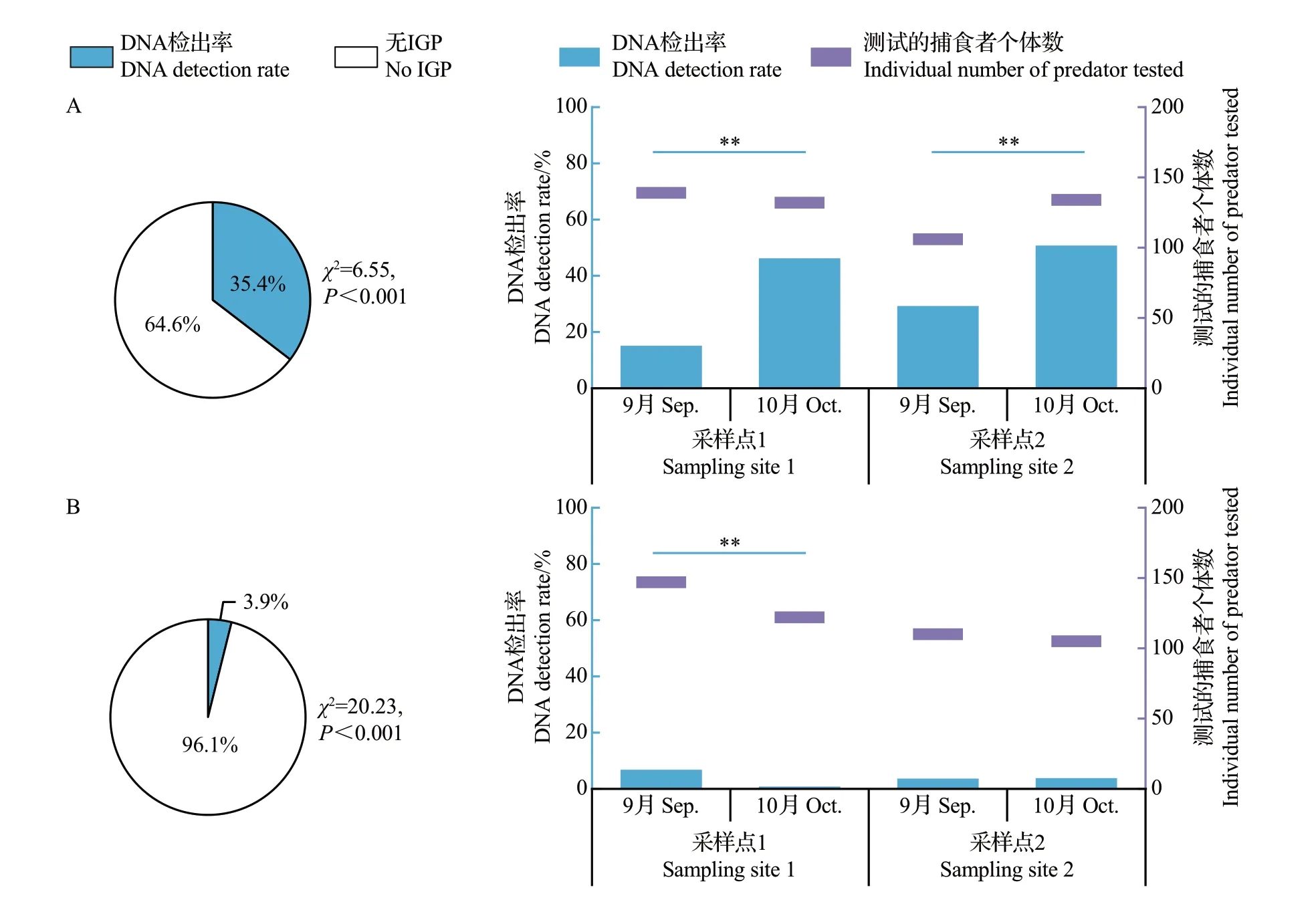
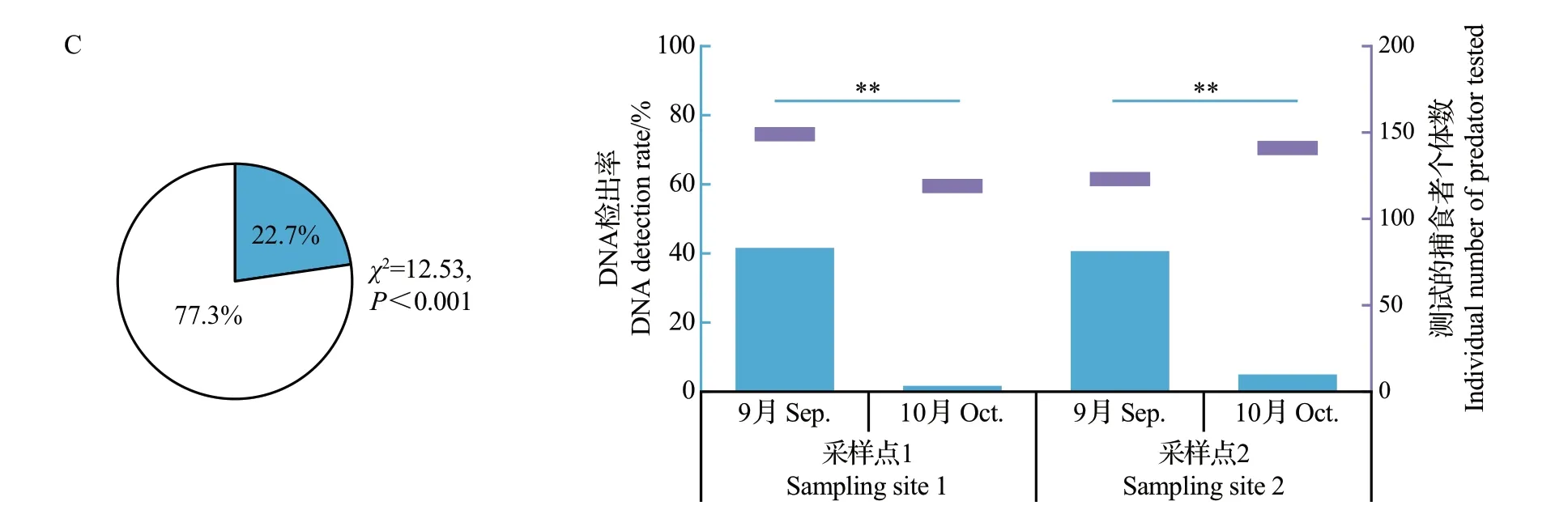
图3 拟环纹豹蛛和青翅蚁形隐翅甲间IGP中的集团内猎物DNA检出率Fig.3 DNA detection rates of intraguild prey in the IGP between Pp and Pf
2 个采样点的隐翅甲肠道内豹蛛DNA 的检出率均为10 月大于9 月,且差异极显著(P<0.01),而豹蛛亚成蛛/成蛛肠道内隐翅甲DNA的检出率均为9 月极显著大于10 月(P<0.01)。豹蛛中龄幼蛛肠道内隐翅甲DNA 的检出率在9—10 月间的变化规律因采样点而异,采样点1 的该DNA 检出率为9 月极显著高于10月(P<0.01),但采样点2中9—10月间该DNA 检出率无显著性差异(P>0.05)。另外,除9月隐翅甲体内豹蛛DNA检出率在2个采样点间差异极显著外(P<0.01),同一月3类天敌体内集团内猎物DNA 检出率在2 个采样点间均差异不显著(P>0.05)。
3类天敌体内集团内猎物DNA检出率与测定的集团内捕食者个体数间均无显著相关性(P>0.05);其中,在隐翅甲捕食豹蛛、豹蛛中龄幼蛛或亚成蛛/成蛛捕食隐翅甲的IGP中,它们间的Pearson相关系数分别为0.07(P=0.94)、0.56(P=0.42)、0.29(P=0.71)。
2.1.3.3 DNA拷贝数
对上述1 527 头2 种天敌中检出有集团内猎物DNA 的321 头个体进一步分析,结果如表4 所示。从中可知:在隐翅甲成虫捕食豹蛛中,2个采样点的集团内猎物DNA拷贝数均为10月大于9月,且采样点2的结果差异极显著(P<0.01);在豹蛛中龄幼蛛或亚成蛛/成蛛捕食隐翅甲中,2 个采样点的集团内猎物DNA拷贝数均为9月大于10月,但差异均不显著(P>0.05)。
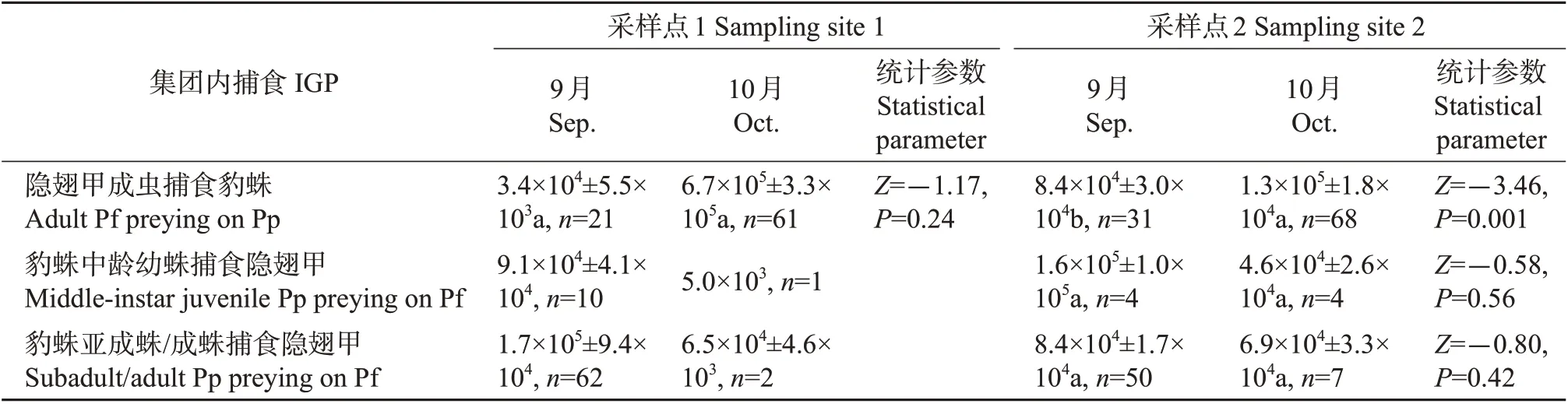
表4 拟环纹豹蛛和青翅蚁形隐翅甲肠道内集团内猎物DNA拷贝数Table 4 DNA copies of intraguild prey in the guts of Pp and Pf
除9 月的豹蛛亚成蛛/成蛛捕食隐翅甲和10 月的隐翅甲成虫捕食豹蛛的集团内猎物DNA 拷贝数在不同采样点间存在显著性差异(P<0.05)外,其他月份隐翅甲成虫捕食豹蛛、豹蛛中龄幼蛛或亚成蛛/成蛛捕食隐翅甲中的集团内猎物DNA 拷贝数在同一月份不同采样点间均差异不显著(P>0.05)。
2.1.3.4 环境温度与集团内猎物DNA 检出率的相关性分析
田间温度会影响天敌的捕食作用[13],包括对IGP 的影响[7],因此,对再生稻田2 个采样点隐翅甲和豹蛛间的集团内猎物DNA 检出率与环境温度随时间的变化进行相关性分析,结果如图4 所示。从中可知:隐翅甲肠道内豹蛛DNA 检出率可划分为>50%、10%~50%和<10%3 个区间,与之相对应的DNA 检出率和环境温度均值分别为85.5%和17.5 ℃(温度区间为15~21 ℃)、21.0%和18.0 ℃(温度区间为15~23 ℃)以及2.0%和22.0 ℃(温度区间为17~27 ℃);豹蛛中龄幼蛛肠道内隐翅甲DNA 检出率则无明显的区间变化,大多在10%以下,均值为7.3%;豹蛛亚成蛛/成蛛肠道内隐翅甲DNA 检出率可分为>35%和<35%2 个区间,与之相对应的DNA 检出率和环境温度均值分别为63.3%和22.4 ℃(温度区间为17~27 ℃)以及3.7%和17.6 ℃(温度区间为15~21 ℃)。
通过Spearman 相关性分析发现,田间温度与隐翅甲捕食豹蛛后的豹蛛DNA 检出率间呈极显著中度负相关(P<0.01),与豹蛛亚成蛛/成蛛捕食隐翅甲后的隐翅甲DNA 检出率呈极显著中度正相关(P<0.01),与豹蛛中龄幼蛛肠道内隐翅甲DNA 检出率相关性不显著(P>0.05)(图4)。
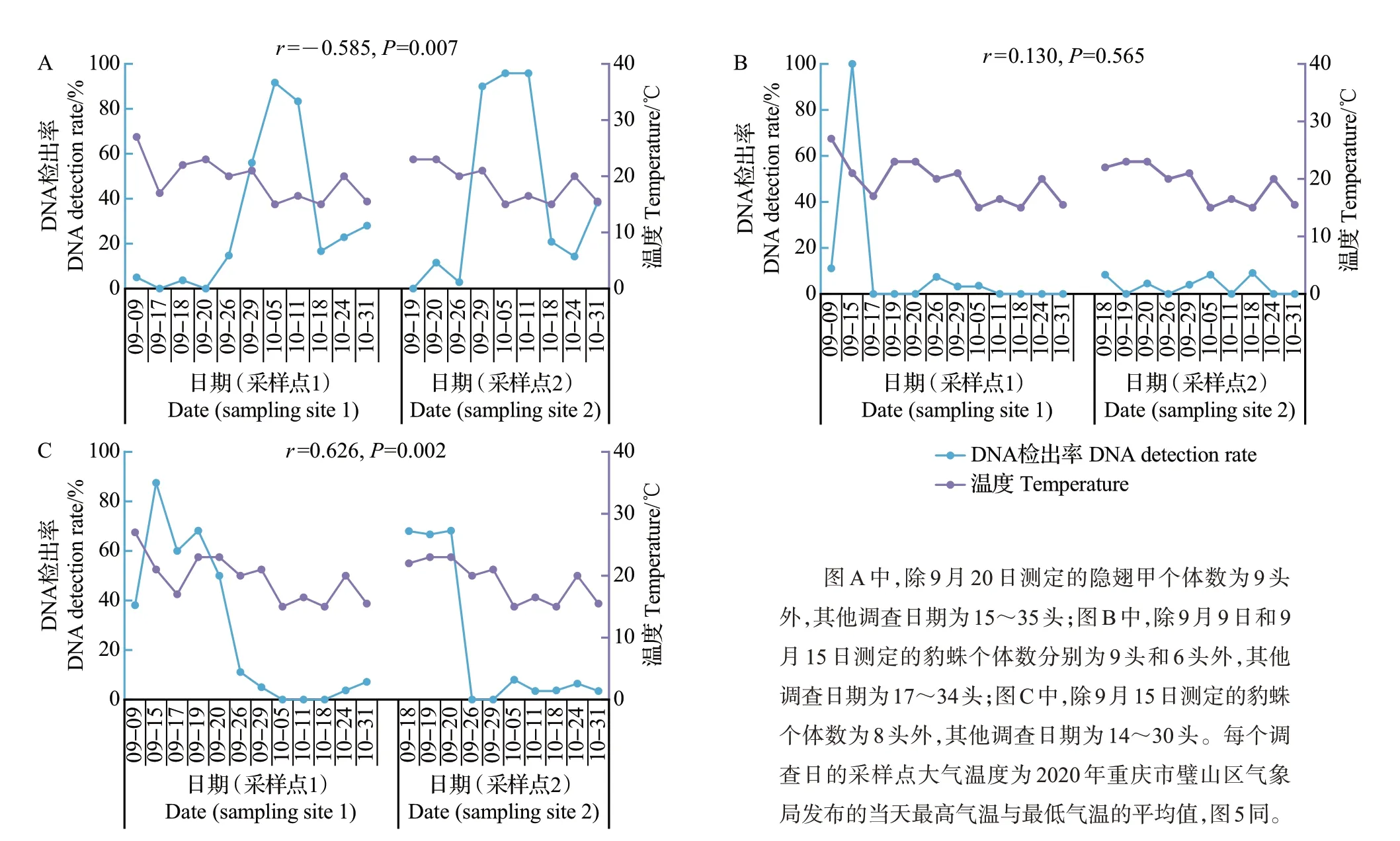
图4 拟环纹豹蛛和青翅蚁形隐翅甲间IGP中的集团内猎物DNA检出率与环境温度变化的相关性Fig.4 Correlations between intraguild prey DNA detection rates in the IGP of Pp and Pf and the changes of ambient temperatures
分别以“积温模型”“线性模型”和“Logistic 模型”方程拟合田间温度对这3类天敌体内集团内猎物DNA检出率的影响规律,结果如图5所示。从中可知:隐翅甲捕食豹蛛(A)和豹蛛亚成蛛/成蛛捕食隐翅甲(C)的拟合方程均达到极显著水平(P<0.01),而豹蛛中龄幼蛛捕食隐翅甲(B)的拟合方程不显著(P>0.05)。当温度升高时,隐翅甲捕食豹蛛的概率显著下降,豹蛛DNA检出率达50%时的环境温度约为15.5 ℃;而豹蛛亚成蛛/成蛛捕食隐翅甲的概率则随温度升高而显著上升,隐翅甲DNA检出率达50%时的环境温度约为22 ℃,特别是在24~28 ℃间的隐翅甲DNA检出率高达65%左右(图5)。

图5 拟环纹豹蛛和青翅蚁形隐翅甲间IGP中温度对集团内猎物DNA检出率的影响Fig.5 Effects of the ambient temperatures on intraguild prey DNA detection rates in the IGP between Pp and Pf
2.2 2 种捕食性天敌间的IGP 规律及影响因素
2.2.1 2 种捕食者间的IGP 分析
2.2.1.1 2种捕食者的死亡率
试验前对豹蛛成蛛饥饿处理和隐翅甲成虫未饥饿处理的试验中,T1和CK1组均未出现豹蛛死亡,而隐翅甲成虫的死亡率分别为20%和8%(图6A)。从中可知:除了第1天外,T1处理中隐翅甲成虫的死亡率均高于CK1,且在第4—6天出现显著性差异(P<0.05)。在试验前均未对豹蛛成蛛和隐翅甲成虫进行饥饿处理的试验中,T2和CK2组均未出现豹蛛死亡,而隐翅甲成虫的死亡率分别为23%和15%(图6B)。从中可知,从第3天开始T2处理中隐翅甲成虫的死亡率均高于CK2,但两者间差异不显著(P>0.05)。
另外,由图6A和图6B比较可知,在相同的观察时间T1和T2间的隐翅甲死亡率均差异不显著(P>0.05);与此相似,CK1和CK2间的隐翅甲死亡率在各个观察时间也均差异不显著(P>0.05)。
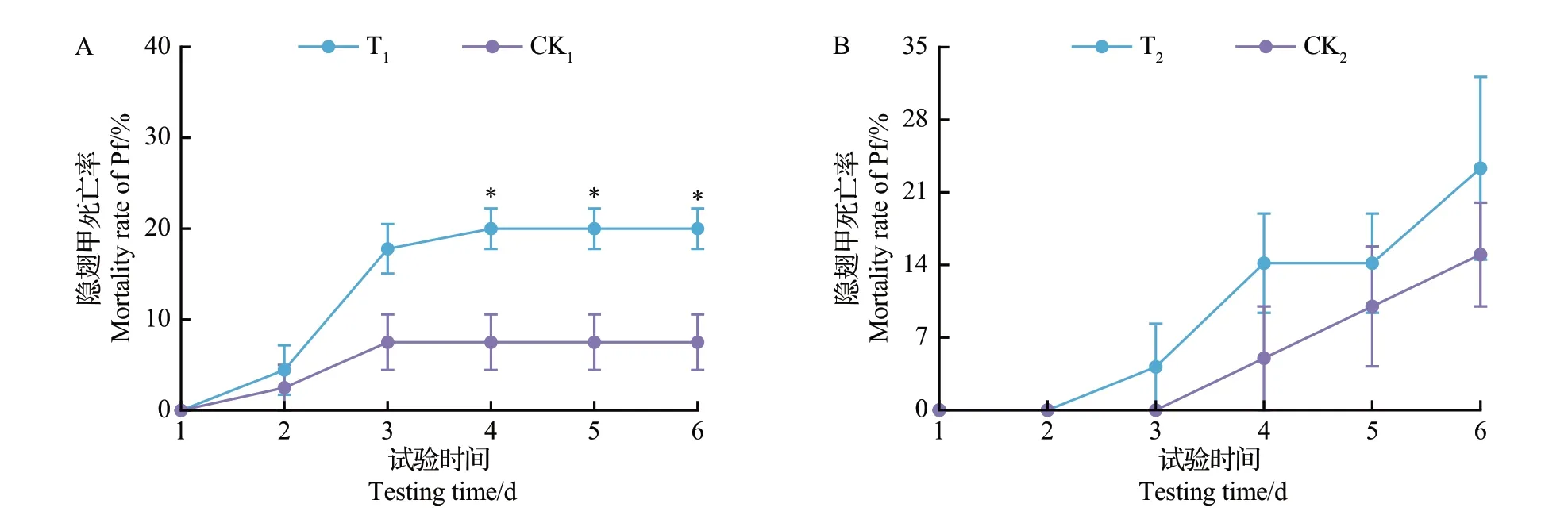
图6 22 ℃下培养皿共存系统中饥饿(A)和未饥饿(B)拟环纹豹蛛成蛛与未饥饿青翅蚁形隐翅甲成虫间的IGP分析Fig.6 IGP analysis between non-starvation adult Pf and adult Pp of starvation (A) and non-starvation (B) treatments in Petri dish coexistence systems at 22 ℃
试验前对豹蛛低龄幼蛛未饥饿处理和隐翅甲成虫饥饿处理的试验中,T3和CK3组均出现了豹蛛低龄幼蛛和隐翅甲成虫死亡的情况。其中,在T3处理中,豹蛛低龄幼蛛和隐翅甲成虫的死亡率分别为48%和23%;而在CK3组中,豹蛛低龄幼蛛和隐翅甲成虫的死亡率分别为5%和25%(图7A1~A2)。从中可知:T3处理中豹蛛低龄幼蛛的死亡率除了第1天显著高于CK3组(P<0.05)外,其他时间均极显著高于CK3组(P<0.01);在第1—4 天,隐翅甲成虫的死亡率在2个处理间无显著差异(P>0.05),但在第5—6 天,CK3组中隐翅甲成虫的死亡率显著高于T3组(P<0.05)。
试验前对豹蛛低龄幼蛛和隐翅甲成虫均未饥饿处理的试验中,T4和CK4组均出现了豹蛛低龄幼蛛和隐翅甲成虫死亡的情况。其中,在T4处理中豹蛛低龄幼蛛和隐翅甲成虫的死亡率分别为53%和13%;而在CK4中豹蛛低龄幼蛛和隐翅甲成虫的死亡率分别为5%和15%(图7B1~B2)。从中可知,T4处理中豹蛛低龄幼蛛的死亡率在每个观察时间均高于CK4组,且在第3 天后均极显著高于CK4组(P<0.01);而第3—5天隐翅甲成虫的死亡率在T4和CK4组间差异不显著(P>0.05)。
由图7可知,除第2天(P<0.01)外,IGP处理和对照组的豹蛛低龄幼蛛死亡率在隐翅甲成虫饥饿和未饥饿试验(图7A1、B1)对应的各个观察时间均差异不显著(P>0.05)。同时,IGP处理的隐翅甲成虫死亡率在这2个试验(图7A2、B2)对应的各个观察时间均差异不显著(P>0.05);除了第1 天(死亡率为0)外,CK3和CK4的隐翅甲成虫死亡率在这2个试验对应的各个观察时间均出现了显著性差异(P<0.05)。
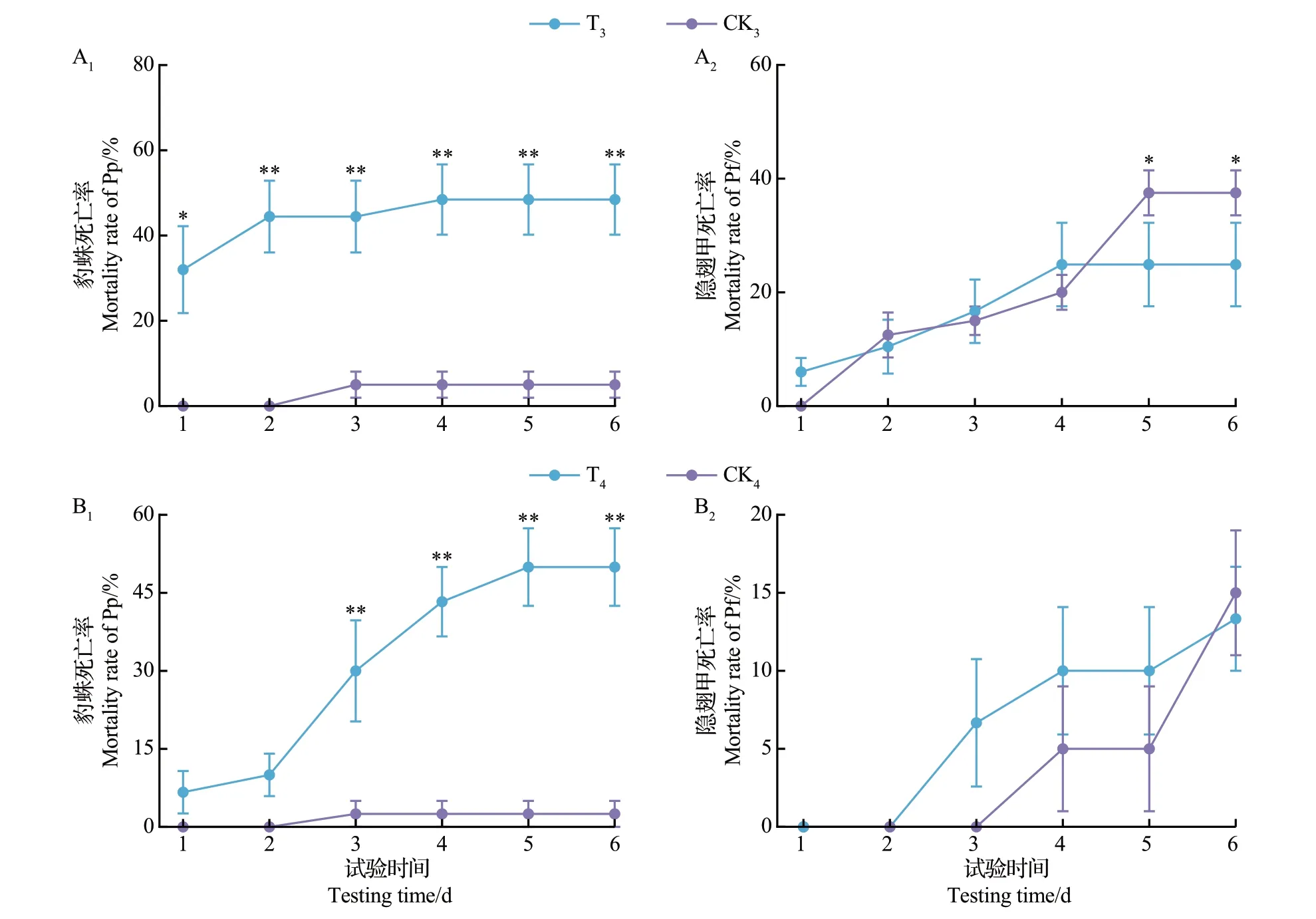
图7 22 ℃下培养皿共存系统中饥饿(A1~A2)和未饥饿(B1~B2)青翅蚁形隐翅甲成虫与未饥饿拟环纹豹蛛低龄幼蛛间的IGP分析Fig.7 IGP analysis between non-starvation low-instar juvenile Pp and adult Pf of starvation (A1-A2) and non-starvation (B1-B2)treatments in Petri dish coexistence systems at 22 ℃
2.2.1.2 IGP的水平与对称性
在2.2.1.1节豹蛛成蛛和隐翅甲成虫的2个集团内捕食试验中,豹蛛成蛛的死亡率均为0,豹蛛成蛛捕杀隐翅甲成虫的IGP 发生率均很低,且豹蛛成蛛总是单向性捕食隐翅甲成虫。在2.2.1.1 节豹蛛低龄幼蛛和隐翅甲成虫的2 个集团内捕食试验中,豹蛛低龄幼蛛和隐翅甲成虫均有死亡现象发生,隐翅甲成虫捕杀豹蛛低龄幼蛛的IGP 发生率均较高,且隐翅甲成虫也总是单向性捕食豹蛛低龄幼蛛。另外,上述这2 类配对试验中捕食者间的IGP 对称性均为完全非对称(表5)。
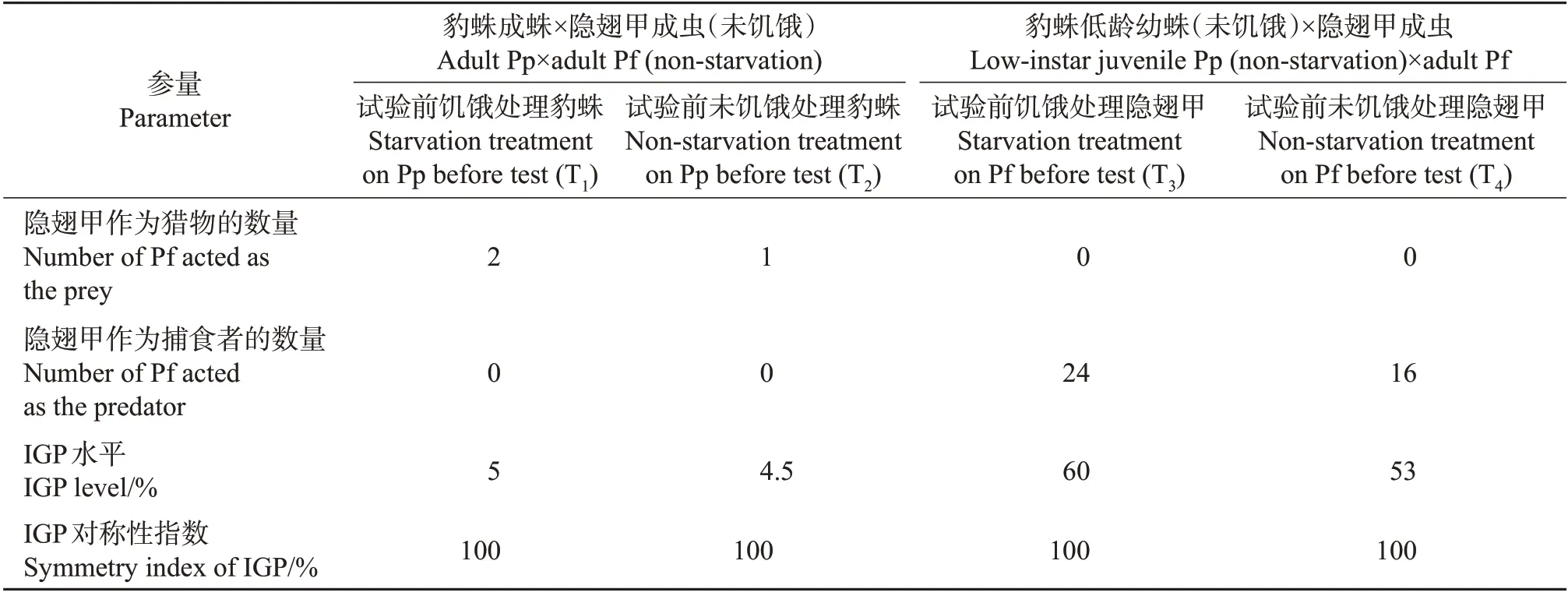
表5 22 ℃下培养皿共存系统中拟环纹豹蛛和青翅蚁形隐翅甲间的IGP分析Table 5 IGP analysis between Pp and Pf in Petri dish coexistence systems at 22 ℃
2.2.2 影响因素分析
上述2.2.1 节中,IGP 发生率高的配对试验存在于豹蛛低龄幼蛛和隐翅甲成虫之间,因此,选择该配对试验进行它们间的IGP影响因素分析。结果表明:除了第2 天外,其他观察时间Ss+Rs+Wi+20Ht 处理中豹蛛低龄幼蛛的存活率均显著大于Ss+Rs+Wi处理的值(P<0.05);在第4—6天,Ss+Rs+Wi+20Ht 处理中豹蛛低龄幼蛛的存活率也显著大于10Tr处理的值(P<0.05);另外,除Ss+Rs+Wi+20Ht 处理外,在所有观察时间,CK 处理中豹蛛低龄幼蛛的存活率均高于其他各处理的值,且与Ss+Rs+Wi 处理的值均差异显著(P<0.05),也与除第2 天外的其他各观察时间的10Tr+20 Ht 处理的值差异显著(P<0.05)(Kruskal-WallisH单因素检验法)(图8)。
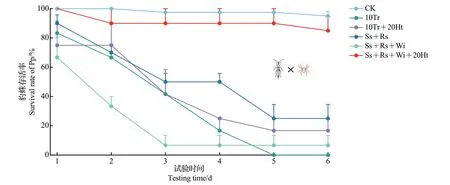
图8 各因素对拟环纹豹蛛低龄幼蛛和青翅蚁形隐翅甲成虫间IGP中集团内猎物存活率的影响Fig.8 Effects of different factors on the survival rates of intraguild prey in the IGP of low-instar juvenile Pp and adult Pf
3 讨论与结论
3.1 2 种捕食性天敌间IGP 的分子检测
利用qPCR方法研究捕食者捕食作用的关键和难点是特异性靶基因引物和探针的设计[22],这是因为,在PCR扩增过程中出现的假阳性会影响检测结果的准确性。另外,对一些近缘物种来说,在同一基因上寻找连续3个差异碱基的难度很大。本研究首次建立和优化的qPCR检测体系中,针对这2种捕食者靶基因设计的引物和探针的特异性很强;该检测体系的变异系数均小于5%,检测的灵敏度也比较高,能满足田间样品分析的要求。此外,本研究建立的qPCR 检测体系的扩增效率为90%~110%,这进一步表明该检测体系的结果可靠。
再生稻田拟环纹豹蛛不同发育阶段各虫态(成蛛和幼蛛)及青翅蚁形隐翅甲成虫的发生量均很大。而经典的IGP 理论认为,集团内捕食者和集团内猎物的角色定位与它们间相对体型大小(发育阶段)密切相关[2]。因此,本研究选择2个发育阶段(用体长表示)的拟环纹豹蛛虫态为试验对象,分析了它们与青翅蚁形隐翅甲成虫间的IGP关系;同时,根据王智[21]报道可知,这些豹蛛亚成蛛和中龄幼蛛龄期应分别为7~8龄和5~6龄。本研究中这些试验对象的体长分析表明,3 类捕食者个体能有效反映它们之间的IGP 关系。有研究也指出,不同体型大小的捕食者间或同一捕食者各发育阶段虫态间的IGP存在明显差异[4,23-24]。
尽管在晚稻早期,血清学研究已指出了豹蛛能捕杀隐翅甲[10],但相较于qPCR 探针法,血清学方法存在检测灵敏度和准确度较低的缺点。此外,隐翅甲能否捕食豹蛛尚未见报道。本研究结果表明,再生稻田青翅蚁形隐翅甲和拟环纹豹蛛间存在较为普遍的双向IGP。相关的研究也指出稻田捕食者间普遍存在IGP。例如,基于qPCR 技术的研究表明,水稻抽穗期稻田的蜘蛛等主要捕食者对稻飞虱2种重要天敌黑肩绿盲蝽和中华淡翅盲蝽存在IGP[11]。而稻田笼罩试验结果表明,拟环纹豹蛛、台湾裂头小皿蛛和黑肩绿盲蝽三者间存在IGP,且该IGP 抑制了台湾裂头小皿蛛和黑肩绿盲蝽种群的发生量[12]。本研究结果还显示,这2种捕食者间IGP的发生率与它们的发育阶段(相对体型大小)存在着密切关系。IGP 理论也认为,捕食者间的相对体型大小决定着IGP的方向和发生率[2]。本研究中,环境温度变化也显著影响了再生稻田集团内捕食者肠道内的集团内猎物DNA检出率;而且从环境温度和该DNA检出率的回归方程可知,隐翅甲成虫对豹蛛的IGP 主要发生在再生稻田较低温阶段,而豹蛛对隐翅甲的IGP主要发生在该稻田较高温时期。有研究指出,环境温度能影响拟环纹豹蛛等集团内捕食者对集团内猎物的IGP 强度,且这种影响程度也与不同的集团内捕食者种类有关[25]。FRANCES等[7]对3种蜻蜓幼虫的IGP 进行研究后发现,不同种类的蜻蜓幼虫对温度变化表现出不同的行为反应:当温度升高时,白颜蜻(Leucorrhinia intacta)幼虫的被捕食率显著增加,且增加的幅度明显超过了淡蓝鹰蜻(Erythemis simplicicollis)和普通白尾蜻(Plathemis lydia)幼虫被捕食率增加的幅度。ROGERS 等[8]研究表明,当地的蓝蟹(Callinectes sapidus)在高温时更有竞争力,而入侵的欧洲青蟹(Carcinus maenas)在低温下更有竞争性;温度升高增强了蓝蟹的捕食能力,即蓝蟹对欧洲青蟹的捕食率显著提高。最新研究指出,温度升高影响了异色瓢虫(Harmonia axyridis)和龟纹瓢虫(Propylaea japonica)的种间干扰竞争及对桃蚜(Myzus persicae)的捕食率[9]。
本研究发现,在气温较低的10 月,隐翅甲肠道内豹蛛DNA 拷贝数要普遍高于温度较高的9 月。昆虫和蜘蛛作为冷血动物,其代谢能力易受到环境温度变化的影响[26],而低温能减缓捕食者体内猎物DNA 的消化和降解速率[27]。例如,在环境温度为20 ℃时,2 种步甲(Pterostichus melanarius和Nebria brevicollis)对麦长管蚜(Sitobion avenae)的消化能力显著高于在12 ℃和16 ℃下的消化能力[28];地豹蛛(Pardosa agraria)和肖蛸蛛(Tetragnathaspp.)对赤条纤盲蝽(Stenotus rubrovittatus)的消化能力在25 ℃时要显著高于16 ℃[29]。但也存在相反的研究结果,即捕食者对猎物的消化能力受温度变化的影响较小。例如,二星瓢虫(Adalia bipunctata)对禾谷缢管蚜(Rhopalosiphum padi)的消化能力在21 ℃和14 ℃间无显著性差异[30]。此外,捕食者肠道内猎物DNA残留量还与其取食量密切相关。例如,大斑长足瓢虫(Coleomegilla maculata)取食马铃薯甲虫(Leptinotarsa decemlineata)卵的数量显著影响了其肠道内马铃薯甲虫DNA拷贝数,瓢虫取食猎物的量越大,其肠道内猎物DNA 的拷贝数就越多[31]。因此,本研究中2种捕食者肠道内集团内猎物DNA的拷贝数在10 月和9 月之间的差异也可能与它们在不同季节温度下对集团内猎物的采食量有关。
3.2 2 种捕食性天敌间的IGP 及其影响因素分析
IGP理论认为,2种物种(包括幼期)间IGP的方向通常是单向性的且不对称的[2],但也存在双向性和对称的情况[4]。本研究的室内试验结果指出,拟环纹豹蛛和青翅蚁形隐翅甲成虫间的IGP方向是双向性的且不对称的,但它们之间谁是集团内捕食者或猎物与它们个体所处的发育阶段直接相关。这种结果与DNA 检出率统计结果存在一致性。相关研究指出,在特定生态系统中,这些广食性天敌间的IGP 常为单向性的,即体型大的种类捕杀体型小的种类[32]。本研究的室内试验还发现,豹蛛亚成蛛/成蛛与隐翅甲成虫间的IGP 发生率很低,这与再生稻田IGP分子检测的结果相矛盾;由此,我们推测再生稻田中这种较高DNA检出率可能是豹蛛亚成蛛/成蛛捕杀隐翅甲幼虫导致的结果,而这有待进一步的研究。另外,本研究也发现,集团内捕食者的饥饿程度能够明显影响IGP 发生的进度,但对该IGP发生率的影响却有限;集团外猎物的存在可降低IGP 的强度,但没有改变IGP 的方向和对称性。在水稻抽穗期稻田,不同种类捕食者(蜘蛛和隐翅甲)对稻飞虱天敌黑肩绿盲蝽和中华淡翅盲蝽存在IGP,集团内捕食者对黑肩绿盲蝽的IGP 强度显著高于对中华淡翅盲蝽的强度,黑肩绿盲蝽和中华淡翅盲蝽遭遇的IGP 强度与捕食者种类及集团外猎物的丰度有关[11]。在水稻生育后期稻田,集团内猎物黑肩绿盲蝽的存在明显降低了集团内捕食者拟环纹豹蛛对集团内猎物台湾裂头小皿蛛的捕食强度[12]。
根据本研究中2种天敌间IGP的分子检测结果推测,隐翅甲成虫对豹蛛的IGP 应该发生在豹蛛低龄幼蛛阶段,而豹蛛对隐翅甲的IGP 应该发生在豹蛛亚成蛛/成蛛阶段。据此,本研究设计了豹蛛1~2龄幼蛛/成蛛与隐翅甲成虫的2个室内IGP试验。其中,室内IGP 试验结果明确了隐翅甲成虫与豹蛛低龄幼蛛间具有较高IGP发生率的结论,显然,这是对隐翅甲成虫体内豹蛛DNA 检出结果的进一步重要解析。同时,本研究使用天台刺齿跳虫和白翅叶蝉作为影响这2 种捕食者IGP 的集团外猎物,这主要是因为这2种集团外猎物在7个月的休耕季节冬水田生境(包括再生稻田)发生量巨大,特别是刺齿跳虫等弹尾虫种类在该季节水稻/植物残体系统重建的节肢动物群落中充当了“关键/中心”类群[13,16-17]。结果表明,上述2 种集团外猎物对这2 种捕食者间IGP 发生率的影响与豹蛛的发育阶段(相对体型大小)有关,而且集团外猎物和非生物因素的结合能显著降低捕食者间IGP 的发生率。YU 等[33]和RANJBAR等[34]研究发现,瓢虫间的IGP发生率随集团外猎物的增加而显著下降。但是,集团外猎物的增加也并不总是降低IGP 的发生,而这种情况的发生通常与IGP中集团内捕食者和集团内猎物双方幼体期所处的不同发育阶段有关[4]。
本研究中设置的稻秆主要作为集团内猎物的避难所,此外,土壤基质和淹水条件的设置还模拟了田间生境条件,而这些非生物因素无疑都增加了捕食者生境的复杂性,且其与集团外猎物在试验期间的结合不同程度地影响了捕食者间IGP 的发生率。有研究指出,生境中水的存在能增加拟水狼蛛(Pirata subpiraticus)对褐飞虱的捕食量,但对食虫沟瘤蛛(Oedothorax insecticeps)的捕食量无影响[35]。其他研究发现,在楔形舞蛛(Alopecosa cuneata)捕食沼泽豹蛛(Pardosa palustris)试验中,掩体的存在能减少豹蛛幼蛛死亡率,认为微生境复杂性可增强狼蛛科不同种类在农田中的共存性[36]。冬季果园诱捕试验显示,诱捕器中避难所的存在会影响近管蛛(Anyphaenaspp.)和逍遥蛛(Philodromusspp.)的死亡率;与无避难所诱捕器相比,有避难所诱捕器能明显降低小型蜘蛛的死亡率(被较大蜘蛛捕食)[37]。RYPSTRA 等[6]的研究指出,生境复杂性对豹蛛Pardosa milvina和穴狼蛛Hogna helluo的捕食均产生了不利影响,但这种生境复杂性也保护了该豹蛛免被穴狼蛛捕食。
总之,本研究首次建立了青翅蚁形隐翅甲和拟环纹豹蛛的qPCR 探针法检测体系,在此基础上揭示了再生稻田中这2 种捕食者间IGP 的发生规律,并进一步在室内条件下探究了影响该IGP规律的生物和非生物因素。这些研究结果为深入研究稻田捕食性天敌间IGP 打下了坚实的技术方法基础,同时丰富了农田生态系统中捕食者间的IGP 理论体系。

