α-酮戊二酸及其钠盐对雨生红球藻生长和虾青素积累的促进作用*
张豪杰 李旺宁 梁梦静 李亚男 张春辉 季春丽 李润植 崔玉琳 秦 松 崔红利
α-酮戊二酸及其钠盐对雨生红球藻生长和虾青素积累的促进作用*
张豪杰1李旺宁1梁梦静1李亚男1张春辉1季春丽1李润植1崔玉琳2秦 松2崔红利1j
(1. 山西农业大学农学院 分子农业与生物能源研究所 山西太谷 030801; 2. 中国科学院烟台海岸带研究所 海岸带生物学与生物资源保护重点实验室 山东烟台 264003)
雨生红球藻是已知虾青素(astaxanthin, AST)含量最高的生物, 是理想的细胞制备工厂。尽管研究表明添加α-酮戊二酸(OG, α-oxoglutarate)能有效促进混养条件下雨生红球藻AST积累, 但在自养条件下是否也有类似效果不清楚。研究以自养雨生红球藻为对象, 在正常(CK)、高光(HL)、缺氮(DN)和高光-缺氮双重逆境(HL-DN)下从细胞生长和AST积累两方面评估OG及其钠盐(OG-2Na)的促进作用。结果显示, 添加OG或OG-2Na显著缓解HL、DN和HL-DN胁迫对细胞生长的抑制作用, 培养至6 d的生物量分别为0.58、0.53和0.38 g/L, 约是未添加组的2.0倍。添加OG或OG-2Na显著促进AST积累。培养至6 d, 在HL、DN和HL-DN下, AST含量分别达到13.62、19.51和28.29 mg/g, 是未添加组的2.39、1.16和1.35倍。同时在胁迫条件下, 添加OG或OG-2Na有效提高单位细胞中AST含量。针对OG和OG-2Na添加, 最大单位细胞AST含量分别出现在HL和HL-DN条件下, 达到53.72和60.58 pg/cell, 是对照的3.09和2.83倍。在CK下, 添加10.0 mg/L的OG或OG-2Na, 其AST含量显著高于单独的胁迫条件。上述结果证实OG或OG-2Na不但可减少HL、DN和HL-DN胁迫对红球藻细胞生长的抑制、显著提高其AST含量, 是一种在提高AST产量的有效途径。
雨生红球藻; α-酮戊二酸; 生长; 虾青素积累; 促进作用
虾青素(astaxanthin, AST)具有良好的着色效果和重要的生物学功能, 已被广泛应用于多种领域(Shah, 2016), 目前市场供不应求(Li, 2020)。雨生红球藻()是一种淡水单细胞绿藻, 是目前已知AST含量最高的物种, 在胁迫条件下AST含量可达细胞干重的4%, 是极为理想的天然AST来源(崔红利等, 2021)。然而, 雨生红球藻中AST的积累是一个胁迫诱导的过程, 即生物量积累与AST积累相互矛盾, 这种矛盾已成为利用雨生红球藻高效生产AST的限制因素(Li, 2020)。因此, 挖掘高效胁迫信号、解析诱导机制并建立兼顾细胞生长与AST积累的调控技术是解决上述矛盾的有力措施。
雨生红球藻中AST的积累受到多种信号因子和多层次水平的调控(Lee, 2018; Li, 2020)。高光和缺氮能有效促进AST积累。例如, 在同等高光强条件下, 与高自然光相比, 高蓝光显著增加雨生红球藻AST的积累, 且虾青素合成相关基因在转录水平的表达显著提高(Cui, 2013, 2021a, 2021b; Xi, 2016; Ma, 2018), 但高光下具有能耗高和显著抑制生长等缺点。缺氮也能显著诱导雨生红球藻中AST的积累(Cui, 2013, 2021a, 2021b; Zhao, 2020; Ahirwar, 2021), 但是存在培养周期长、易于污染等缺点。因此, 急需开发新型低能耗、方便快捷及环境友好型的高效胁迫条件。研究表明, 补充三羧酸循环中间代谢产物或植物生长调节剂耦合高光或缺氮是一种新型诱导体系(Lee, 2016;崔丹丹等, 2018; Lu, 2020; Yu, 2021, 2022)。
α-酮戊二酸(OG, α-oxoglutarate)是三羧酸循环中的重要中间代谢产物(Foyer, 2003), 同时作为生物体感知碳-氮信号的重要受体, 广泛参与植物多种代谢(Chen, 2006; Liu, 2013)。此外, 它还能够显著促进植物体内氨同化相关酶的活性, 进而改变谷氨酸的积累, 从而适应胁迫条件下的生长(Yuan, 2007)。在低水和缺氮的胁迫条件下, 添加外源OG能够增强小麦幼苗对氮素的同化能力, 进而促进对干物质的积累, 最终提高生物量(孙倩等, 2014)。在固氮蓝藻中, 添加OG可瞬间造成细胞内其浓度的增加, 产生一个缺氮(DN, deficient nitrogen)的假定信号, 从而诱导异形胞的形成与固氮, 最终促进生物量(Zhao, 2010)。从雨生红球藻的代谢组学数据分析来看, OG含量的变化对多种胁迫条件具有不同的响应模式, 并推测其与AST的积累有关(Su, 2014)。在混养条件下, 添加OG能有效促进高碳氮比值(C/N=50)藻细胞内AST的积累(Lu, 2019, 2020), 但是对自养条件下的效果尚不清楚。
本研究以自养型雨生红球藻细胞为对象, 探讨在正常(CK, control)、高光(HL, high light)、DN和高光-缺氮双重逆境(HL-DN)条件下, 添加不同浓度OG及OG-2Na对细胞生长和AST积累的促进作用, 为构建高效AST积累的调控技术奠定基础。
1 材料和方法
1.1 藻种
试验所用藻株为Flotow 1844购自藻类和原生生物培养中心(英国CCAP藻种库: https://www.ccap.ac.uk/), 现保存于山西农业大学分子农业与生物能源研究所。藻株培养基为BG11培养基, 培养条件设置为温度(24±1) °C, 光/暗周期12 h/12 h、白天光照强度1 500 lx, 并且每8 h摇晃一次, 防止细胞贴壁。
1.2 实验设置
将培养至对数生长期的雨生红球藻以5 000 r/min离心5 min, 收集藻细胞, 然后重新悬浮在正常培养基和缺氮培养基中。OG及OG-2Na的浓度设置为0.1、1.0和10.0 mg/L。缺氮培养基为不添加硝酸钠的BG11培养基。高光处理的光照强度为16 000 lx。
实验设置如下: 未添加外源物组包括CK、DN、HL和HL-DN四组, 其中CK在1 500 lx正常培养基下培养、DN在1 500 lx缺氮培养基下培养、HL在16 000 lx正常培养基下培养和HL-DN在16 000 lx缺氮培养基下培养。添加外源物组包括分别在上述四种条件下添加不同浓度的OG或OG-2Na, 浓度设置为0.1、1.0和10 mg/L三种。每隔2 d定时取样用于各项生理指标的测定。
1.3 试验指标测定
1.3.1 细胞密度(cells/mL)的测定 从每种培养体系中吸取100 μL样品, 用移液枪将其转移到血球计数板中, 在光学显微镜下对细胞进行计数, 该显微镜连接到装有Optilab软件的计算机上。
1.3.2 生物量(g/L)的测定 取5 mL藻液用真空泵抽滤装置将其抽滤到预先称重为0(g)的孔径为0.45 μm滤膜上, 将滤膜置于烘箱中烘至恒重, 测定最终总干重1(g), 通过细胞干重和藻液体积来确定藻液的生物量浓度0(g/L), 生物量每隔2 d测定一次, 每个处理设置3次重复。根据如下公式计算:0= 1 000(1–0)/5。
1.3.3 虾青素含量(mg/L)的测定 采用(游泳等, 2011)的虾青素测定方法, 用二甲基亚砜提取虾青素, 于490 nm处测定光吸收。根据如下公式计算: 虾青素含量(mg/L)=4.5×OD490×稀释倍数。
1.3.4 虾青素含量(mg/g)的计算 根据如下公式计算: 虾青素含量(mg/g)=[虾青素含量(mg/L)/生物量(g/L)]。
1.3.5 单位细胞虾青素含量(pg/cell)的计算 根据如下公式计算: 单位细胞虾青素含量(pg/cell)=[虾青素含量(mg/L)/细胞密度(cell/mL)]×109。
1.4 统计分析
各处理组均设置3个平行样, 采用excel(2019)和SPSS 25.0软件对数据进行统计分析, 采用单因素方差分析法进行显著性分析(<0.05), 绘图采用Origin9软件(OriginLab Corporation, 美国)。
2 结果与分析
2.1 添加OG及OG-2Na对雨生红球藻生长的影响
在HL、DN及HL-DN下显著抑制雨生红球藻细胞的生长。其中, 培养至第6 d, 在HL、DN及HL-DN胁迫下的生物量分别是0.29、0.27和0.18 g/L, 只有CK组(0.64 g/L)的45.3%、42.2%及28.1% (图1)。
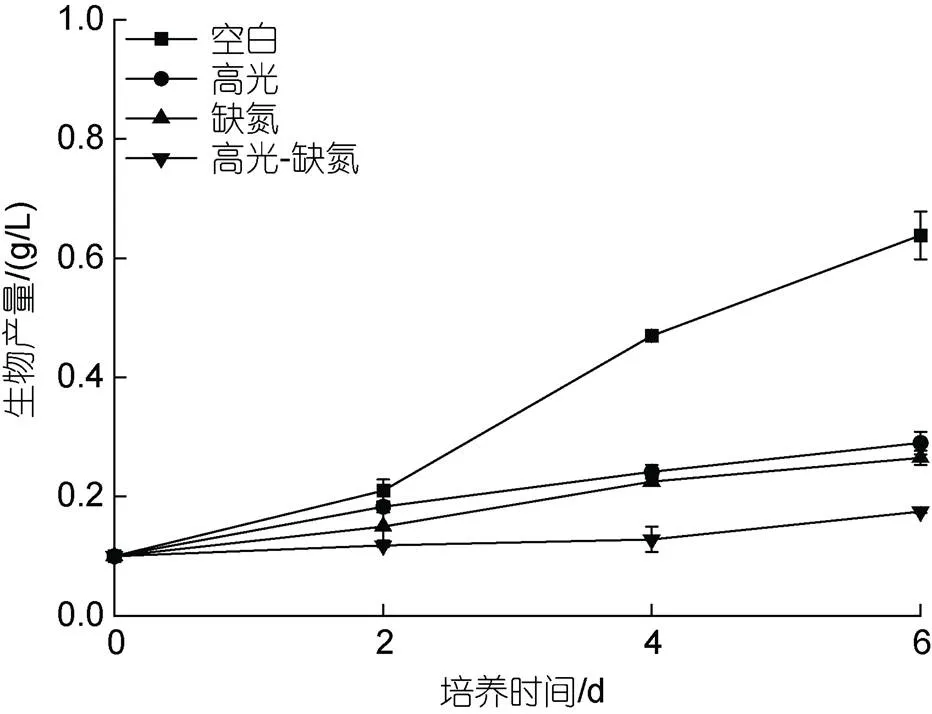
图1 在正常、高光、缺氮和高光缺氮下培养对雨生红球藻生长的影响
在CK下, 尽管在培养初期(2 d), 添加不同浓度的OG (0.1~10 mg/L)能促进藻细胞的生长, 但在后期对生长具有一定抑制作用, 并且与浓度呈正相关, 培养至6 d, 最终的生物量分别是0.45、0.51和0.57 g/L, 只有CK组(0.64 g/L)的70.3%、79.7%及89.1% (图2a)。在DN下, 添加不同浓度的OG均促进藻细胞的生长, 促进效果与OG浓度呈负相关。培养至6 d, 最终的生物量分别是0.39、0.43和0.53 g/L, 为DN对照组(0.27 g/L)的1.44、1.59和1.96倍(图2b)。在HL下, 添加不同浓度的OG均促进藻细胞的生长, 促进效果与浓度不相关。培养至6 d, 最终的生物量分别是0.52、0.58和0.58 g/L, 为HL对照组(0.29 g/L)的1.79、2.0和2.0倍(图2c)。在HL-DN下, 添加不同浓度的OG都能促进藻细胞的生长, 促进效果与浓度不相关。培养至6 d, 最终的生物量分别是0.33、0.35和0.36 g/L, 为HL-DN对照组(0.19 g/L)的1.83、1.94和2.0倍(图2d)。
在CK下, 添加不同浓度的OG-2Na对雨生红球藻的生长均有抑制作用, 并与浓度呈正相关。培养至6 d, 最终的生物量分别是0.38、0.43和0.54 g/L, 只有CK组(0.64 g/L)的59.3%、67.2%及84.4% (图3a)。在DN下, 添加不同浓度的OG-2Na均促进藻细胞的生长, 促进效果与OG浓度呈负相关。培养至6 d, 最终的生物量分别是0.36、0.48和0.49 g/L, 为DN对照组(0.27 g/L)的1.33、1.78和1.81倍(图3b)。在HL下, 添加不同浓度的OG-2Na均促进藻细胞的生长, 促进效果与浓度不相关。培养至6 d, 最终的生物量分别是0.32、0.37和0.47 g/L, 为HL对照组(0.27 g/L)的1.19、1.37和1.74倍(图3c)。在HL-DN下,添加不同浓度的OG-2Na都能促进藻细胞的生长, 促进效果与浓度不相关。培养至6 d, 最终的生物量分别是0.37、0.37和0.38 g/L, 为HL-DN对照组(0.18 g/L)的2.06、2.06和2.11倍(图3d)。
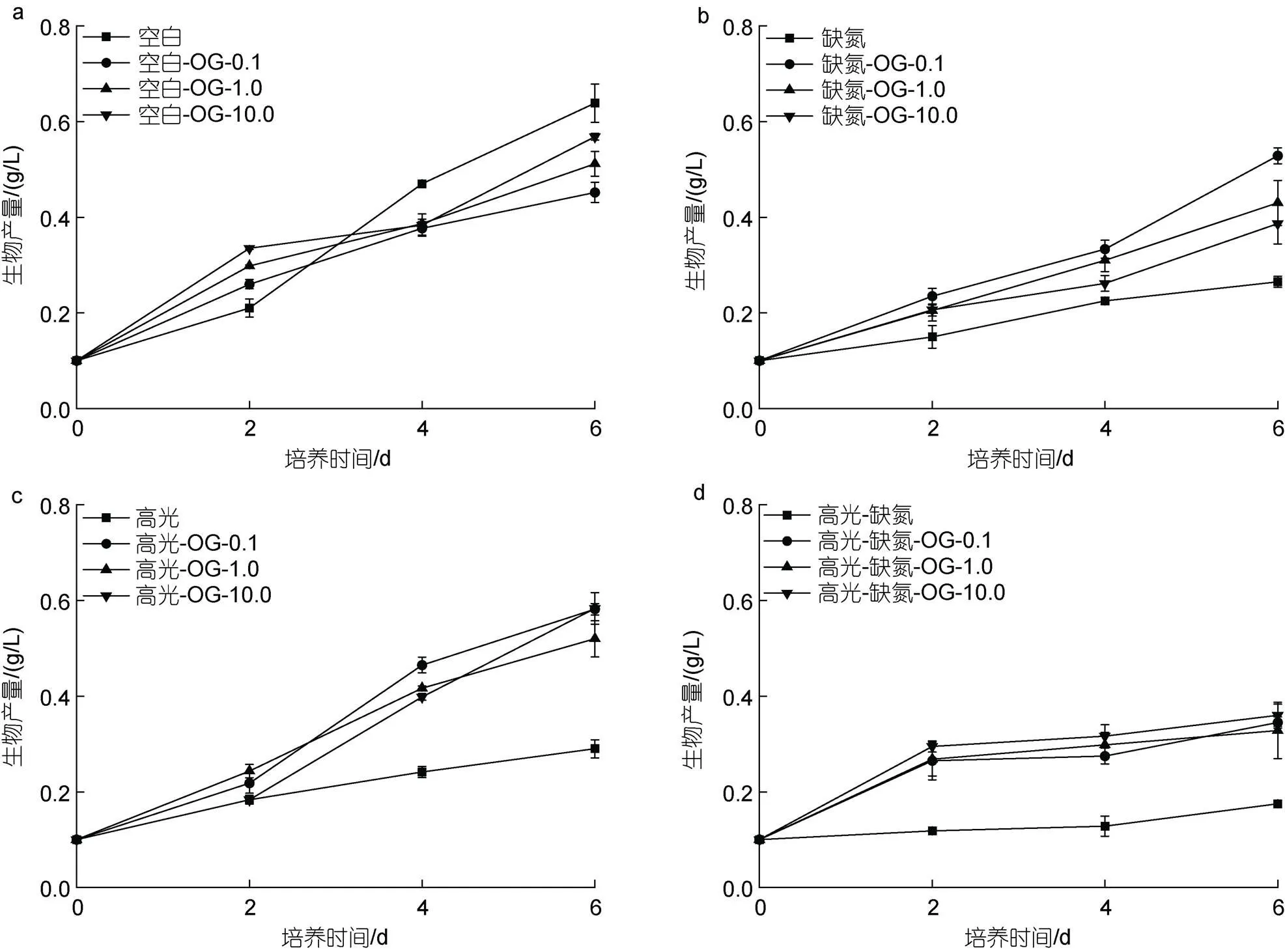
图2 在正常、高光、缺氮和高光缺氮添加α-酮戊二酸(OG)对雨生红球藻生长的影响
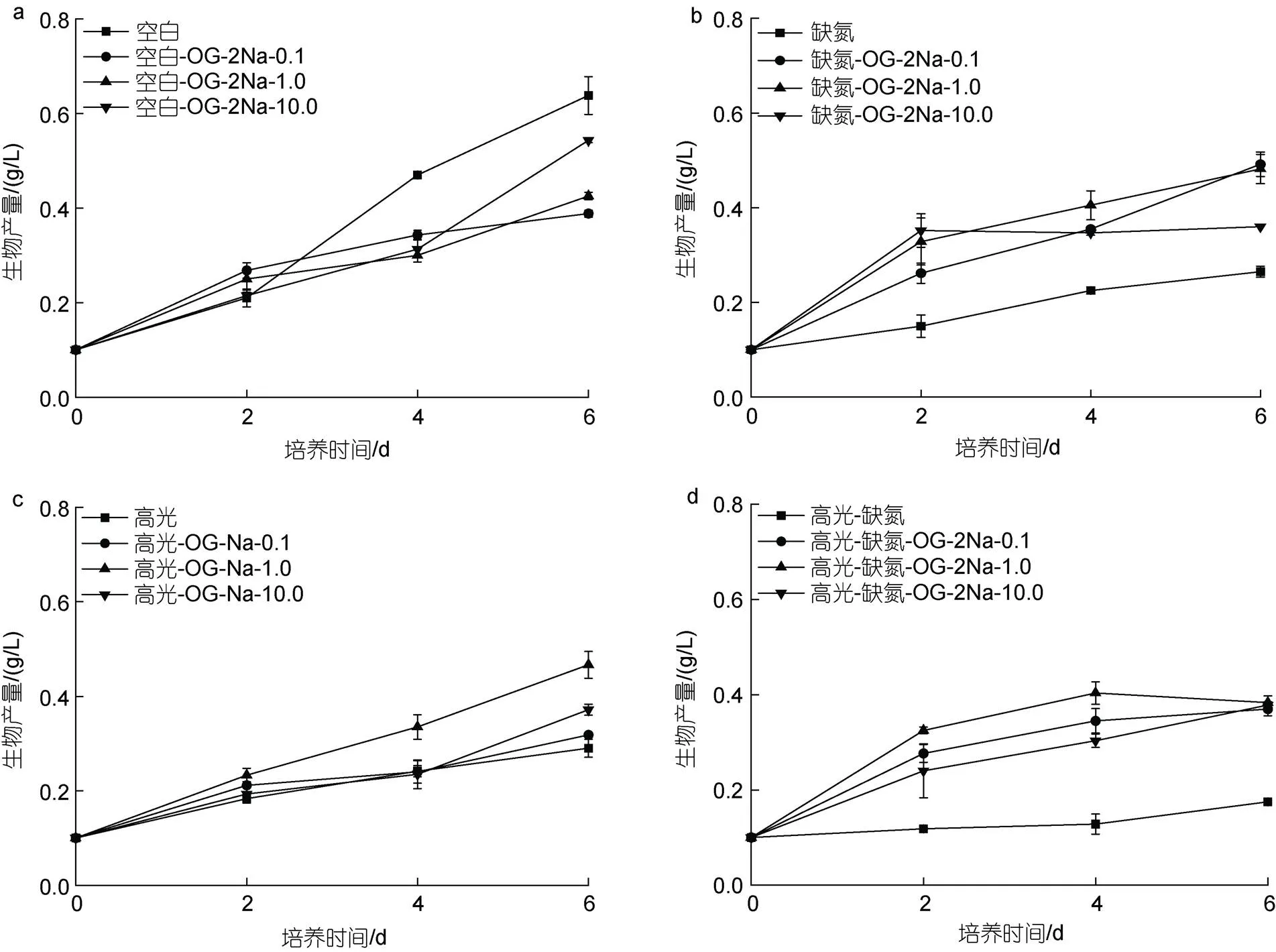
图3 在正常、高光、缺氮和高光缺氮下添加α-酮戊二酸二钠盐(OG-2Na)对雨生红球藻生长的影响
在CK下, 添加外源OG或OG-2Na对细胞的生长有一定的抑制作用且与浓度呈正相关。在HL、DN和HL-DN胁迫下, 添加OG或OG-2Na对细胞的生长均具有一定的促进作用, 且作用模式与添加浓度呈现一定相关性(图4)。
2.2 添加OG及OG-2Na对虾青素含量的影响
在HL、DN和HL-DN胁迫下都能促进雨生红球藻AST的积累, 其积累程度为HL-DN>DN>HL>CK。其中, 培养至第6 d, 在HL、DN及HL-DN胁迫下AST含量分别是20.88、16.81和5. mg/g, 为CK组(4.03 mg/g)的5.18、4.17和1.41倍(图5)。
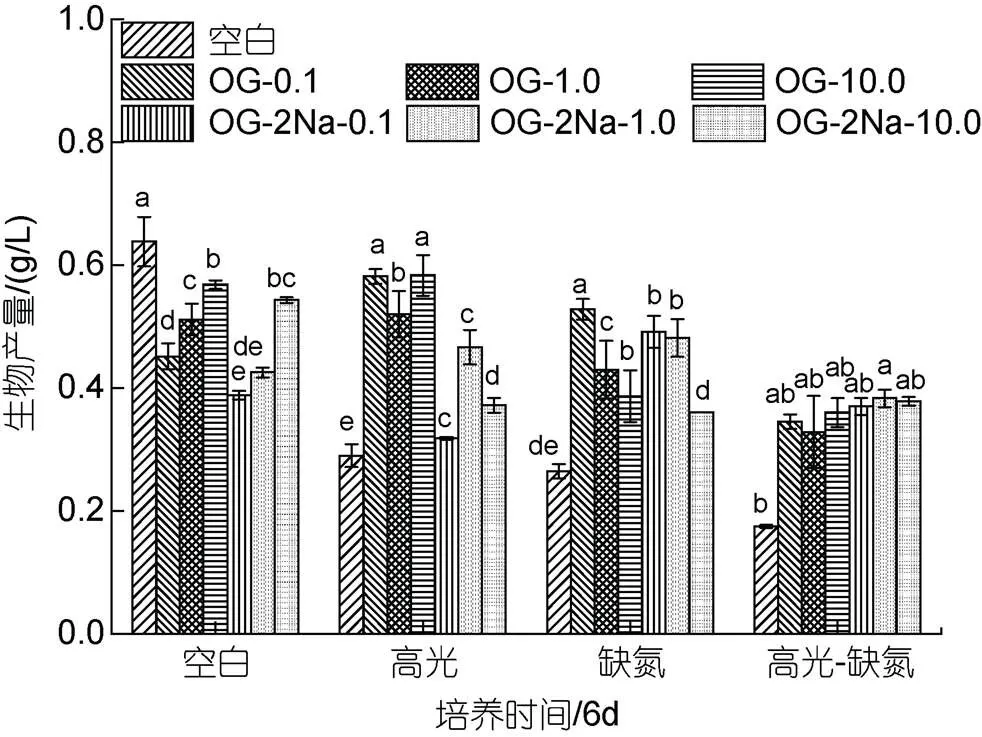
图4 在正常、高光、缺氮和高光缺氮下添加α-酮戊二酸(OG)或α-酮戊二酸二钠盐(OG-2Na)对雨生红球藻生长的影响
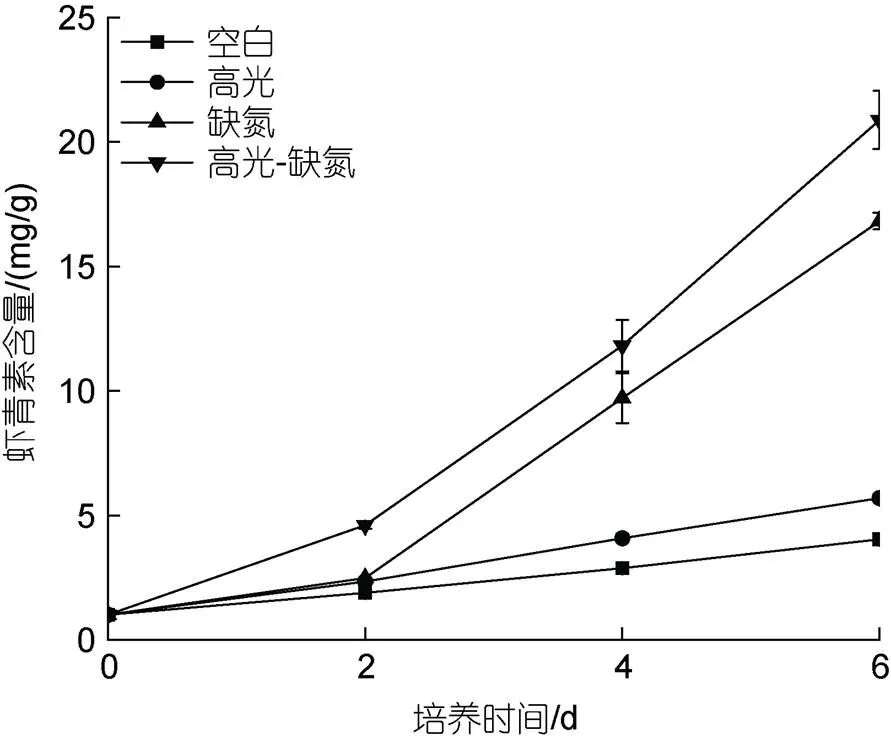
图5 在正常、高光、缺氮和高光缺氮条件下对虾青素含量的影响
在CK下, 添加不同浓度OG都能促进雨生红球AST的含量, 与浓度呈正相关。培养至6 d, 最终AST的含量分别是5.75、6.42和11.02 mg/g, 为CK组(4.03 mg/g)的1.43、1.59和2.73倍(图6a)。在HL下, 不同浓度的OG也能促进AST的含量, 且与浓度剂量不相关。培养至6 d, 最终AST的含量分别是9.41、9.92和13.62 mg/g, 为HL对照组(5.69 mg/g)的1.65、1.74和2.39倍(图6b)。在DN下, 不同浓度的OG在第2 d均促进AST的含量, 但在最后一天的促进效果不显著。但在此过程中AST积累速率的提高。培养至6 d, 最终AST的含量分别是17.48、18.58和19.44 mg/g, 为DN对照组(16.81 mg/g)的1.04、1.10和1.16倍(图6c)。在HL-DN下, 不同浓度的OG不仅促进AST的积累同时加快其积累的速率。培养至6 d, 最终AST的含量分别是24.72、25.86和26.08 mg/g, 为HL-DN对照组(20.88 mg/g)的1.18、1.24和1.25倍(图6d)。
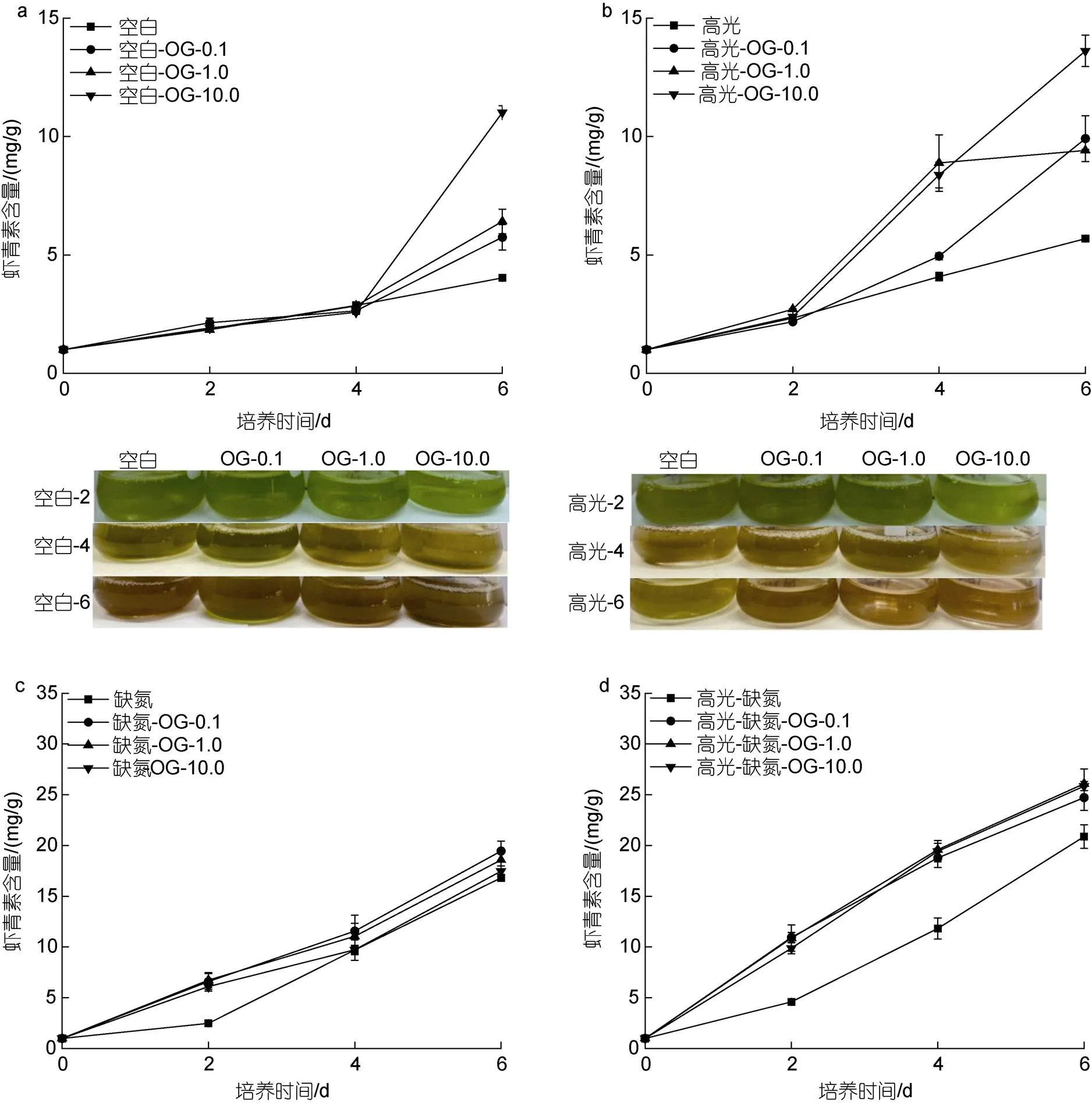
注: 绿色到红色指的是虾青素积累的过程
在CK下, 低浓度的OG-2Na对雨生红球藻AST的含量没有显著影响, 但高浓度促进雨生红球AST的含量。培养至6 d, 最终AST的含量分别是3.51、3.69和7.11 mg/g, 只有CK组(4.03 mg/g)的87.1%、91.6%及176.4%(图7a)。在HL下, 不同浓度的OG-2Na能促进AST的含量, 且与浓度剂量不相关。培养至6 d, 最终AST的含量分别是7.49、9.90和11.40 mg/g, 为HL对照组(5.69 mg/g)的1.32、1.74和2.0倍(图7b)。在DN下, 不同浓度的OG-2Na尽管在培养初期(2 d)均促进AST的含量, 但是对最终的含量促进作用不显著。但在此过程中AST积累的速率提高。培养至6 d, 最终AST的含量分别是15.25、18.78和19.51 mg/g, 为DN对照组(16.81 mg/g)的90.7%、111.7%及116.1% (图7c)。在HL-DN下, 不同浓度OG-2Na不仅促进AST的积累同时加快其积累的速率。培养至6 d, 最终虾青素的含量分别是24.28、25.98和28.29 mg/g, 为HL-DN对照组(20.88 mg/g)的1.16、1.24和1.35倍(图7d)。
在CK下, 添加不同浓度的OG或OG-2Na, 其浓度在10 mg/L时促进AST积累效果显著, 其他浓度下促进效果不显著; 在HL、DN和HL-DN胁迫下, 添加OG或OG-2Na对细胞中AST的含量均具有一定的促进作用, 且促进效应在HL条件中最显著(图8)。
2.3 添加OG及OG-2Na对单位细胞AST含量的影响
在CK下, 低浓度的OG对单位细胞AST的含量影响不大, 但在高浓度10 mg/L时显著促进AST的含量, 达到44.86 pg/cell是相同条件下对照组的2.69倍。
在HL下, 不同浓度OG都能提升单位细胞AST的含量, 10 mg/L浓度时单位细胞AST的含量达到最大, 为53.72 pg/cell是相同条件下对照组的3.09倍; 在DN下, 不同浓度的OG都能提升单位细胞AST的含量, 但与浓度呈负相关。0.1 mg/L浓度时单位细胞AST的含量达到最大, 为39.98 pg/cell是相同条件下对照组的1.89倍; 在HL-DN下, 加入不同浓度的OG都能提升单位细胞AST的含量且与浓度呈正相关, 10 mg/L浓度时单位细胞AST的含量最大, 为43.30 pg/cell是相同条件下处理的2.23倍。综上所述, 在不同的胁迫条件下, 不同浓度的OG对单位细胞AST含量的提高具有不同的效果(图9)。
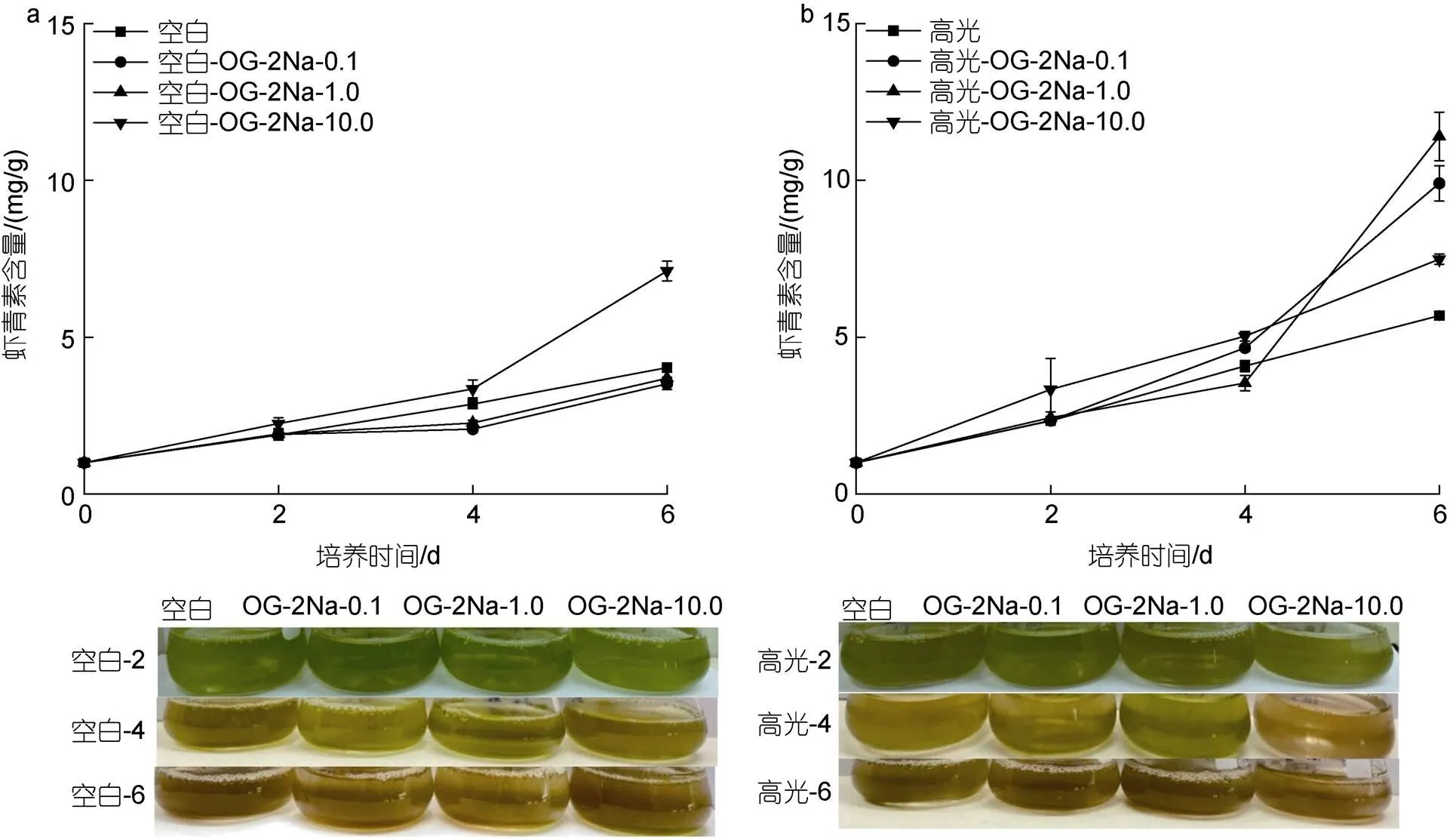
(注: 绿色到红色指的是虾青素积累的过程)
(Note: Green to red refers to the accumulation of astaxanthin)
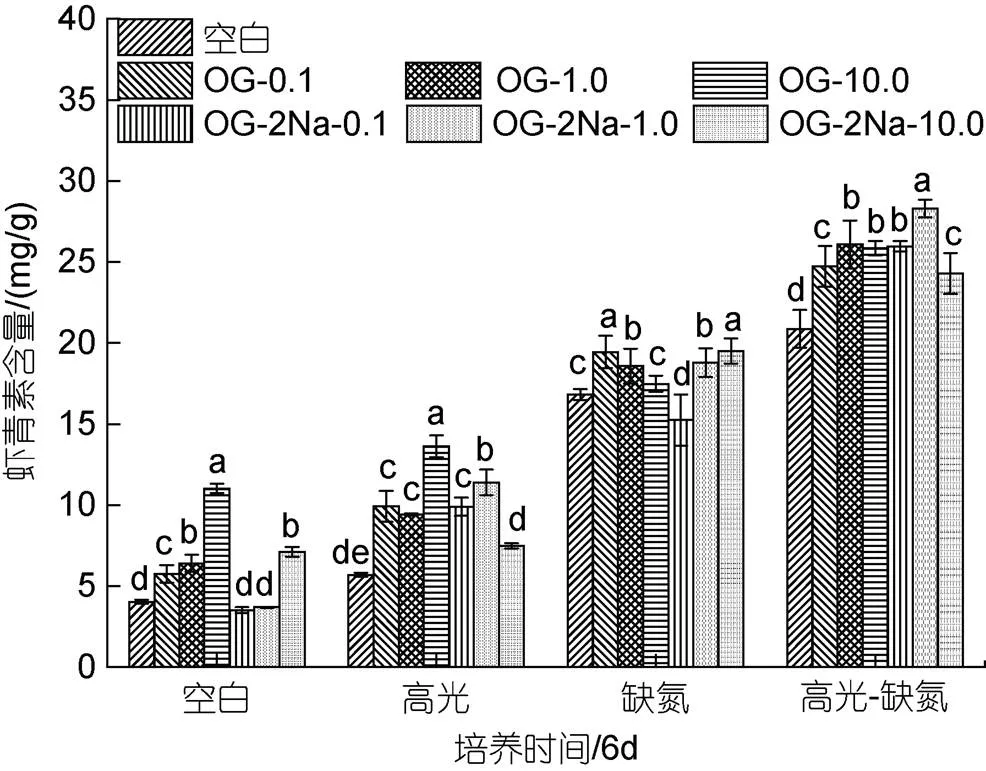
图8 在正常、高光、缺氮和高光缺氮条件下添加α-酮戊二酸(OG)或α-酮戊二酸二钠盐(OG-2Na)对虾青素含量的影响
在CK下, 低浓度的OG-2Na抑制了单位细胞AST的含量, 但在高浓度10 mg/L时显著提高AST的含量, 达到31.38 pg/cell是相同条件下对照组的1.88倍; 在HL下, 不同浓度的OG-2Na都能提升单位细胞AST的含量且与浓度呈正相关, 10 mg/L浓度时单位细胞AST的含量最大, 为55.56 pg/cell是相同条件下处理的2.66倍; 在DN下, 不同浓度的OG-2Na都能提升AST的产量, 但与浓度呈现先增加后降低的趋势, 1 mg/L浓度时单位细胞AST的含量达到最大, 为44.37 pg/cell是相同条件下对照组的2.11倍; 在HL-DN下, 加入不同浓度的OG-2Na都能提升单位细胞AST的含量且与浓度呈正相关, 10 mg/L浓度时单位细胞AST的含量达到最大, 为60.58 pg/cell是相同条件下对照组的2.83倍。综上所述, 在不同的胁迫条件下, 不同浓度的OG-2Na对单位细胞AST含量的提高具有不同的效果(图10)。
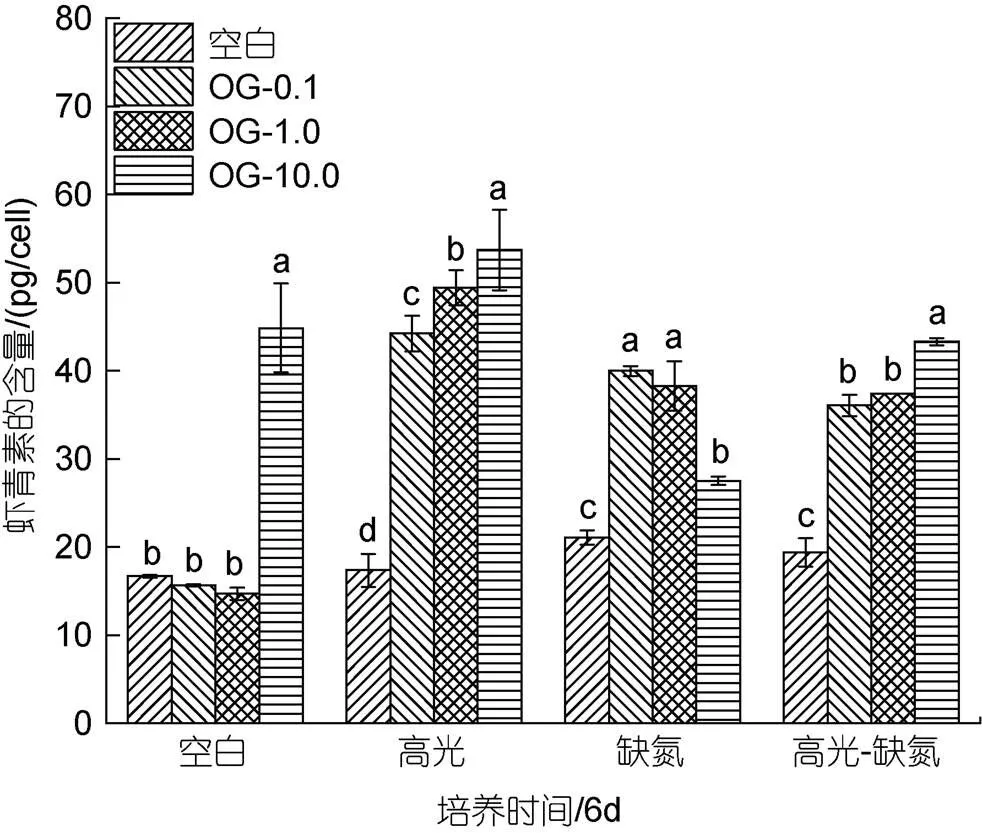
图9 在正常、高光、缺氮和高光缺氮条件下添加α-酮戊二酸(OG)对雨生红球藻单位细胞虾青素含量的影响
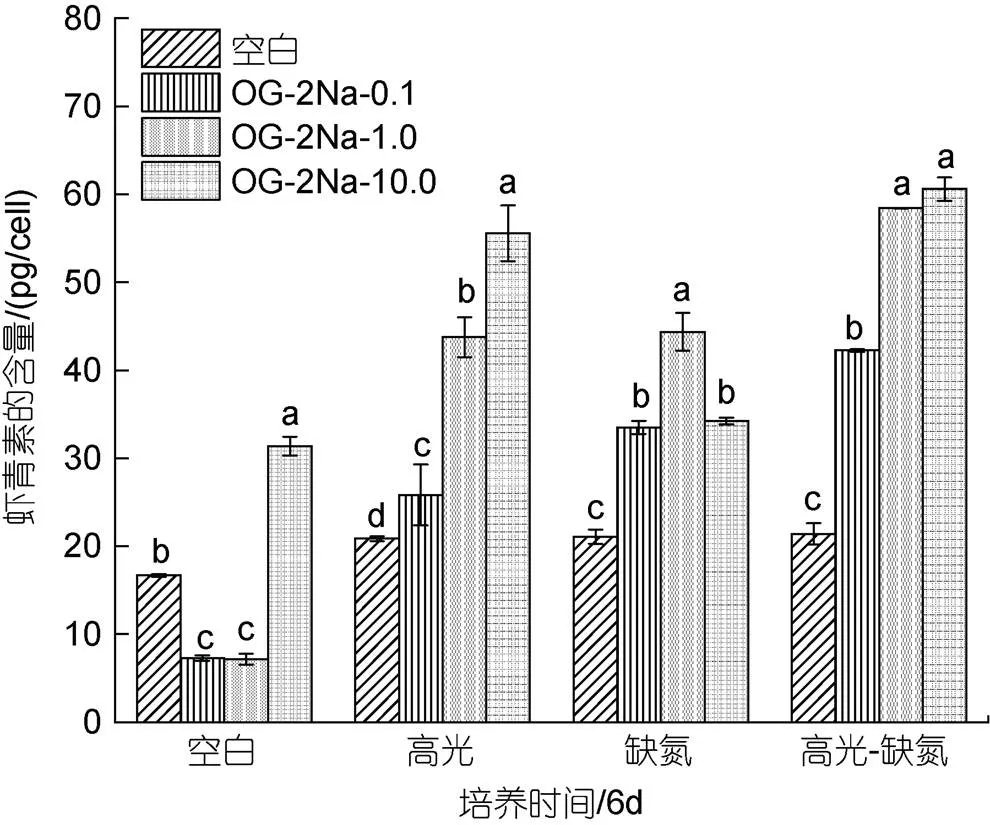
图10 在正常、高光、缺氮和高光缺氮条件下添加α-酮戊二酸二钠盐(OG-2Na)对雨生红球藻单位细胞虾青素含量的影响
3 讨论
挖掘高效胁迫信号、解析诱导机制并建立兼顾细胞生长与AST积累的调控技术解决利用雨生红球藻制备虾青素限制因素的有力措施。与HL或DN等胁迫条件存在的能耗高与显著抑制藻细胞生长等缺点相比。研究表明, 通过添加三羧酸循环中的重要中间代谢产物或植物生长调节剂(Lee, 2016;崔丹丹等, 2018; Lu, 2020; Yu, 2021, 2022)。不仅增强HL或DN的诱导效应, 而且有效缓解上述胁迫条件对雨生红球藻生长的抑制作用, 并显著提高AST的含量。之前研究证实, 雨生红球藻中OG含量的变化对多种胁迫具有不同的响应模式, 暗示其参与AST的积累(Su, 2014)。在混养条件下, 添加OG能有效促进藻细胞AST的积累(Lu, 2019, 2020), 但是在自养条件的效果不清楚。本研究揭示了自养条件下添加OG及其OG-2Na对红球藻生长和虾青素积累的促进作用。
从藻细胞的生长来看, 在胁迫条件下, 通过添加OG和OG-2Na均可显著缓解胁迫条件对细胞的生长抑制作用(图4)。这个结果与之前研究基本一致, 在HL下, 通过添加62.5 mg/L的花生四烯酸或0.16%的CO2显著能促进藻细胞的生物量(王丽丽等, 2010; 叶鑫等, 2021)。从雨生红球藻的AST含量情况来看, 在CK条件下, 通过添加高浓度的OG和OG-2Na均可显著提高AST的含量, 甚至可达到HL条件下的效果(图8)。这个结果与之前研究基本一致, 在HL下, 通过添加0.05 mg/L的玉米素或1 mmol/L的1-氨基环丙烷-1-羧酸均能促进藻细胞虾青素的含量(Lee, 2016; 崔丹丹等, 2018)。
在胁迫条件下, 添加OG和OG-2Na对AST含量的提高效应与胁迫条件和浓度均相关, 本实验中效果最显著的是在HL条件下。研究表明, 在高光胁迫下培养至7天, 向培养基中添加0.6 mmol/L柠檬酸三钠虾青素产量增加了11.9% (Du, 2021)。在DN和HL-DN条件尽管对最终的AST含量影响不大, 但是显著增强了AST积累的速率。可能的原因是本身DN和HL-DN胁迫条件已经能充分诱导雨生红球藻中AST含量的提升。这与之前的研究结果不完全一致, 例如, 添加延胡索酸和DN耦合策略显著加速了虾青素的合成, 10 mmol/L延胡索酸在第7天和第12天分别使细胞虾青素含量增加了1.75和1.47倍(Yu, 2021)。添加草酰乙酸和DN耦合策略促进雨生红球藻生产虾青素, 10 mmol/L草酰乙酸在第7天使细胞虾青素含量提高了约7.18倍(Yu, 2022)。在HL-DN条件下, 通过添加45 mmol/L乙酸钠能够显著提高虾青素的含量(Huang, 2006)。添加中间代谢产物对雨生红球藻虾青素积累的促进作用与胁迫条件和使用浓度密切相关。
雨生红球藻中AST含量不但与藻细胞生物量相关, 而且与单位细胞中AST的积累也密切相关。在CK条件下, 通过添加高浓度的OG和OG-2Na均可显著提高单细胞中AST的含量, 甚至可达到传统胁迫条件下的效果(图9和图10)。这些结果暗示在CK条件下通过添加OG和OG-2Na是一种简单高效且低能耗的高效诱导AST积累的技术。在HL条件下, 通过添加10 mg/L的OG和OG-2Na对单位细胞AST的含量提升具有显著效果。前人研究表明, 在HL条件, 添加0.6 mmol/L柠檬酸三钠或10 mg/LOG-2Na均能显著提高单位细胞AST含量(Lu, 2020; Du, 2021)。
4 结论
本研究揭示了添加OG或OG-2Na对雨生红球藻生长和虾青素积累的促进作用。添加OG或OG-2Na不但可以缓解胁迫条件对细胞生长的抑制作用, 而且显著提高AST含量。在正常条件下, 通过添加10.0 mg/L的OG或OG-2Na也能显著提高AST的含量, 这是一种低能耗与高效诱导的方式。
王丽丽, 李惠咏, 龚一富, 2010. 花生四烯酸对雨生红球藻细胞生长和虾青素含量的影响[J]. 水产科学, 29(3): 142-146.
叶鑫, 虞新磊, 胡朝阳, 等, 2021. CO2和乙酸钠对雨生红球藻生长及其虾青素积累的影响[J]. 核农学报, 35(3): 613-622.
孙倩, 梁威威, 贾琳, 等, 2014. α-酮戊二酸对低水氮下冬小麦产量相关性状的影响[J]. 安徽农业科学, 42(3): 671-674.
崔丹丹, 杨柳, 孙雪, 等, 2018. 玉米素和水杨酸对雨生红球藻()生长及虾青素积累的影响[J]. 海洋与湖沼, 49(3): 682-691.
崔红利, 许文鑫, 崔玉琳, 等, 2021. 光诱导雨生红球藻虾青素积累的信号通路转录组分析[J]. 生物工程学报, 37(4): 1260-1276.
游泳, 管斌, 孔青, 等, 2011. 混合培养对雨生血球藻虾青素产量的影响[J]. 中国酿造(6): 38-41.
AHIRWAR A, MEIGNEN G, JAHIR KHAN M,, 2021. “Light modulates transcriptomic dynamics upregulating astaxanthin accumulation in: a review” [J]. Bioresource Technology, 340: 125707.
CHEN H, LAURENT S, BÉDU S,, 2006. Studying the signaling role of 2-oxoglutaric acid using analogs that mimic the ketone and ketal forms of 2-oxoglutaric acid [J]. Chemical & Biology, 13(8): 849-856.
CUI H L, XU W X, ZHU X L,, 2021a. Characterization of adiacylglycerol acyltransferase 1 and its potential in unsaturated fatty acid-rich triacylglycerol production [J]. Front Plant Science, 12: 771300.
CUI H L, YU X N, WANG Y,, 2013. Evolutionary origins, molecular cloning and expression of carotenoid hydroxylases in eukaryotic photosynthetic algae [J]. BMC Genomics, 14: 457.
CUI H L, ZHAO C C, XU W X,, 2021b. Characterization of type-2 diacylglycerol acyltransferases inreveals their functions and engineering potential in triacylglycerol biosynthesis [J]. BMC Plant Biology, 21(1): 20.
DU F C, HU C Y, SUN X,, 2021. Transcriptome analysis reveals the promoting effect of trisodium citrate on astaxanthin accumulation inunder high light condition [J]. Aquaculture, 543: 736978.
FOYER C H, PARRY M, NOCTOR G. 2003. Markers and signals associated with nitrogen assimilation in higher plants[J]. Journal of Experimental Botany, 54(382): 585-593.
HUANG J C, CHEN F, SANDMANN G, 2006. Stress-related differential expression of multiple β-carotene ketolase genes in the unicellular green alga[J]. Journal of Biotechnology, 122(2): 176-185.
LEE C, AHN J W, KIM J B,, 2018. Comparative transcriptome analysis ofon astaxanthin biosynthesis in response to irradiation with red or blue LED wavelength [J]. World Journal of Microbiology and Biotechnology, 34(7): 96.
LEE C, CHOI Y E, YUN Y S, 2016. A strategy for promoting astaxanthin accumulation inby 1-aminocyclopropane-1-carboxylic acid application [J]. Journal of Biotechnology, 236: 120-127.
LI X, WANG X Q, DUAN C L,, 2020. Biotechnological production of astaxanthin from the microalga[J]. Biotechnology Advances, 43: 107602.
LIU X J, WANG Y, LAURINI E,, 2013. Structural requirements of 2-oxoglutaric acid analogues to mimic its signaling function [J]. Organic Letters, 15(18): 4662-4665.
LU Z, DAI J C, ZHENG L L,, 2020. Disodium 2-oxoglutarate promotes carbon flux into astaxanthin and fatty acid biosynthesis pathways in[J]. Bioresource Technology, 299: 122612.
LU Z, ZHENG L L, LIU J,, 2019. A novel fed-batch strategy to boost cyst cells production based on the understanding of intracellular carbon and nitrogen metabolism in[J]. Bioresource Technology, 289: 121744.
MA R J, THOMAS-HALL S R, CHUA E T,, 2018. Gene expression profiling of astaxanthin and fatty acid pathways inin response to different LED lighting conditions [J]. Bioresource Technology, 250: 591-602.
SHAH M R, LIANG Y M, CHENG J J,, 2016. Astaxanthin-producing green microalga: from single cell to high value commercial products [J]. Frontiers in Plant Science, 7: 531.
SU Y X, WANG J X, SHI M L,, 2014. Metabolomic and network analysis of astaxanthin-producingunder various stress conditions [J]. Bioresource Technology, 170: 522-529.
XI T Q, KIM D G, Roh S W,, 2016. Enhancement of astaxanthin production usingwith novel LED wavelength shift strategy [J]. Applied Microbiology and Biotechnology, 100(14): 6231-6238.
YU W J, ZHANG L T, ZHAO J,, 2021. Exogenous sodium fumarate enhances astaxanthin accumulation inby enhancing the respiratory metabolic pathway [J]. Bioresource Technology, 341: 125788.
YU W J, ZHANG L T, ZHAO J,, 2022. Enhancement of astaxanthin accumulation inby exogenous oxaloacetate combined with nitrogen deficiency [J]. Bioresource Technology, 345: 126484.
YUAN Y Z, OU J Q, WANG Z Q,, 2007. Regulation of carbon and nitrogen metabolisms in rice roots by 2-oxoglutarate at the level of hexokinase [J]. Physiologia Plantarum, 129(2): 296-306.
ZHAO M X, JIANG Y L, HE Y X,, 2010. Structural basis for the allosteric control of the global transcription factor NtcA by the nitrogen starvation signal 2-oxoglutarate [J]. Proceedings of the National Academy of Sciencesof the United States of America, 107(28): 12487-12492.
ZHAO Y, HOU Y Y, CHAI W J,, 2020. Transcriptome analysis ofof multiple defensive systems against nitrogen starvation [J]. Enzyme and Microbial Technology, 134: 109487.
PROMOTING EFFECTS OF Α-KETOGLUTARATE AND ITS SODIUM SALT ON GROWTH AND ASTAXANTHIN ACCUMULATION IN
ZHANG Hao-Jie1, LI Wang-Ning1, LIANG Meng-Jing1, LI Ya-Nan1, ZHANG Chun-Hui1, JI Chun-Li1, LI Run-Zhi1, CUI Yu-Lin2, QIN Song2, CUI Hong-Li1
(1. College of Agriculture, Institute of Molecular Agriculture and Bioenergy, Shanxi Agricultural University, Taigu 030801, China; 2. Key Laboratory of Coastal Biology and Biological Resources Utilization, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China)
has been considered an ideal cell factory for astaxanthin (AST) production. Although it has been reported that adding α-ketoglutaric acid (OG) can effectively promote AST accumulation in algal cells under mixotrophic condition, its effect on autotrophic cells is unclear. Therefore, autotrophiccells were cultured under normal (CK, control), high light (HL), deficient nitrogen (DN) and high-light- deficient-nitrogen (HL-DN) conditions. The effects of different concentrations of OG and its disodium salt (OG-2Na) on growth and AST content were evaluated. Results show that compared to CK, the addition of OG or OG-2Na could significantly enhance the growth of algal cells under HL, DN, and HL-DN stresses. After 6 days of culture, the maximum biomass content under HL, DN, and HL-DN stresses was 0.58, 0.53, and 0.38 g/L, respectively, which were approximate 2.0 times that of the group without addition under the same conditions. Interestingly, the AST accumulation was significantly promoted by adding OG or OG-2Na under stress conditions. After 6 days of culture, the maximum AST contents under HL, DN and HL-DN stresses were 13.62, 19.51, and 28.29 mg/g, respectively, which were 2.39, 1.16, and 1.35 times of those in the non-supplemented group under the same conditions. Under stress conditions, the AST content per cell was significantly increased by adding OG or OG-2Na. For OG and OG-2Na supplementation, the highest AST content per cell reached 53.72 and 60.58 pg/cell under HL and HL-DN conditions, respectively, which were 3.09 and 2.83 times of those without supplementation under the same condition. It is worth noting that AST content under CK condition with 10.0 mg/L OG or OG-2Na addition was significantly higher than that under the same stresses without supplement. Therefore, the addition of OG or OG-2Na could not only significantly relieve the inhibition of HL, DN, or HL-DN stress condition on the growth of algal cells, but also significantly increase AST content. This study provided a new way to increase AST production under normal conditions in.
; α-Ketoglutarate; growth; astaxanthin accumulation; promoting effect
Q945
10.11693/hyhz20220400090
*国家自然科学基金, 31902394号, 41876188号; 山西省高等学校科技创新基金, 2021L119号; 山西农业大学科技创新基金, 2018YJ16号; 山西省优秀博士来晋工作奖励基金, SXYBKY2019036号; 山西农谷建设科研专项基金, SXNGJSKYZX201906号。张豪杰, 硕士研究生, E-mail: m15713969552@163.com
崔红利, 硕士生导师, 副教授, E-mail: cuihongli@sxau.edu.cn
2022-04-06,
2022-06-01

