施肥方式对设施番茄产量及土壤细菌多样性、群落结构的影响
刘晓梅,苏文英,纪伟,梁长东,任立凯
(连云港市农业科学院,江苏 连云港 222000)
近年来,由于设施蔬菜栽培有较高的经济效益,其栽培面积一直呈上升趋势,已成为农业增效、农民增收的重要途径,在我国农业结构化调整中占据重要位置。截至2014年,江苏省设施蔬菜为主的设施农业面积达到75.7万hm2,占耕地面积比重达16.5%[1],其中,苏北设施蔬菜以产值高的茄果类蔬菜为主,其面积占江苏65%以上[2]。然而,由于肥料使用过多、连作与重茬等不合理的种植方式,导致土壤盐渍化、酸化等问题突出,土壤结构被破坏,养分含量失衡,微生物群落结构改变,蔬菜品质与产量逐年下降[3]。因此,逐步优化施肥方式成为今后设施蔬菜可持续发展的必然选择。
土壤微生物作为土壤生态链中的关键组成部分,直接参与土壤结构的形成,推动着土壤养分循环和能量流动,在维持土壤生态功能中扮演着重要角色[4],其中细菌在土壤微生物数量中占有绝对优势,决定着土壤微生物总量的分布,影响着有机物的分解和转化[5]。设施蔬菜种植过程中土壤微生物多样性、群落组成和结构的变化可以作为土壤受损程度和质量变化的重要预警指标,了解土壤微生物及功能群的变化对揭示设施蔬菜栽培条件引起的土壤质量退化微生物学机制及保持设施土壤可持续性具有重要意义。
目前,有关设施番茄土壤微生物的研究主要围绕种植模式(套种、轮作)[6-9]、养分吸收[10-11]、管理模式[12]等方面。关于不同施肥方式对设施番茄土壤微生物多样性及群落结构的研究还相对较少。本研究以不施肥为对照(CK),分析了化肥(T1)、中药渣有机肥配施化肥(T2)、复合微生物肥料配施化肥(T3)、生物有机肥配施化肥(T4)4种施肥方式对设施番茄产量的影响,并利用Illumina MiSeq平台,对这4种施肥方式下土壤进行16S rRNA高通量测序分析。探讨不同施肥方式对土壤中微生物多样性和群落结构的变化情况,阐明不同施肥方式对设施番茄土壤细菌群落及各类群间的关系,为本地区设施番茄合理施肥提供参考依据。
1 材料与方法
1.1 供试材料
试验在江苏省连云港市农业科学院东辛试验基地塑料大棚中进行。供试土壤基本理化性状为:pH 7.9,有机质含量19.98 g·kg-1,全氮 1.9 g·kg-1,全磷1.8 g·kg-1,全钾14.3 g·kg-1。供试作物番茄为粉果,由淮安市农业科学研究院提供。供试肥料为15%金正大复合肥(N 15%、P2O515%、K2O 15%);中药渣有机肥含有机质≥45%,N 1.78%、P2O50.92%、K2O 2.63%,由江苏好徕斯肥业有限公司提供;25%复合微生物肥料(N 10%、P2O57%、K2O 8%)含枯草芽孢杆菌0.2亿·g-1,有机质≥6%,由江苏肥之星生物科技有限公司提供;生物有机肥含巨大芽孢杆菌、固氮类芽孢杆菌、胶冻样类芽孢杆菌共0.2亿·g-1,有机质40%,由扬州森大肥业有限公司提供。
1.2 试验设计
试验共设5个处理,T1:每667 m2复合肥160 kg,T2:每667 m2复合肥50 kg+中药渣有机肥1 000 kg,T3:每667 m2复合微生物肥料250 kg;T4:每667 m2生物有机肥1 200 kg;CK:不施肥处理组。每个处理设4次重复,共16个小区,每小区面积为12.6 m2,每个小区种植三垄,每垄2行,每行8棵(行间距35 cm,株距30 cm),完全随机区组设计。开花坐果后每两周追肥1次,每667 m2追施复合肥10 kg,共7次,每667 m2中微量元素肥(顺欣N 15%、P2O515%、K2O 30%、TE)10 kg 共7次。
1.3 土壤样品采集与分析
土壤样品采集时间为2019年7月19日,用环刀取各处理耕层(0~20 cm)土壤样品,每小区多点混合采样,去除植物根系和石块装入无菌袋中带回实验室,-80 ℃冰箱保存用于土壤微生物DNA提取。
1.4 各项指标测定
于采收期测定每个小区番茄植株产量,并计算产量。土壤细菌群落分析由上海派森诺生物科技股份有限公司(上海)完成,采用Illumina MiSeq平台对细菌群落DNA片段进行双端(Paired-end)测序。
1.5 计算和统计方法
采用QIIME进行土壤细菌群落相关指标分析;采用Excel 2012软件制图;采用SAS 9.0对番茄产量及土壤细菌多样性进行显著性分析;采用 Qiime 软件计算Bray-Curtis距离,使用R软件绘制主坐标分析图,进行多样本比较分析。
2 结果与分析
2.1 番茄产量
从表1可以看出T2、T3、T4处理组番茄产量显著高于T1和CK处理组,三者之间无显著差异。相较于CK处理组,T1、T2、T3、T4分别增产12.1%、35.3%、39.1%、41.5%,其中T4处理组的番茄产量最高,每667 m2为4 628 kg。

表1 不同处理番茄产量
2.2 土壤细菌群落OTU聚类分析
基于16S rRNA的高通量测序,共获得有效序列1 811 453,其中T1处理组样品平均有效序列数为113 814,T2处理组样品平均有效序列数为126 531,T3处理组样品平均有效序列数为136 999,T4处理组样品平均有效序列数为120 436。CK处理组样品平均有效序列数为106 038,对每组样品随机抽取91 276条序列进行抽平,在0.95相似水平下进行聚类,得到每组样本OTU数。T1土壤中细菌群落OTU数量是10 379,T2土壤中细菌群落OTU数量是10 146,T3土壤中细菌群落OTU数量是8 811,T4土壤中细菌群落OTU数量是10 644,CK土壤中细菌群落OTU数量是9 417。各处理共同的 OTU数为2 055,特有的OTU数相对较多,分别为4 636、3 729、3 270、4 509、3 712,占各处理土壤细菌群落OTU数量的44.7%、36.8%、37.1%、42.4%、39.4%。
2.3 土壤细菌Alpha多样性分析
土壤样品的Alpha 多样性结果见表2。5个土壤样本覆盖率均达到99.4%以上,说明测序深度较高,基本能覆盖样品中所有物种,能够真实反映土壤细菌群落组成。细菌群落结构丰富度和多样性主要是由代表OTUs统计的物种数、表征菌群丰度的Chao1指数、进化多样性以及反映菌群多样性的香浓指数和辛普森指数来表示。从表2可以看出,T2处理组土壤Chao1指数、物种数、进化多样性显著高于CK处理组;T4处理组的物种数、进化多样性指数也显著高于CK处理组,T1、T3处理组与CK无显著差异。
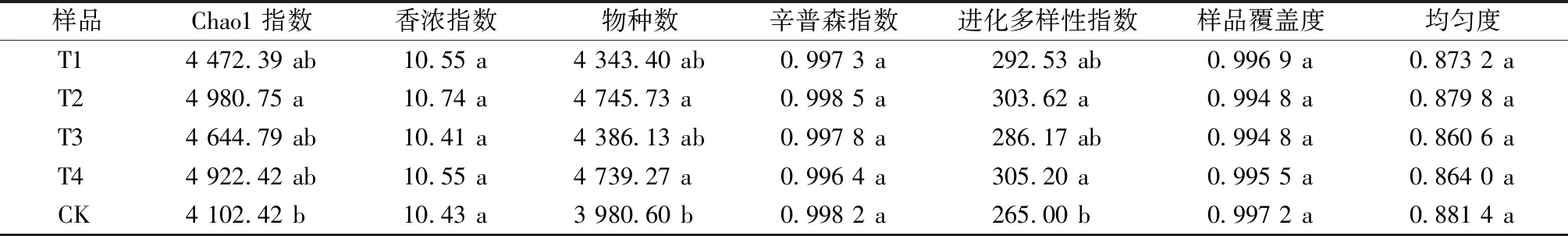
表2 不同处理下土壤细菌菌群丰度、多样性指标
2.4 土壤细菌群落的Beta多样性分析
基于Bray-Curtis距离对不同施肥处理下土壤成分进行主坐标分析(PCoA),结果显示第1主成分(PC1)和第2主成分(PC2)的贡献率分别为29.2%和19.3%(图1)。主坐标分析二维图中不同样本的距离越近,不同样本中物质组成多样性越相似。样本T3、T2和CK距离相近,说明两个样本间的物种组成多样性较为相似。T4、T1与CK的距离较远,说明T4、T1与CK样本的细菌群落多样性差异较大。
2.5 土壤细菌群落结构分析
在门水平上,不同施肥方式下土壤样品中优势细菌从高到低依次为变形菌门Proteobactreia、放线菌门Actinobacteria、酸杆菌门Acidobacteria、芽单胞菌门Gemmatimonadetes、拟杆菌门Bacteroidetes、绿弯菌门Chloroflexi、厚壁菌门Firmicutes(图2)。与CK相比,各施肥处理中变形菌门相对丰度均升高;T2、T3、T4处理组中放线菌门的相对丰度升高;T2、T3处理组中的酸杆菌门、芽单胞菌门的相对丰度升高;仅T1处理组中厚壁菌门的相对丰度升高。仅T2处理组中绿弯菌门的相对丰度升高;T1、T4处理组中拟杆菌门的相对丰度升高。
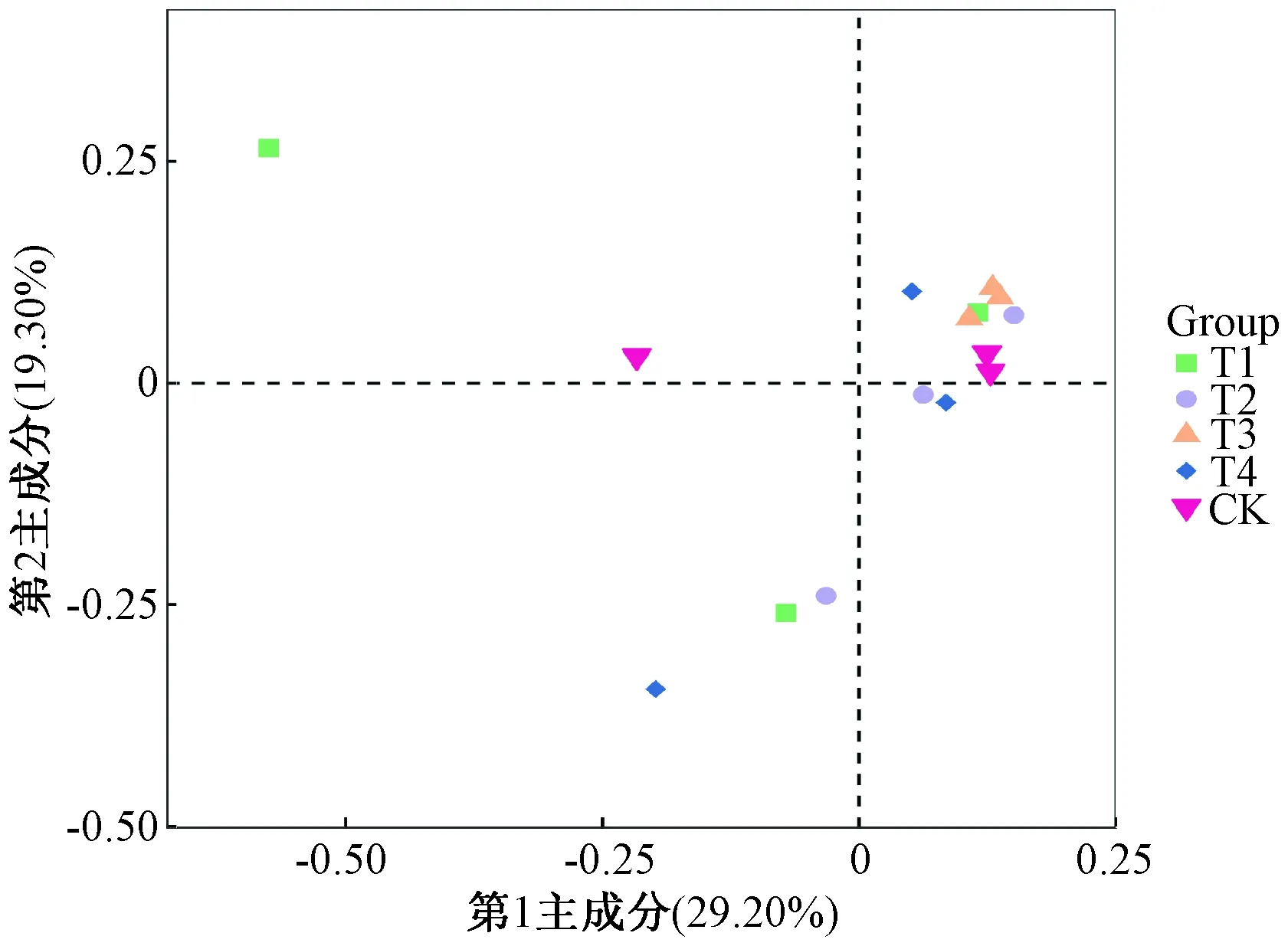
图1 不同施肥处理下土壤细菌群落的PCoA分析
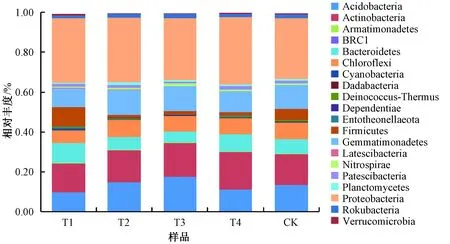
图2 门水平上细菌相对丰度
在属水平上,不同施肥方式下土壤样品中优势菌属基本相似分别为苍白杆菌属Ochrobactrum、MND1、Vibrionimonas、芽单胞菌属Gemmatimonas、RB41、Gaiella、鞘脂单胞菌属Sphingomonas、Subgroup10、Iamia(图3)。与CK相比,各施肥处理中Vibrionimonas、链霉菌属Streptomyces、水沉积物杆菌属Ilumatobacter的相对丰度均升高,Gaiella的相对丰度均降低;T2、T3、T4处理组中Subgroup 10、Haliangium的相对丰度升高;T1、T3、T4处理组中苍白杆菌属、Pelomonas的相对丰度升高;T2、T3中RB41、芽单胞菌属、消化螺菌属Nitrospira、MND1的相对丰度升高;T2、T4中Iamia、类诺卡氏菌属Nocardioides、交替赤杆菌属Altererythrobacter的相对丰度升高;仅T1中乳酸菌属Lactobacillus、LachnospiraceaeNK4A136 group、劳尔氏菌属Ralstonia的相对丰度升高;仅T3中溶杆菌属Lysobacter、鞘氨醇单胞菌属Sphingomonas的相对丰度升高。
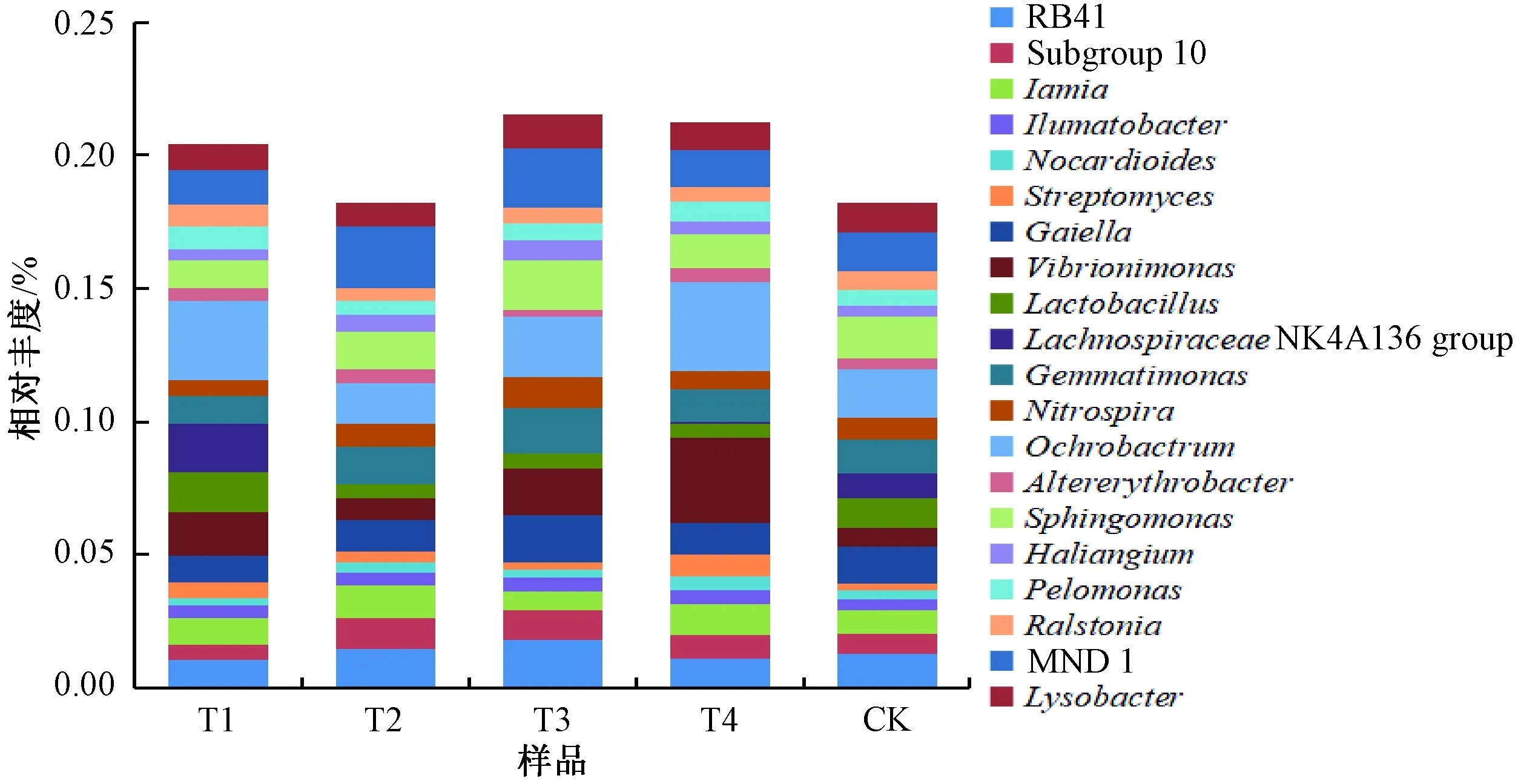
图3 属水平上细菌相对丰度
3 小结与讨论
土壤微生物群落结构受植物、微生物与土壤理化环境互作的影响[13]。本研究分析了不同施肥方式对设施番茄产量及土壤细菌多样性、群落结构的影响。从土壤样品的Alpha多样性分析结果可以看出,中药渣有机肥、生物有机肥配施化肥土壤细菌丰度显著高于不施肥处理组,与孙家骏等[14]研究结果相似。这是因为,适量施用有机肥能够显著提高土壤中有机质、氮磷钾等养分含量,有利于微生物繁殖,一定程度上提高了土壤微生物的多样性,改变土壤细菌群落结构[15]。然而,施用化肥以及复合微生物肥料配施化肥土壤细菌丰度和多样性与不施肥处理无显著差异,这与蔡杰等[16]的研究一致,其研究发现,未施肥区与常规化肥施肥区土壤微生物多样性相似。
大量研究表明,不同施肥方式能够影响土壤微生物类群的相对丰度[16-18]。在本研究中,不同施肥方式下土壤中的优势菌门基本相似,分别为变形菌门、放线菌门、酸杆菌门、芽单胞菌门、绿弯菌门、拟杆菌门,这与之前的研究结果相似[19-20],但各处理中优势菌门的相对丰度具有一定差异,这说明土壤微生物群落结构和多样性受植物种类、土壤类型等因素的影响[16]。各施肥处理土壤中变形菌门相对丰度均升高,中药渣有机肥、复合微生物肥料、生物有机肥配施化肥处理组土壤中放线菌门的相对丰度升高,与王庆等[21]、姜蓉等[22]、靳晓拓等[23]的研究结果一致。放线菌是一类具有重要生物活性的功能性微生物,它在各种生态环境中广泛存在,能产生种类繁杂和富含生物活性的次级代谢产物,还能产生各类酶、有机酸等,有助于分解有机物和矿物质[24];同时它具有良好的抗菌活性和耐盐碱作用[25-26]。中药渣有机肥、复合微生物肥料、生物有机肥配施化肥通过提高土壤有益微生物的多样性,改变土壤微生物的群落结构,维持土壤微生物稳态,促进番茄生长,从而增加番茄的产量。本研究中,相较于不施肥处理组,中药渣有机肥、复合微生物肥料、生物有机肥配施化肥均能显著提高番茄产量。
基于土壤细菌群落的 PCoA,发现不同施肥方式下土壤微生物群落分成两大类,T3、T2和CK距离相近,说明两个样本间的物种构成较为相似。T4、T1与其他样本的距离较远,说明T4、T1样本的细菌群落构成与其他样本差异较大。这说明,生物有机肥配施化肥不仅显著增加土壤微生物的丰度,还改变了微生物的群落结构;中药渣有机肥仅显著提高了土壤微生物的丰度,其微生物群落结构并无太大的变化;施用化肥仅改变了土壤微生物群落构成,微生物的丰度、多样性并无太大变化,这与之前桑文等[27]的研究结果不同。
综上所述,不同施肥方式不仅可以影响设施番茄土壤细菌的多样性与相对丰度,也能在一定程度上改变土壤的细菌群落结构。本研究中,生物有机肥配施化肥对设施番茄的施用效果最好,不仅可以提高番茄产量,还能够丰富土壤细菌多样性,改变土壤细菌群落结构,起到改良土壤的作用。

