Notch信号通路中Notch2在胰腺癌中表达及临床意义
李东伟,依马木买买提江·阿布拉,李海军,周婧博,张 波
(1.深圳市罗湖医院集团罗湖区人民医院普外科,广东 深圳 518000;2.新疆医科大学附属肿瘤医院肝胆胰外科,新疆 乌鲁木齐 830006)
胰腺癌的发病率在全球范围呈逐年上升趋势[1],但早期诊断困难,确诊时往往已到中晚期,手术切除术率很低,放化疗后仍容易复发和转移[2]。而随着医疗技术的发展,国内外学者研究发现,Notch信号通路在胰腺癌的发生、发展中起着重要的作用[3]。Mazur等[4]发现,选择性阻断Notch2而非Notch1可以使胰腺癌演变进程停止,延长生存期。因此,本研究从转录、翻译两个水平检测Notch2的表达情况及其与胰腺癌患者临床病理特征的关系,以期探索胰腺癌发生发展新的分子机制。
1 资料与方法
1.1一般资料:收集新疆医科大学附属肿瘤医院2015年2月~2017年2月胰十二指肠手术标本48例,术后经病理确诊全部为胰腺导管腺癌患者,手术后即刻切取胰腺癌组织和配对的癌旁组织(距癌3 cm组织),置液氮贮存。48例患者术前均未经放化疗,33~80岁,平均58.3岁,其中男28例,女20例。病理检查:其中中高分化癌21例,低分化癌27例;肿瘤直径≤2 cm 23例,>2 cm 25例;胰腺癌分期(AJCC,第8版)标准进行分期,Ⅰ期和Ⅱ期20例,Ⅲ期和Ⅳ期28例;浸润深度T1~T2期22例,T3~T4期26例;有淋巴结转移18例,无淋巴结转移30例;CA19-9>34 U/ml 25例,CA19-9≤34 U/ml23例。本次研究经过本院医学伦理委员会同意。
1.2方法
1.2.1采用反转录-聚合酶链反应(RT-PCR)检测Sufu表达:按30 mg新鲜胰腺组织加入1 ml的Trizol试剂提取组织总RNA,然后用紫外分光光度计检测总RNA样品的纯度和浓度,按照两步法RT-PCR试剂盒说明书将1 μg总RNA反转录成cDNA后进行PCR反应。Notch2引物:上游5′-CAACCCCAGATAGGAAGCAG-3′,下游5′-GAGCCTTTTCCCCATATTCC-3′,扩增片段102 bp;β-actin引物,上游5′-GGGACCTGACTGACTACCTC-3′,下游5′-CGTCATAC TCCTGCTTGCTG-3′,扩增片段543 bp。引物均由上海生工生物工程公司合成。PCR反应条件:94℃预变性2 min,接着94℃变性30 s、退火30 s,然后72℃延伸30s,30个循环,最后72℃终延伸2 min。退火温度分别为57℃、56℃。所得PCR终产物10 μl用2%琼脂糖凝胶电泳,BIO-RAD Gel Doc XR凝胶成像系统进行灰度扫描,后用Image Lab 4.0软件分析结果。测定目的基因Notch2扩增条带与内参基因β-actin扩增条带的光密度比值,以此作为Notch2基因mRNA的相对表达量。
1.2.2采用Western印迹检测Notch2蛋白表达:新鲜胰腺组织加入蛋白质裂解液后冰上研磨提取组织总蛋白,所用一抗、二抗均购自Santa Cruz公司。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,取50 μg蛋白样品,用100 V恒压SDS-PAGE分离,电转移到PVDF膜上,用封闭液室温下封闭PVDF膜1 h,分别加入Notch2兔抗人抗体(1∶300)、β-actin兔抗人抗体(1∶1 000),4℃孵育过夜,用1×TBST漂洗,分别于相应的二抗孵育30 min后洗膜。加入ECL化学发光试剂,用Bio-Rad Chemi DOC MP全能型成像系统拍照,并用Image Lab 4.0软件分析。测定目的基因Notch2蛋白条带与内参基因β-actin蛋白条带的光密度比值,以此作为Notch2基因蛋白的相对表达量。
1.3统计学方法:应用SPSS22.0统计软件进行t检验。
2 结果
2.1RT-PCR检测结果:胰腺癌组织中Notch2 mRNA的相对表达量为0.713±0.032,胰腺癌旁组织中Notch2 mRNA的相对表达量为0.312±0.026,胰腺癌组织中Notch2 mRNA的表达量是胰腺癌旁组织的(2.285±0.294)倍,差异有统计学意义(P<0.05)。见图1、表1。

注:1,2,3为胰腺癌组织;4,5,6为胰腺癌旁组织
2.2Western印迹检测结果:胰腺癌组织中Notch2蛋白的相对表达量为0.621±0.047,胰腺癌旁组织中Notch2蛋白的相对表达量为0.297±0.052,胰腺癌组织中Notch2蛋白的表达量是胰腺癌旁组织的(2.091±0.169)倍,差异有统计学意义(P<0.05)。见图2、表1。

表1 Notch2 mRNA和蛋白在胰腺癌组织和癌旁组织平均表达水平差异

注:1,2为胰腺癌组织;3,4为胰腺癌旁组织
2.3胰腺癌组织中Notch2 mRNA的表达与临床病理特征的关系:低分化胰腺癌Notch2 mRNA平均表达水平(0.853±0.061)高于中高分化胰腺癌(0.578±0.029),Notch2 mRNA在Ⅲ期、Ⅳ期胰腺癌组平均表达水平(0.876±0.043)高于Ⅰ期、Ⅱ期胰腺癌组(0.532±0.037),差异均有统计学意义(P<0.05)。Notch2 mRNA表达水平与胰腺癌的分化程度和TNM分期明显相关(P<0.05),与患者年龄、性别、肿瘤直径、浸润深度、淋巴结转移和CA19-9无明显相关。见表2。
2.4胰腺癌组织中Notch2蛋白的表达与临床病理特征的关系:低分化胰腺癌Notch2 蛋白平均表达水平(0.738±0.038)高于中高分化胰腺癌(0.509±0.052),Notch2 蛋白在Ⅲ期、Ⅳ期胰腺癌组平均表达水平(0.783±0.054)高于Ⅰ期、Ⅱ期胰腺癌组(0.413±0.035),差异均有统计学意义(P<0.05)。Notch2 蛋白表达水平与胰腺癌的分化程度和TNM分期明显相关(P<0.05),与患者年龄、性别、肿瘤直径、浸润深度、淋巴结转移和CA19-9无明显相关(P>0.05)。见表2。
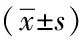
表2 胰腺癌组织 Notch2 mRNA和蛋白的表达与临床病理特征的关系
3 讨论
Notch信号通路普遍存在于各种生命体中,不仅决定细胞命运、胚胎、个体发育及成体微环境稳定,而且参与了多种肿瘤的发生发展[5],近年来研究发现Notch信号通路与胰腺癌的发生发展密切相关[3,6]。在胰腺发育过程中有四种Notch基因表达,其中Notch2在胰芽分支和导管发生时,局限表达于胰腺胚胎导管细胞,所以推测Notch2是胰腺干细胞的标志物之一[7-8]。Mazur等[4]研究Kras小鼠发现,在胰腺上皮内瘤变(PanINs)进展过程中,Notch1在胰腺腺泡细胞呈高表达,Notch2在胰腺导管细胞呈高表达,进一步采用γ-分泌酶抑制剂阻断Notch信号通路发现PanINs进展延缓,提示Notch信号通路在调控PanINs进展中起关键作用。
本研究RT-PCR和Western印迹检测结果均显示:胰腺癌组织中Notch2 mRNA和蛋白表达均高于癌旁组织。胰腺癌组织中Notch2 mRNA和蛋白表达与胰腺癌的分化程度和TNM分期明显相关,与患者年龄、性别、肿瘤直径、浸润深度、淋巴结转移和CA19-9无明显相关。
综上所述,Notch信号通路中Notch2基因在胰腺癌组织中高表达,且该基因表达量与胰腺癌的分化程度和TNM分期有关,表明Notch信号通路参与了胰腺癌的发生发展。进一步研究Notch2在胰腺癌中如何表达调控,将有助于阐明胰腺癌发生发展的分子机制。

