雪貂食管黏膜下腺体在胃食管生理稳态下清酸的作用机制
李 博,黄 河,王 磊,周海宁
根据癌症统计报表显示,胃食管连接部癌及食管癌发病率排恶性肿瘤第6位[1]。胃食管连接部(esophagogastric junction, EGJ)肿瘤是位于食管胃中间特殊部位的肿瘤,以腺癌为主,鳞癌发生率较低[2]。目前EGJ肿瘤发病机制尚不明确,可能与胃食管反流病(gastroesophageal reflux disease,GERD)相关,而GERD是抗反流防御机制减弱和反流物对食管黏膜攻击作用的结果[3]。食管的抗反流防御机制包括抗反流屏障、食管清酸作用、食管黏膜屏障,其中食管的清酸作用极其重要[4,5],关于食管黏膜下腺体(esophageal submucosal glands, SMG)在清酸机制中的意义研究甚少。雪貂是一类哺乳动物,属于鼬科[6,7],其解剖学和生理学特性与人类相似,故用于各种人类疾病发病机制的研究[7]。本课题组前期实验已证实雪貂食管中存在与人类食管类似的SMG结构,所以本文基于雪貂SMG在胃食管生理稳态下,通过检测胃食管黏膜分泌含有黏蛋白的黏液及分泌囊性纤维化跨膜电导调节器(cystic fibrosis transmembrane conductance regulator,CFTR)对碳酸氢钠调控,对胃食管清酸作用及对胃食管黏膜的保护进行了研究。同时探讨发育情况下SMG中WNT信号LEF1的变化,为进一步研究胃食管反流模型下损伤修复机制干细胞的作用及与肿瘤的发生提供依据。
1 材料与方法
1.1 样本采集 选取无锡珊瑚礁公司提供的6~8个月成年雪貂食管制成冷冻和石蜡组织。通过采集出生1 d、3 d、5 d、7 d和14 d的雪貂食管制作冷冻蜡块组织进行形态学及分子标记物观察,实验动物的饲养条件均保持一致。本研究通过宁夏医科大学总医院伦理委员会审批(2020-584)。
1.2 试剂 抗体生产厂家及浓度:抗小鼠MUC5A抗体(1∶150;Cat#MS-145-PO, thermofisher)和抗兔MUC5B抗体(1∶200;Cat#2223, Santa Cruz Biotechnology, INC)、抗兔LEF1(1∶500;AF647)。
1.3 制作石蜡切片 将石蜡切片组织送至宁夏医科大学总医院病理科进行包埋,横断面切成5 μm进行苏木精-伊红染色法(HE染色)、过碘酸雪夫染色(PAS)、免疫组化染色。
1.4 HE染色 二甲苯浸泡10 min,入浓度由高到低梯度乙醇浸泡各5 min,入水洗涤10 s,染色液浸泡8 min,流动水洗涤10 s,分化液分化2 s,流动水洗涤10 min,入伊红染液浸泡1 min,依次入浓度由低到高梯度乙醇脱水各5 min,二甲苯透明10 min,封片剂封片。通风,显微镜采图。
1.5 PAS染色 脱蜡,流动水洗1次,超纯水洗2次,氧化剂内静置4~9 min,流动水洗涤1次,超纯水洗涤2次,将其放入Schiff染色液中,避光静置,充分反应20 min,流动水洗涤10 min,入苏木精染色液充分浸泡2 min,分化液分化2~5 s,流动水洗涤10~15 min,使其返蓝,依次入浓度由低到高梯度乙醇脱水各5 min,接着入二甲苯溶液进行透明,封片剂封片。通风,显微镜采图。
1.6 免疫组化染色 65 ℃温箱烤片2 h,梯度二甲苯乙醇脱蜡,蒸馏水冲洗,EDTA 9.0高压修复,喷气后计时3 min,自然冷却,3%过氧化氢水溶液10 min,PBS溶液浸泡10 min,PBS洗涤3次,加入一抗试剂,移至37 ℃恒温箱反应90 min,PBS洗涤3次,加入一抗相对应的二抗,移至37 ℃恒温箱反应30 min,PBS洗涤3次,加入适量DAB显色10 min,流动水冲洗结束显色,入苏木精染液浸泡1 min,流动水冲洗,分化液分化2 s,流动水洗涤,放入氨水中返蓝,流动水洗涤,依次入浓度由低到高梯度乙醇进行脱水,入二甲苯透明,封片剂进行封片通风。
1.7 免疫荧光染色 冷冻切片用10%、15%、20%的糖梯度处理过夜。将OCT(最佳切割温度)与20%葡萄糖溶液依次混合入食管腔,OCT包埋,-80 ℃保存,进行免疫荧光和原位杂交。染色前将OCT组织切片放置室温30 min充分干燥,放入4% PFA再次固定5 min,后于DBB封闭1 h,加一抗过48 h,再次取出后放置室温加入二抗1 h,后封片固定,每步操作之间使用PBS 处理5 min。LEF1染色需要抗原修复,将枸橼酸盐(pH6)放入水浴锅预热至95 ℃以上,放入切片开始计时20 min取出,放置至室温,加一抗过夜,复温后加Biotin将其信号再次扩大放置1 h,最后加Avidin放置1 h,封片。
1.8 LECTIN染色 染色前将OCT组织切片放置室温30 min充分干燥,用3%BSA封片通透,加BIOTIN,主要包括双花扁豆凝集素(dolichos biflorus, DBA)、鸡冠珊瑚树凝集素(erythrina cristagalli lectin,ECL)、非偶联西非单叶豆凝集素Ⅰ(unconjugated griffonia simplicifolia lectin Ⅰ, GSLⅠ)、非偶联西非单叶豆凝集素Ⅱ(GSL Ⅱ)、大豆凝集素(soybean agglutinin,SBA)、他卡林生物化合物凝集素(tacalin biotylated)、荆豆凝集素(ulex)、麦胚凝集素(wheat germ agglutinin, WGA)、花生凝集素(peanut agglutinin,PNA)、凝集素伴刀豆凝集素(concanavalin A, ConA)、红腰果E型凝集素(phytohaemagglutinin E, PHA-E)和红腰果L型凝集素(PHA-L),阴性对照室温放置1 h,AVIDIN室温放置40 min,封片。
1.9 原位杂交
1.9.1 探针变性 将探针在75 ℃恒温水浴中温育 5 min,立即置 0 ℃,5~10 min,使探针变性。
1.9.2 标本变性 (1)烤片2~3 h;(2)标本浸在 70~75 ℃的体积分数70%甲酰胺/2×SSC的变性液中变性2~3 min;(3)立即按顺序将标本经体积分数 70%、体积分数 90%和体积分数 100%冰乙醇系列脱水,干燥。
1.9.3 杂交 将已变性或预退火的 DNA 探针 10 μl 滴于已变性并脱水的玻片标本上,盖上玻片,封片,置于潮湿暗盒中 37 ℃杂交过夜(约 16 h)。
1.9.4 洗脱 (1)用刀片轻轻将盖玻片揭掉;(2)将已杂交的玻片标本放置于已预热 42~50 ℃的体积分数 50%甲酰胺/2×SSC中洗涤3 次;(3)在已预热42~50 ℃的 1×SSC中洗涤3次;(4)在室温下,将玻片标本于2×SSC中轻洗一下;(5)自然干燥;(6)取200 μl 复染溶液(DAPI 染液)滴加在玻片标本上,盖上盖玻片。
1.9.5 杂交信号的放大(适用于使用生物素标记的探针) (1)在玻片的杂交部位加 150 μl 封闭液Ⅰ,用保鲜膜覆盖,37 ℃温育20 min;(2)去掉保鲜膜,再加 150 μl avidin-FITC 于标本上,用保鲜膜覆盖,37 ℃继续温育 40 min;(3)取出标本,将其放入已预热 42~50 ℃的洗脱液中洗涤3次;(4)在玻片标本的杂交部位加 150 μl 封闭液 II,覆盖保鲜膜,37 ℃温育 20 min;(5)去掉保鲜膜,加 150 μl antiavidin 于标本上,覆盖新的保鲜膜,37 ℃温育40 min;(6)取出标本,将其放入已预热 42~50 ℃的新洗脱液中,洗涤3次;(7)重复步骤(1)、(2)、(3),再于2×SSC中室温清洗一下;(8)取出玻片,自然干燥;(9)取 200 μl PI/antifade 染液滴加在玻片标本上,盖上盖玻片,封片。
1.9.6 荧光显微镜观察 FISH 结果:探针所在的位置发出红色荧光。

2 结 果
2.1 采用HE、PAS染色对成年雪貂食管SMG形态学进行分析 HE染色结果显示,成年雪貂食管SMG为食管黏膜肌层下方结缔组织,其在食管中分布存在差异,食管近端和远端分布较中间多,SMG由单层柱状细胞组成,细胞核位于基底部;PAS染色结果提示SMG中优势腺体细胞呈阳性表达并分泌中性黏多糖(图1)。
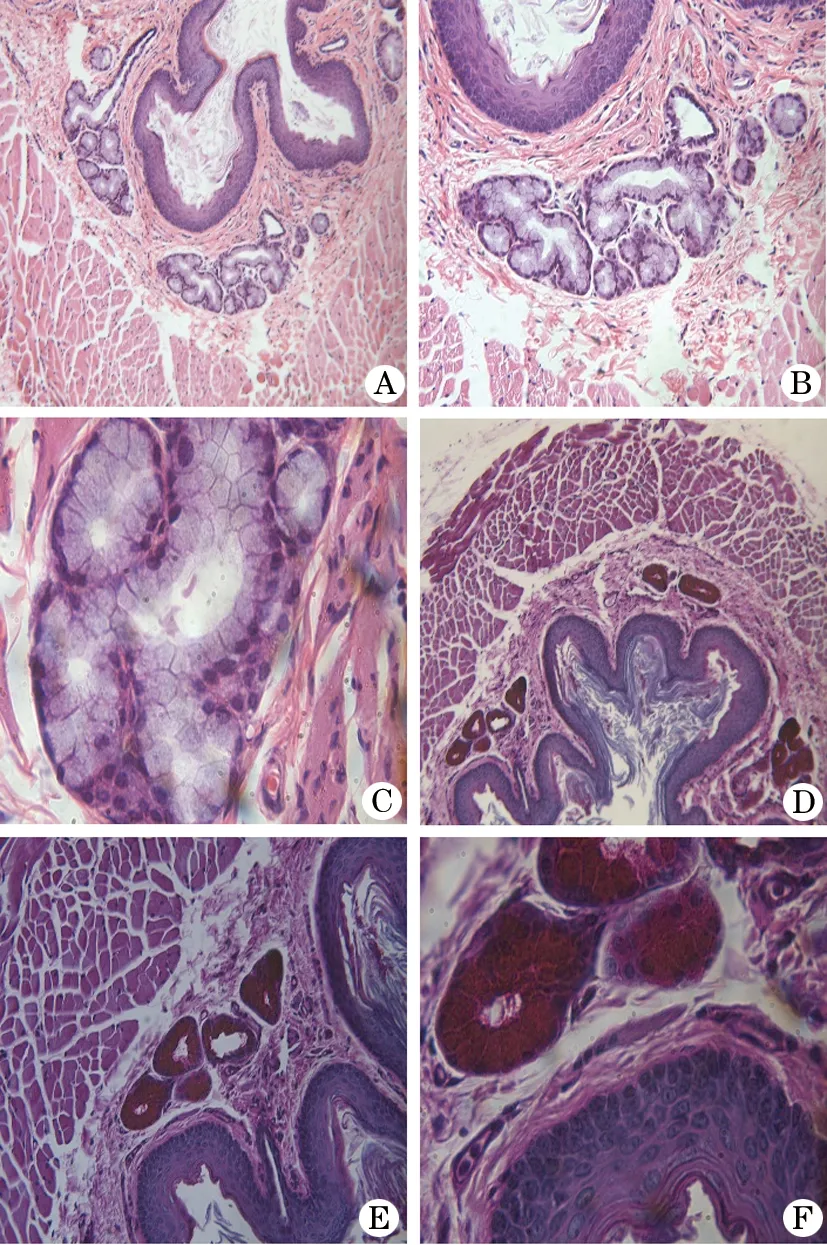
图1 采用HE、PAS染色对成年雪貂食管黏膜下腺体进行形态学分析
2.2 不同凝集素在成年雪貂食管SMG中与不同细胞结合特点 凝集素染色结果显示,在成年雪貂食管SMG中不同类型细胞膜可特异性结合不同凝集素,黏液细胞结合DBA、ECL、GSL Ⅰ、GSL Ⅱ、SOYBEAN、tacalin biotylated、ules、Triticum vulgare Wheat germ agglutinin(WGA),导管细胞结合GSL Ⅰ、GSL Ⅱ,上皮细胞结合ECL、PNA和WGA,浆液细胞结合ConA、PHA-E和PHA-L(图2)。
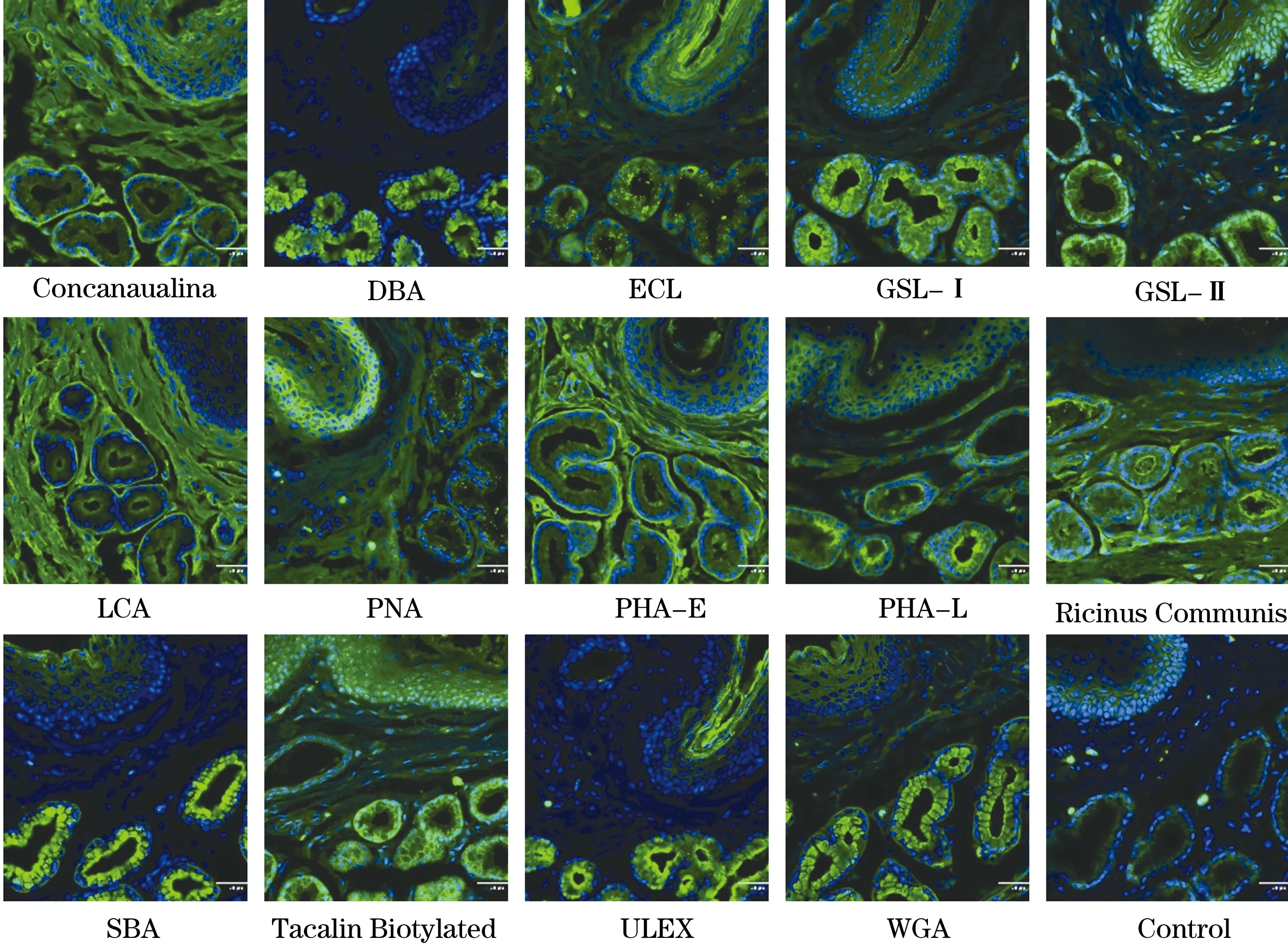
图2 免疫荧光检测不同凝集素与成年雪貂食管黏膜下腺体中不同细胞的结合情况(×200)
2.3 分别使用免疫组化及免疫荧光染色分析MUC5B和MU5AC在成年雪貂食管SMG中表达情况 免疫组化Mucin染色结果显示,雪貂食管SMG黏液细胞胞质及腺体管腔内呈棕黄色着色(阳性表达)。MU5AC使用647 nm波长白光激发,可见腺体黏液细胞胞质及腺体管腔内呈白色(阳性表达)。MUC5B使用555 nm波长红光激发,可见腺体黏液细胞胞质及腺体管腔内呈红色(阳性表达,图3)。

图3 MUC5B和MU5AC在成年雪貂食管黏膜下腺体中表达情况
2.4 免疫原位杂交检测CFTR在成年雪貂食管SMG中表达情况 免疫原位杂交结果提示,在成年雪貂食管SMG中可见腺体中有红色特异性染色,呈阳性表达(图4)。
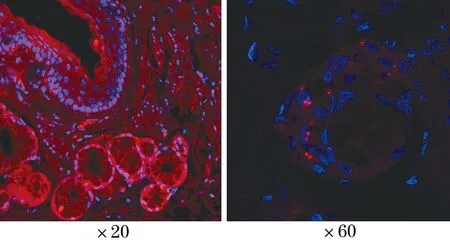
图4 原位杂交检测CFTR在成年雪貂食管黏膜下腺体中的表达(CFTR染色)
2.5 免疫荧光检测新生雪貂食管中LEF1的表达 免疫荧光结果显示,LEF1的表达在不同出生时间段的雪貂食管中存在差异。使用波长为555 nm红光激发,雪貂出生1 d食管上皮细胞中有红色(阳性表达),出现在一个或多个散在细胞,未见明确发育的腺体,在雪貂出生3~7 d可见发育腺体中有红色,14 d时腺体中未见红色(图5)。

图5 免疫荧光检测新生雪貂食管中LEF-1的表达(10×)
3 讨 论
人食管腺体是一种位于黏膜下层的外分泌腺[8],SMG腺泡是由单层柱状上皮细胞组成。本课题组前期研究显示,在雪貂食管近端和远端存在SMG集中[9]。从HE染色看,SMG中有腺体细胞呈红色,因为细胞质中充满黏原颗粒,是分泌物的前身。在固定染色的切片上,黏原颗粒被溶解,常呈现空泡状,故细胞质着色很浅。当细胞质内充满黏原颗粒时,细胞核被挤到细胞基部的一侧,被挤压成半月状或扁平形,着色较深。有些腺体细胞向深层凹陷形成管状,这些腺细胞的分泌物是黏稠的液体,其化学成分主要是蛋白多糖,当分泌物排出后,细胞核又变成圆形或椭圆形。PAS结果显示雪貂SMG中有腺体细胞呈红色,并且分泌蛋白多糖,说明了其对食管有清酸作用。


淋巴细胞结合增强因子(LEF1)是 Wnt 通路关键基因之一,在多种肿瘤细胞中呈高表达,可促进癌细胞的增殖、侵袭[14-17]。本研究通过对LEF1的追踪发现,随着雪貂食管发育成熟,LEF1的表达显著降低。在胃食管结合部中多潜能干细胞,可能位于黏膜下腺,在没有损伤情况的稳态下,SMG参与到上皮细胞的维持。Wnt 信号在发育过程中必不可少,但受到严格调控,在健康成人组织该通路基本被封闭。LEF1参与到Wnt信号通路的细胞增殖,所以,通过观察雪貂食管早期发育过程中LEF1的表达追踪其发展。在雪貂出生1 d可以看到上皮中1个或更多细胞LEF1表达阳性,出生3~7 d可以看到LEF1在腺体发育中的表达,当腺体的分化成熟LEF1的表达消失。所以其可能在上皮更新时可再次被激活,调控形成新的上皮细胞。显然我们对于其机制了解有限,其转化的过程需要进一步谱系追踪。LEF1随着出生发育表达明显下降,但大量研究表明,在很多肿瘤或肿瘤细胞株中检测到了 LEF-1 的表达,甚至高表达。LEF1 参与的 Wnt 信号通路不仅与细胞增殖和癌变的调控有关,而且也与肿瘤的发生、发展关系密切。这将会成为本课题组后续研究的重点,SMG对稳态的维持及损伤有应答,存在一种假说,其可能机制是在修复过程中通过WNT信号LEF1调控的异常最终导致肿瘤的发生。

